|
При исследовании скелетных структур клеточного ядра показано активное фосфорилирование белков, особенно интенсивное в препаратах из опухолей. Фосфорилируются главным образом высокомолекулярные белки внутриядерного матрикса. В ядерном матриксе из гепатомы 27 крыс обнаружено фосфорилирование по тирозиновому остатку. Выявлен активный протеолиз фосфопротеинов при относительной устойчивости к гидролизу нефосфорилированных белков. Изучена ассоциация с ядерным матриксом белков теплового шока. Показано, что биосинтез белков ядерного матрикса подавляется тепловым шоком в меньшей степени, чем биосинтез белков других клеточных структур, что однако не наблюдается в препаратах из опухолей. В ядерном матриксе гепатом 27 и 22а выявлен фибронектин, отсутствующий в ядрах нормальных клеток. Показано, что подавление транскрипции рентгеновским облучением тем интенсивнее, чем больше длина петель ДНК, прикрепленных к ядерному матриксу, что связывается с нарушением упругого напряжения суперспирализованной ДНК. Итоги исследований и литература по проблеме изложены в монографиях по организации клеточного ядра и по скелетным структурам клеточного ядра.
Большое внимание уделяется изучению НК-полимераз и репликативтивных комплексов различных организмов. Найден способ селективного подавления 3'-5'-экзонуклеазнойе активности ДНК-полимеразы I (фрагмента Кленова) из клеток Е. coli с помощью фторидиона, который нашел практическое применение в структурно-функциональных исследованиях ДНК-полимераз. Из клеток шелкопряда, инфицированных вирусом ядерного полиэдроза (ВЯП), выделен репликативный комплекс,содержащий ДНК-полимеразу а и праймазу. В зависимости от ионных условий этот комплекс способен или инициировать синтез de novo, или осуществлять элонгацию прсдсуществующих затравок. При инициации синтеза праймаза синтезирует олигорибонуклеотиды длиной около 10 кДа, которые используются как затравки для синтеза ДНК. Обнаружена новая "раскрученная форма" двунитевой плазмидной ДНК, которая служит эффективной матрицей для инициации синтеза. Двунитевые участки в матрицах типа "шпилек" служат барьерами для элонгации ДНК, которые могут быть преодолены с помощью ДНК-связывающих белков. Впервые показано, что комплекс с ДНК-полимеразой а способен заполнять однонитевые бреши в ДНК полностью. На модели куколок шелкопряда, инфицированных ВЯП, изучены динамика синтеза различных групп вирусоспецифичных белков, включая фосфопротеиды, ДНК-связывающие белки и структурные белки вируса. Идентифицированы два фосфопротеида, рр35 и ррВ (основной ДНК-связывающий белок), которые являются структурными белками вируса. Впервые обнаружено приобретение шелкопрядом нечувствительности к ВЯП в ходе куколочного периода и исследованы возможные причины нечувствительности к вирусу.
Открыт новый путь эксцизионной репарации основания, который осуществляется ДНК-полимеразой дельта без участия фактора процессивности PCNA. Этот путь репарации ДНК, по всей вероятности, реализуется в экстремальных ситуациях в клетке: при пониженном количестве других репаративных ДНК-полимераз и PCNA.
(рис. 1).
Совместно с группой Иммунологии лаборатории
Клеточных и молекулярных основ гистогенеза
исследовано развитие иммунной системы млекопитающих.
Сотрудниками нашей лаборатории выявлен неизвестный ранее способ миграции В- и Т-лимфоцитов из красной пульпы в белую пульпу развивающейся селезенки крысы.
(рис. 4 - 5).
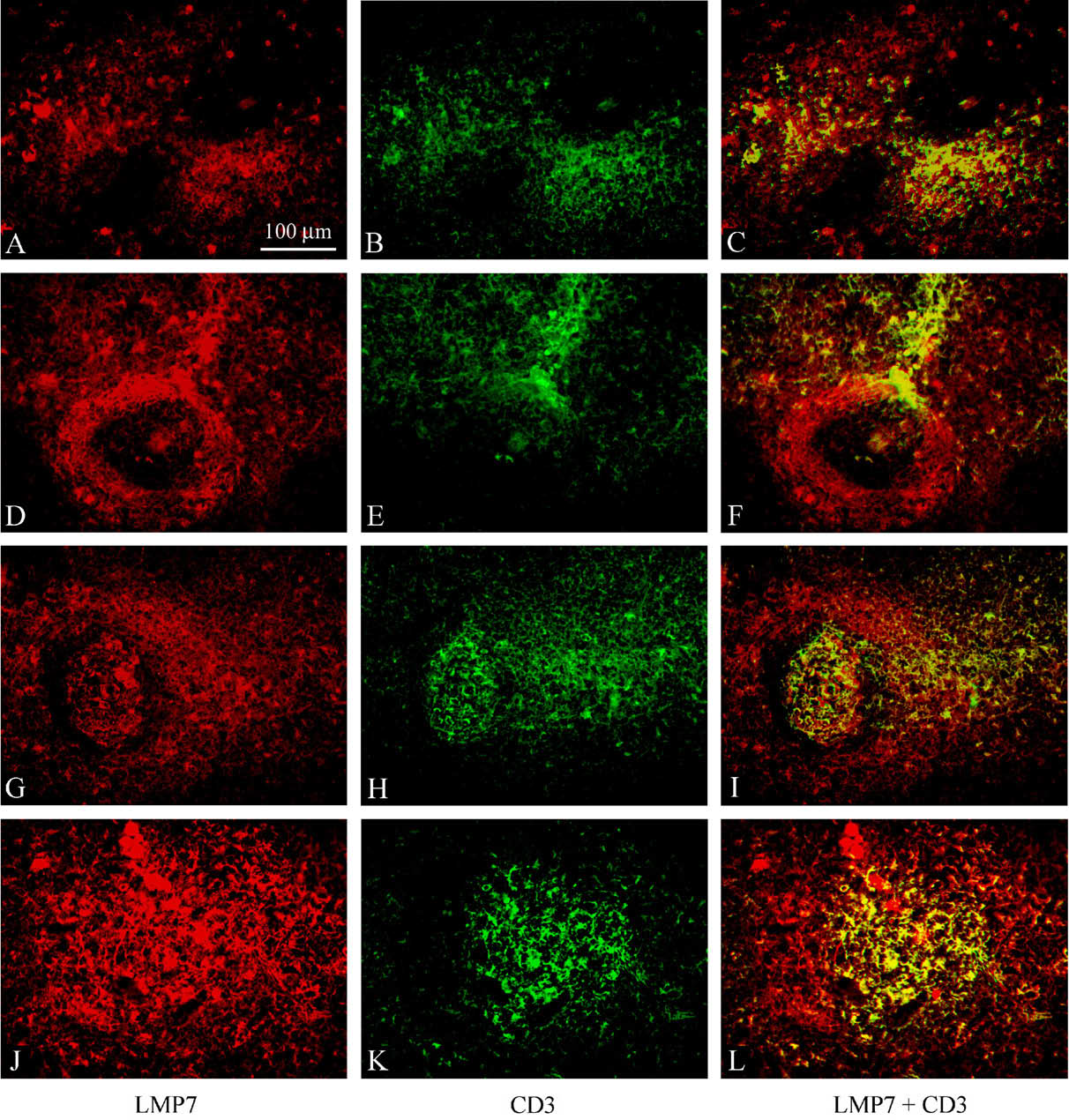 Рис. 4.
Рис. 4.
Миграция Т-лимфоцитов в селезенке крысы
на 4, 9, 15 и 19 постнатальные сутки
|
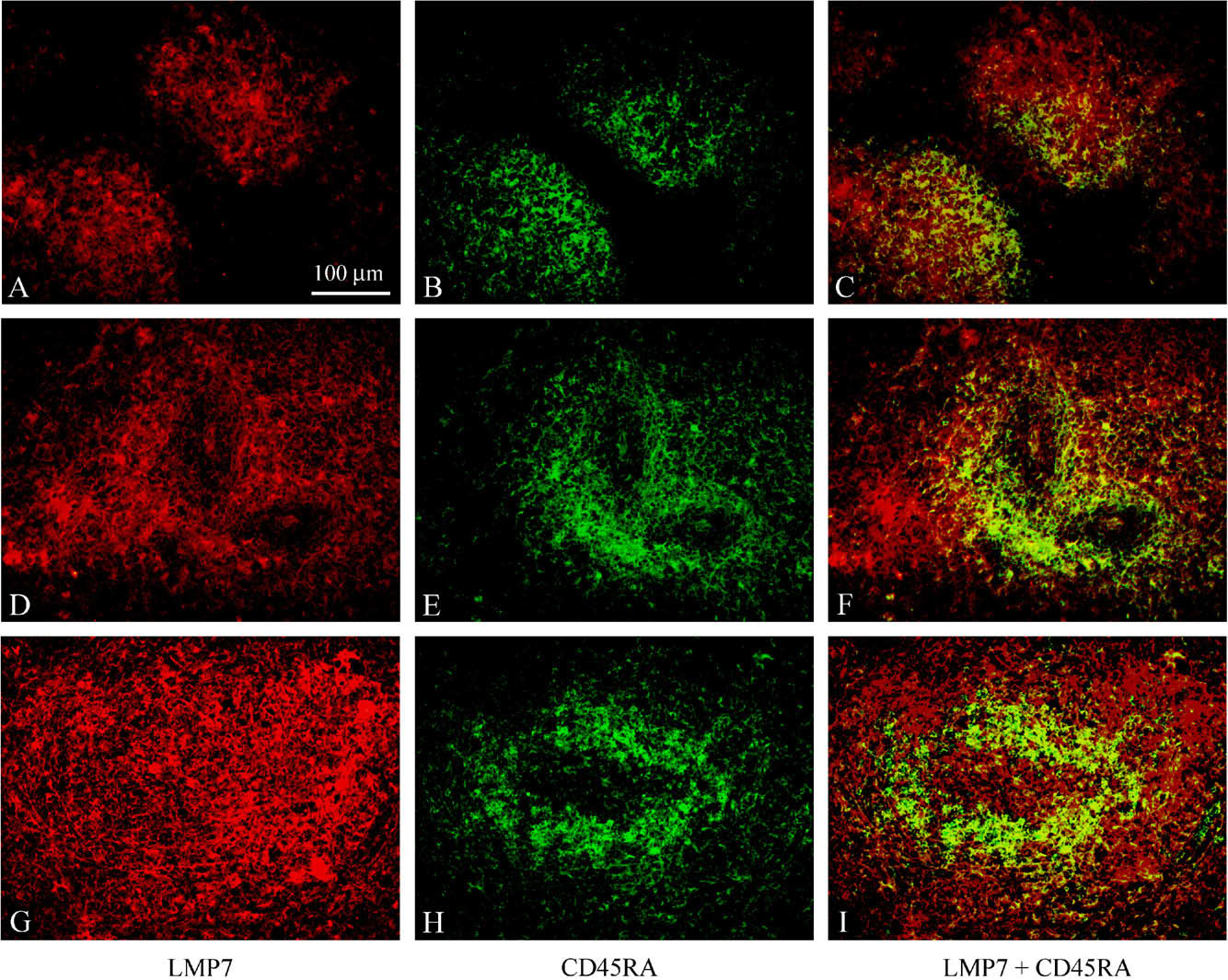 Рис. 5.
Рис. 5.
Миграция В-лимфоцитов в селезенке крысы
на 4, 9 и 19 постнатальные сутки
(Sharova N.P., Zakharova L.A., Astakhova T.M., Karpova Ya.D., Melnikova V.I., Dmitrieva S.B., Lyupina Yu.V., Erokhov P.A. New approach to study of T cellular immunity development: Parallel investigation of lymphoid organ formation and changes in immune proteasome amount in rat early ontogenesis. Cell. Immunol. 2009, V. 256. P. 47-55.)
|
Многолетние исследования протеасомных механизмов развития опухолей экспериментальных животных и пациентов нашли выход в практическую медицину в двух направлениях.
I. Разработано новое противоопухолевое лекарственное средство «БВ», комплексно воздействующее на протеасомы. Проведены его доклинические испытания в сравнении с отдаленным аналогом – препаратом
Велкейд® (бортезомиб).
Выявлены существенные преимущества разработанного лекарственного средства:
– его токсичность ниже токсичности Велкейда в 4-12 раз при противоопухолевой эффективности, превышающей
эффективность Велкейда в 1,5-2 раза, или соизмеримой с ней;
– данное лекарственное средство эффективно по отношению к опухолям, резистентным к Велкейду.
II. Разработан новый способ диагностики рака щитовидной железы, отличающийся высокой точностью. Способ основан на определении отношения химотрипсинподобной активности протеасом в опухоли и в условно нормальной ткани. Способ показал 100%-ную точность при диагностировании 34 новообразований пациентов (15 образцов папиллярной карциномы без метастазов, 5 образцов папиллярной карциномы с метастазированием в регионарные лимфоузлы, 10 образцов фолликулярной аденомы и 4 образцов хронического аутоиммунного тиреоидита).
Лаборатория проводит совместные исследования с Российским научно-исследовательским медицинским университетом им. Н.И. Пирогова МЗ РФ, Российским онкологическим научным центром им. Н.Н. Блохина, НИИ онкологии, г. Томск, МГУ, ИБХ РАН, ИМБ РАН, Институтом проблем криобиологии и криомедицины НАН Украины, г. Харьков.
Уникальной моделью для изучения молекулярных механизмов адаптаций являются морские беспозвоночные приливно-отливной зоны, в частности губки (Porifera). Клетки губок находятся в постоянном движении и в состоянии трансдифференцировки. Высокая устойчивость губок к влиянию стрессовых факторов обеспечивается лабильностью их структуры, которая проявляется в способности восстанавливать исходную организацию животного после диссоциации тканей и сопровождается дедифференцировкой и трансдифференцировкой клеток.
Мы изучаем роль протеасомного пути регуляции клеточного протеома в процессах диссоциации и реагрегации у холодноводных
морских губок Halichondria panacea и Halisarca dujardini (тип Porifera, класс Demospongiae) (рис. 7). Влияние стресса на функционирование УПС также исследуется на другой модели: в целомоцитах
кольчатых червей Arenicola marina (класс Polychaeta) (рис. 8) при воспалении, индуцированном липополисахаридом.
Протеасомы морских беспозвоночных практически не исследованы, их изучение позволит получить оригинальные сведения о протеасомной системе многоклеточных организмов, находящихся на ранних этапах эволюции.
Рис. 7. Halisarca dujardini
|

Рис. 8. Arenicola marina
|
|
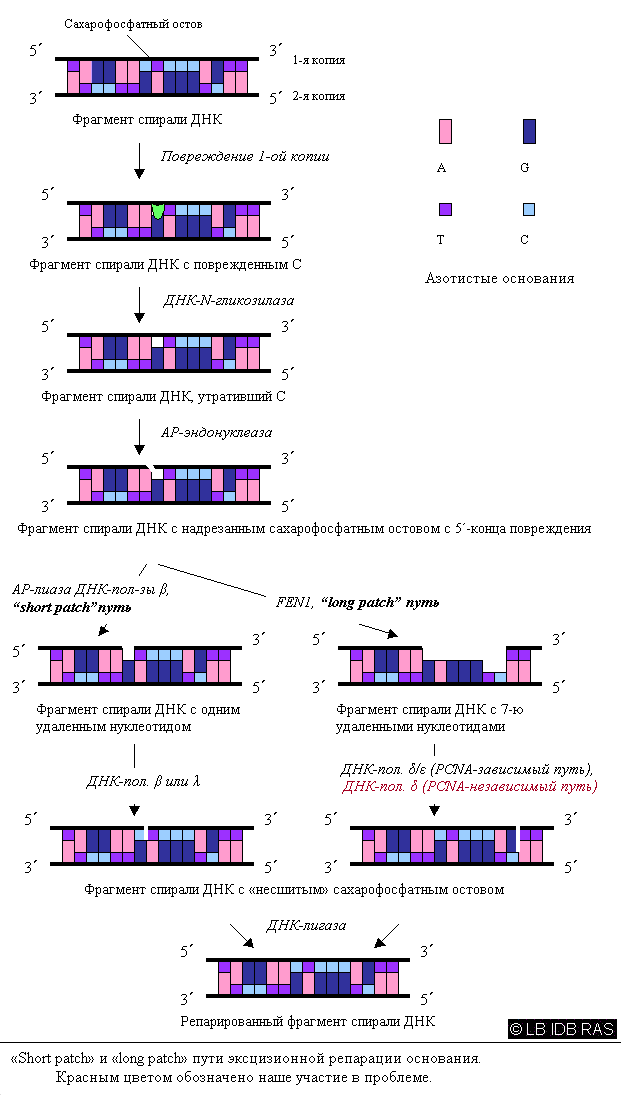 Рис. 1.
Рис. 1. Cхема эксцизионной репарации основания.
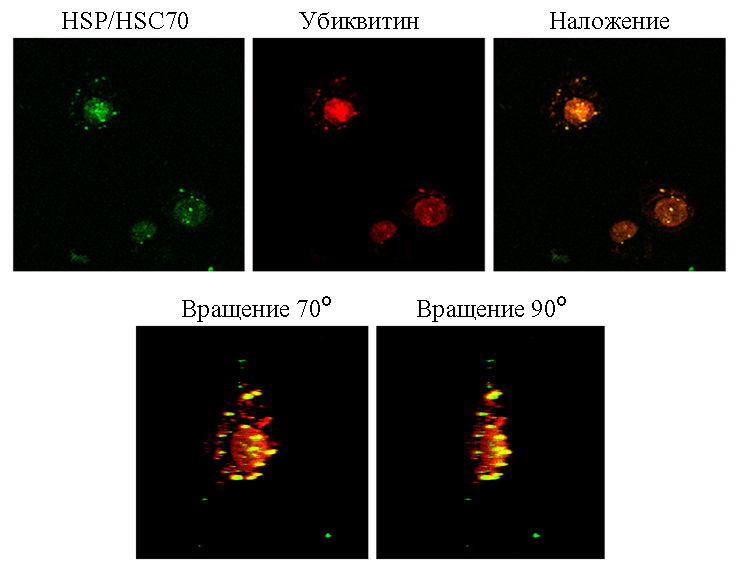
Рис. 2. Протеотоксичный стресс в клетках
кукурузной листовой совки Spodoptera frugiperda в результате инфекции бакуловирусом AcMNPV.
В цитоплазме инфицированных клеток формируются комплексы белков, модифицированных убиквитином, с клеточными шаперонами, белками теплового шока HSP/HSC70.
Вращение изображений подтверждает локализацию токсичных белковых агрегатов в цитоплазме клеток. (Lyupina Y.V., Zatsepina O.G., Timokhova A.V., Orlova O.V., Kostyuchenko M.V., Beljelarskaya S.N., Evgen’ev M.B., Mikhailov V.S. New insights into the induction of the heat shock proteins in baculovirus infected insect cells. Virology, 2011, v. 421, N 1, 34-41)
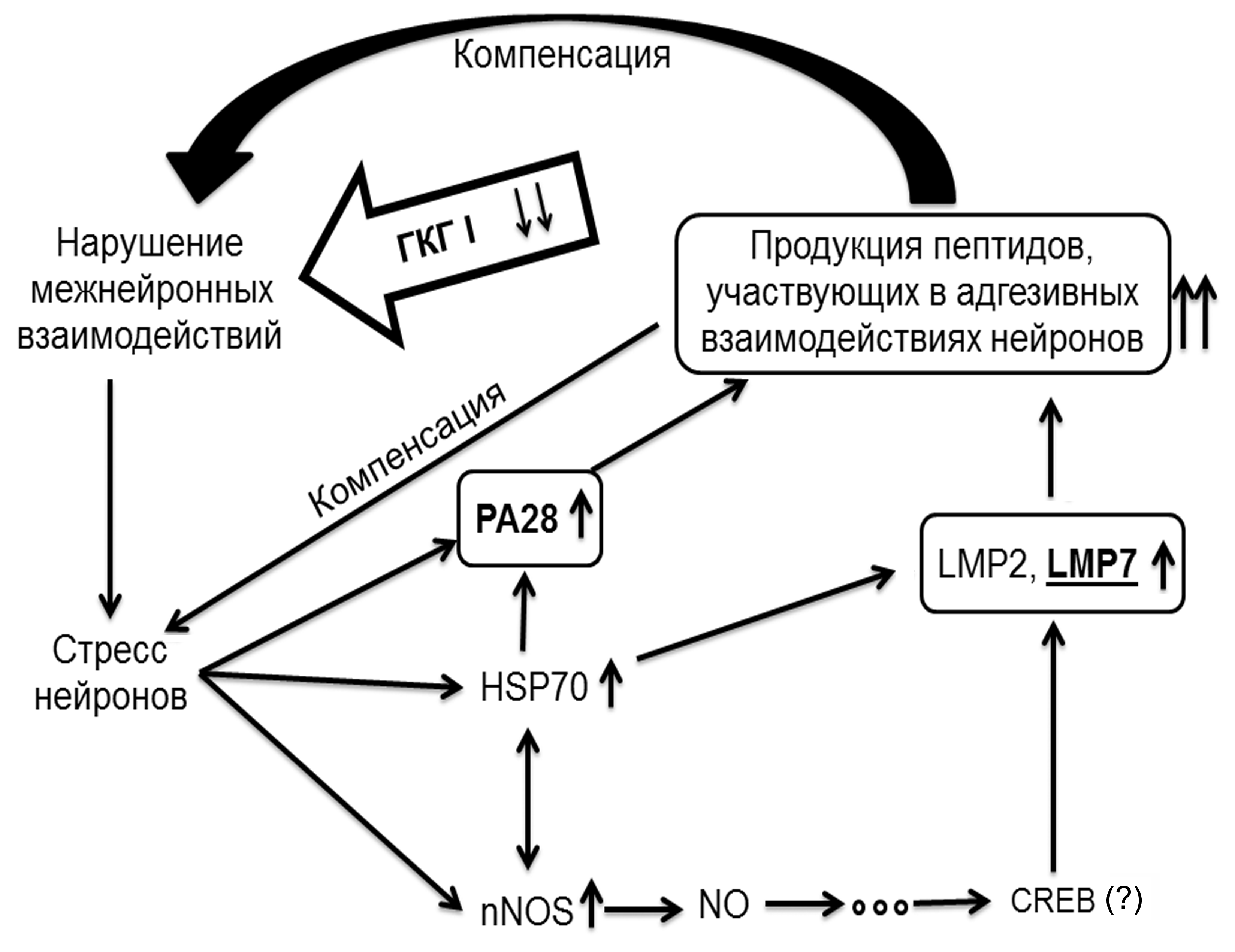
Рис. 3.
Предложенная гипотетическая схема компенсаторных механизмов синаптической пластичности,
развивающихся во фронтальной коре головного мозга мышей в отсутствие молекул ГКГ.
Отсутствие молекул ГКГ I приводит к нарушениям межнейронных взаимодействий, что, в свою очередь,
вызывает стрессовое состояние нейронов, которое подтверждается повышенным содержанием nNOS и HSP70.
Эти молекулы участвуют в сигнальных путях, приводящих к увеличению экспрессии иммунных протеасом и регулятора РА28. Вероятно, иммунные протеасомы в совокупности с регулятором РА28 в нейронах коры головного мозга В2m-нокаутных мышей создают определенный «молекулярный паспорт», свой для каждого нейрона, путем образования специфического набора олигопептидов. Последние, попадая на клеточную поверхность тем или иным способом, обеспечивают адгезивные взаимодействия с другими нейронами и компенсируют нарушения во взаимодействиях, создаваемых молекулами ГКГ I у контрольных животных.
 Pис. 6.
Pис. 6.Модель 26S
протеасомы
Термин "протеасома" (протеазы в соме) отражает наличие протеолитических активностей в дискретной частице – соме.
Протеасомы организованы так, что протеолитически активные центры обращены внутрь
протеолитической камеры, чтобы предотвратить случайное расщепление белков. Все клетки
эукариот содержат множественные формы протеасом, различающиеся структурой и спецификой
гидролиза белков (Sharova, Zakharova, 2008). Наименьшая функциональная единица,
20S протеасома, (рис. 6) представляет собой цилиндрическую структуру длиной 15–17 и диаметром
11–12 нм, состоящую из двух внутренних и двух наружных колец (Groll et al., 1997; Sharova, Zakharova, 2008).
У эукариот каждое из двух внутренних колец образовано семью различными β-субъединицами, окружающими полость, в которой происходит
протеолиз. Три β-субъединицы каждого кольца содержат треониновые протеолитические
сайты. Субъединицы X(β5), Y(β1) и Z(β2) проявляют химотрипсин-, каспаза- и трипсин-подобную
активности, которые расщепляют пептидные связи белка-субстрата после гидрофобных, дикарбоновых или положительно заряженных аминокислот соответственно (Ротанова и
др., 2005). Каждое из двух внешних колец образовано семью различными α-субъединицами,
которые окружают входное отверстие для белковых субстратов. Гидрофобные N-концы α-субъединиц служат своеобразной пробкой и препятствуют
проникновению белков внутрь протеолитической камеры. 20S-протеасомы не способны распознавать и связывать убиквитинированные
белки, однако они расщепляют некоторые белки независимо от убиквитина. К их числу
относятся белки с поврежденной третичной структурой, некоторые вирусные антигены
(Grune et al., 1996; Voigt et al., 2007; Yuksek et al., 2009).
По набору протеолитических субъединиц протеасомы млекопитающих и человека можно разделить на две группы – конститутивные (или протеасомы “домашнего хозяйства”) и иммунные. Иммунные протеасомы проявляют те же активности, что и конститутивные протеасомы, но отличаются от них конформацией субстратсвязывающих карманов (Unno et al., 2002). Вследствие этого иммунные протеасомы проявляют более выраженные химотрипсин- и трипсин-подобные
активности и образуют из чужеродных белков в несколько раз больше антигенных эпитопов с “правильным” С-концом, содержащим остатки гидрофобных или основных аминокислот. Образовавшийся антигенный эпитоп переносится в эндоплазматический ретикулум, встраивается в
щель Бьоркмана молекул главного комплекса гистосовместимости класса I и транспортируется
вместе с ними на клеточную поверхность для представления лимфоцитам CD8+-фенотипа. Данная
функция иммунных протеасом делает их важными участниками развития иммунных реакций, связанных с Т-клеточным звеном иммунитета. Помимо обеспечения развития иммунных реакций иммунные протеасомы выполняют и другие функции. Одна из их важнейших неимунных функций
– участие в развитии адаптивных процессов к различным стрессовым состояниям (Kotamraju et al.,
2006; Люпина и др., 2013).
Важно отметить, что каждый тип клеток характеризуется строго определенным уровнем общего
пула протеасом, регуляторов протеасом, в том числе активатора РА700, и строго определенным соотношением иммунных и конститутивных протеасом (Шарова, 2006). Изменения в пуле протеасом могут быть связаны с различными патологиями, в частности с онкологическими заболеваниями.
(Н. П. Шарова и др.
ИЗВЕСТИЯ РАН. СЕРИЯ БИОЛОГИЧЕСКАЯ,
2014, № 4, с. 1–7)
|
 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки





 Рис. 4.
Рис. 4. Рис. 5.
Рис. 5.





