Лаборатория ПРОБЛЕМ РЕГЕНЕРАЦИИ
Основные направления исследований
Молекулярные механизмы репрограммирования клеток РПЭ, через популяцию нейробластов при регенерации сетчатки у низших позвоночных
Объектом исследований являются хвостатые амфибии Pleurodeles waltl (Urodela), способные к полному восстановлению после ее отслойки или удаления. Сетчатка тритона является уникальной модельной системой для изучения судьбы дифференцировки клеток, закономерностей клеточной пролиферации, апоптоза, механизмов морфогенеза в развитии и регенерации, исследования функций клеток в норме и патологии. В лаборатории показано, что пролиферация транзиторного нейробластоподобного пула, сформированного из клеток ретинального пигментного эпителия (РПЭ) путем геномного репрограммирования in vivo, обеспечивает регенерацию сетчатки у взрослого тритона. В развитии сетчатки популяция клеток нейробластов также является источником формирования разнообразного потомства для всех типов нейрональных и глиальных клеток. С помощью морфологических, молекулярных и иммунохимических методов нами выявлены закономерности дифференцировки типов клеток сетчатки и молекулярная регуляция морфогенеза сетчатки в процессе развития и регенерации у тритона P. waltl. Обнаружены гены, кодирующие факторы транскрипции и сигнальные белки, экспрессирующиеся на ранних стадиях нейробластов, образующихся в результате репрограммирования РПЭ, а позднее – в дифференцирующихся нейронах регенерирующей сетчатки. Среди них Fgf2, Wntb2, Bmp4, Pax6, Sox2, Rx, Six3, Prox1, Pitx1-3, Otx2 и другие. Результаты свидетельствуют о том, что морфогенез сетчатки происходит независимо от происхождения клеток-предшественников (нейробластов) в процессе развития и регенерации под контролем эволюционно консервативных регуляторных генов. Они вовлечены в специфические генные сети, которые координируют дифференцировку типов клеток и морфогенез глаза позвоночных. В цилиарной зоне роста глаза тритона нами также обнаружены регуляторные факторы Fgf2, Pax6, Sox2, Rx, Six3, Prox1, Otx2, Pitx1-3, Gnl3, которые участвуют в поддержании недифференцированных «стволовых» клеток. Эти клетки представляют ростовой и регенеративный (наряду с клетками РПЭ) потенциал сетчатки. Полученные нами данные также указывают на существование таксономических различий.
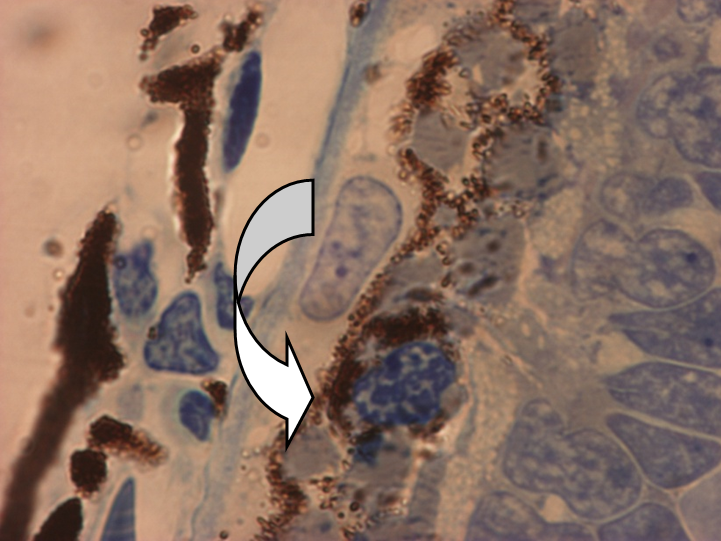 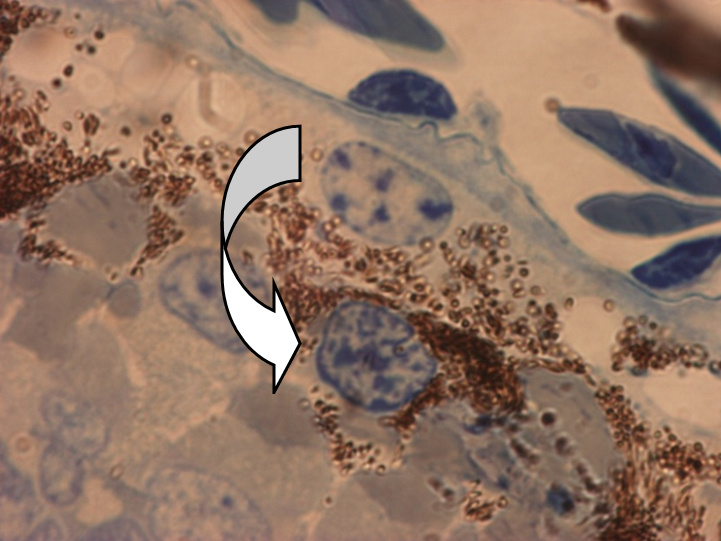
Рисунок 1. Репрограммирование клеток РПЭ тритона Pl. waltl. при повреждении сетчатки ярким светом (полутонкие срезы, H-E).
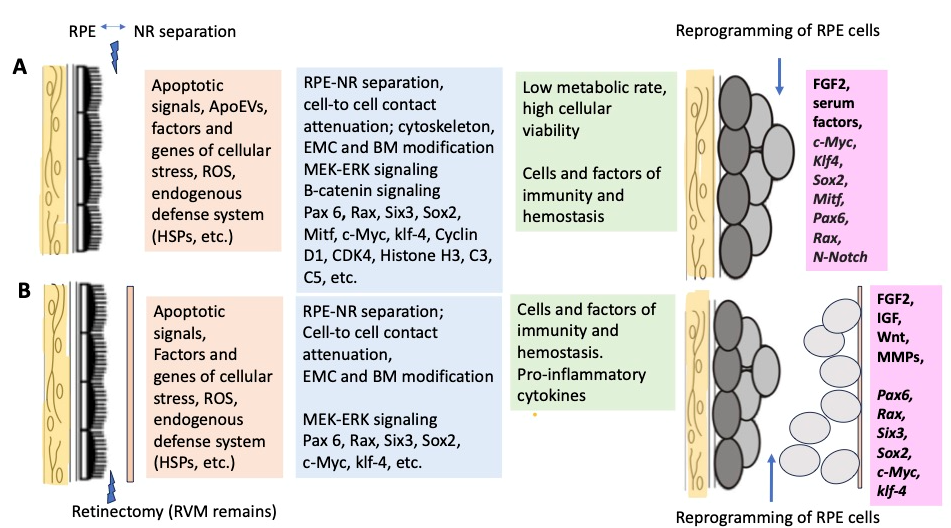
Рисунок 2. Ряд известных клеточных и молекулярных факторов, участвующих в инициации регенерации сетчатки и репрограммировании РПЭ у Urodela (A) и Anura (B) (Markitantova, Grigoryan, 2023).
Вектор многолетних лабораторных исследований механизмов регенерации сетчатки у тритонов можно кратко суммировать следующим образом – от изучения макромолекулярных синтезов к анализу экспрессии отдельных генов, транскриптомных изменений, сигнальных путей и далее к протеомике и эпигенетике
В настоящее время наши исследования направлены на поиск ключевых компонентов эндогенных защитных систем (сигнальных путей, транскрипционных факторов и т.д.) клеток пигментного эпителия сетчатки, которые допускают/блокируют регенерацию за счет клеточной конверсии; их филогенетическую характеристику.
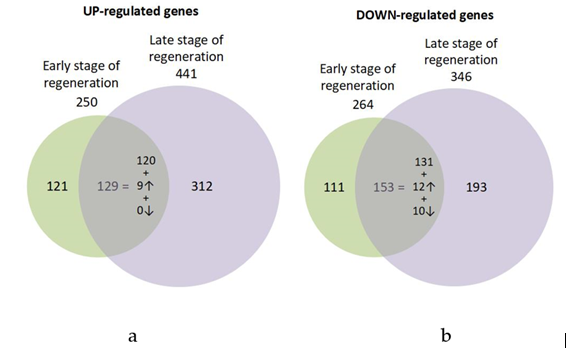
Рисунок 3. Транскриптомный анализ. Диаграмма Венна генов с повышенной (a) и пониженной (b) экспрессией на ранней и поздней стадии репрограммирования клеток РПЭ во время регенерации сетчатки у тритона P. waltl. Экспрессия в областях пересечения паттернов демонстрируют общие дифференциально экспрессируемые гены для обеих стадий регенерации, долю из них со схожими уровнями дифференциальной экспрессии, с уровнем, увеличенным на поздней стадии в два раза и более или уменьшенным в два раза и более раза. Направление стрелок указывает на увеличение или уменьшение дифференциальной экспрессии (Markitantova et al., 2023).
Избранные публикации по теме:
- Markitantova, Y.; Simirskii, V. Retinal Pigment Epithelium Under Oxidative Stress: Chaperoning Autophagy and Beyond // Int. J. Mol. Sci. 2025, 26, 1193. https://doi.org/10.3390/ijms26031193
- Новикова Ю.П.1 , Григорян Э.Н.1 Оценка возрастзависимых гистопатологических изменений, происходящих в слезной железе стареющих крыс Wistar//Офтальмология. 2024. Т. 21(1). С. 205-213. DOI: 10.18008/1816-5095-2024-1-205-213. - Novikova Yu.P.1 , Grigoryan E.N.1 Assessment of Age-related Histopathological Changes Occurring in the Lacrimal Gland of Aging Wistar Rats//Ophthalmology in Russia. 2024. Vol. 21(1). P. 205-213. (In Russ.). DOI: 10.18008/1816-5095-2024-1-205-213. - УБС4
- Markitantova Y.V., Grigoryan E.N. Cellular and Molecular Triggers of Retinal Regeneration in Amphibians // Life-Basel. 2023. Vol. 13(10). Art. No. 1981. DOI: 10.3390/life13101981.
- Markitantova Y., Fokin A., Boguslavsky D., Simirskii V., Kulikov A. Molecular Signatures Integral to Natural Reprogramming in the Pigment Epithelium Cells after Retinal Detachment in Pleurodeles waltl // Int. J. Mol. Sci. 2023. Vol. 24. Art.no 16940.DOI: 10.3390/ ijms242316940.
- Markitantova Y., Simirskii V. Endogenous and Exogenous Regulation of Redox Homeostasis in Retinal Pigment Epithelium Cells: An Updated Antioxidant Perspective//Int. J. Mol. Sci. 2023. 24 10776. DOI: 10.3390/ijms241310776. Published: 28 June 2023.
- Markitantova Yu.V., Simirskii V.N. Conservatism and Variability of the Antioxidant Defense System in the Retinal Pigment Epithelium of Vertebrates Journal of Evolutionary Biochemistry and Physiology. 2023. No. 3, Vol. 59, pp. 655–675 https://doi.org/10.1134/S0022093023030018
- Markitantova Y., Simirskii V. Endogenous and Exogenous Regulation of Redox Homeostasis in Retinal Pigment Epithelium Cells: An Updated Antioxidant Perspective // Int. J. Mol. Sci. 2023. 24 10776. DOI: 10.3390/ijms241310776. Published: 28 June 2023.
- Grigoryan E.N. Study of natural longlife juvenility and tissue regeneration in caudate amphibians and potential application of resulting data in biomedicine // Journal of Developmental Biology. 2021. Vol. 9. Is. 1. Art. No 2. P. 1-19. DOI: 10.3390/jdb9010002.
- Grigoryan E.N., Markitantova Y.V. Molecular Strategies for Transdifferentiation of Retinal Pigment Epithelial Cells in Amphibians and Mammals In Vivo // Russian journal of Developmental biology. 2021. Vol. 52. Is. 4. P. 220-243. DOI 10.1134/S1062360421040032.
- Grigoryan E.N. Self-Organization of the Retina during Eye Development, Retinal Regeneration In Vivo, and in Retinal 3D Organoids In Vitro // Biomedicines. 2022. Vol. 10. Art. no 1458. DOI: 10.3390/biomedicines10061458
- Markitantova Yu.V., Simirskii V.N. Role of the Redox System in Initiation of a Regenerative Response of Neural Eye Tissues in Vertebrates // Russian Journal of Developmental Biology. 2020. Vol. 51. Is. 1. P. 16-30. DOI: 10.1134/S106236042001004X.
- Markitantova Y.V., Novikova Y.P., Poplinskaya V.A., Grigoryan E.N. Expression of FGF2 and Nucleostemin in Models of Retinal Regeneration in the Newt Under Conditions of 3D Organotypic Culture In vitro//EC Ophthalmology. 2020. V. 11. Is. 1. P. 01-09. DOI:10.31080/ecop.2020.11.00580.
- Grigoryan E.N. Potential Endogenous Cell Sources for Retinal Regeneration in Vertebrates and Humans: Progenitor Traits and Specialization//Biomedicines. 2020. V. 8. P. 208. DOI: 0.3390/biomedicines8070208.
- Markitantova Yu.V., Simirskii V.N. Inherited retinal diseases through the eyes of homeobox genes // Int. J. Mol. Sci. 2020. V. 21. № 5. P. 1602.Doi: 10.3390/ijms21051602
ИССЛЕДОВАНИЯ МЕХАНИЗМОВ ПЛАСТИЧНОСТИ КЛЕТОК РЕТИНАЛЬНОГО ПИГМЕНТНОГО ЭПИТЕЛИЯ МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА IN VITRO
Регенерация сетчатки глаза позвоночных осуществляется за счет внутренних и внешних резервов. Дегенерация нейронов сетчатки человека часто является следствием патологического репрограммирования клеток ретинального пигментного эпителия (РПЭ), способных к различным типам дифференцировки. Дегенеративные заболевания или повреждения структур нервной системы часто не имеют эффективного лечения. Работа группы экспериментальной нейробиологии (д-р М.А. Александрова) направлена на изучение участия стволовых и высокопластичных клеток нервной ткани животных и человека в процессах регенерации. Наши исследования сосредоточены на клеточных подходах, которые включают регуляцию репрограммирования клеток in vitro, а также изучение влияния трансплантации различных типов клеток на восстановление функций центральной нервной системы. Трансдифференцировка и репрограммирование клеток ретинального пигментного эпителия (РПЭ) изучается с использованием клеточной линии ARPE-19 человека. Клетки РПЭ взрослого глаза человека при культивировании in vitro проявляют потенции к фенотипическим изменениям в сторону нейральной и эпителиальной дифференцировки и проявляют свойства стволовых клеток. Идентифицированы несколько сигнальных белков, участвующих в изменении характера дифференцировки взрослых клеток РПЭ и клеток линии ARPE-19. Установлено снижение уровня дифференцировки клеток РПЭ на ранних этапах культивирования после действия oFGF, в том числе: инактивация сигнальных путей Wnt/?-катенина и Notch, активация неканонического сигнального пути Wnt/PCP и модуляция BMP-сигнального пути. Изучаются механизмы репрограммирования клеток и способы регуляции пластичности клеток РПЭ.
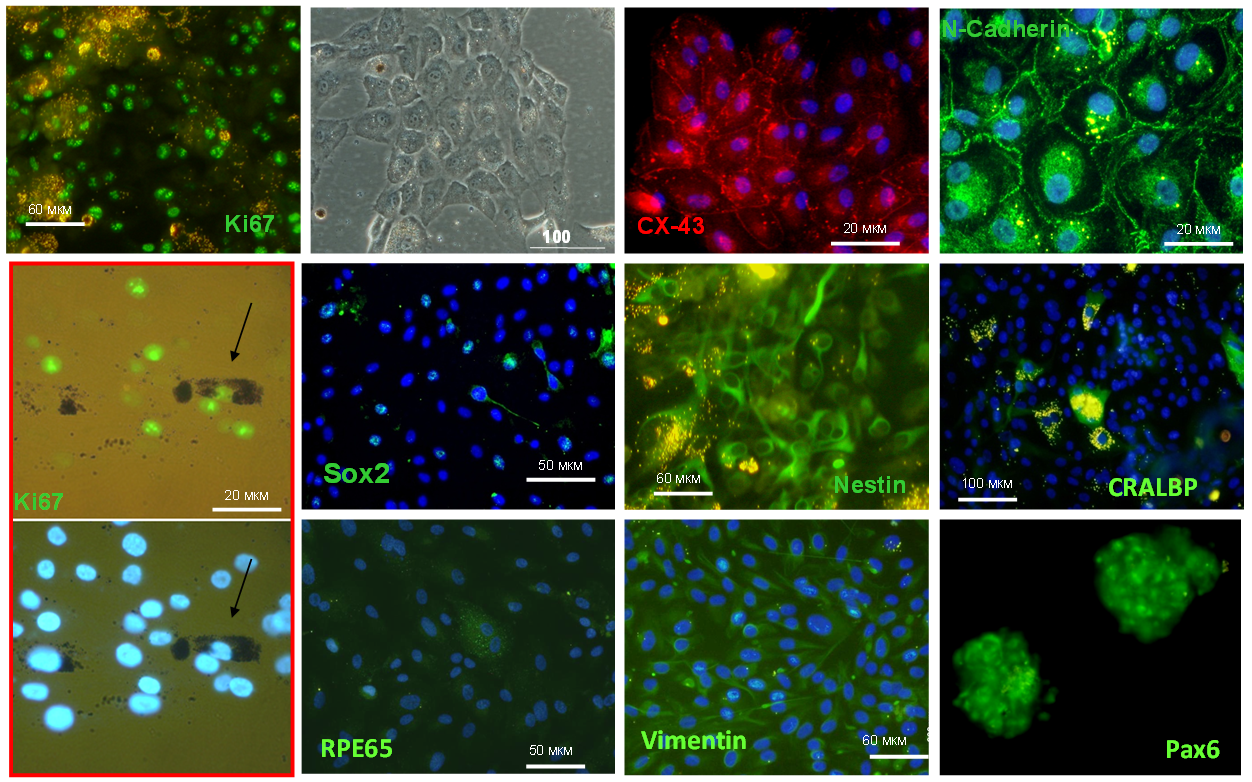
Рисунок 4. Экспрессия маркерных белков в дедифференцированных клетках пигментного эпителия сетчатки человека in vitro.
Избранные публикации по теме:
- Rzhanova L.A.1, Markitantova Y.V.1, Aleksandrova M.A.1 Recent Achievements in the Heterogeneity of Mammalian and Human Retinal Pigment Epithelium: In Search of a Stem Cell//Cells-Basel. 2024. Vol. 13. Art. no 281. DOI: 10.3390/cells13030281. Published: 4 February 2024.- Q2 - УБС1
- Shafei E.V., Rzhanova L.A., Novikova Y.P., Kurinov A.M., Grigoryan E.N., Aleksandrova M.A., Kuznetsova А.V. Response of human retinal pigment epithelial cells to the effect of the conditioned media of newt retinal regenerates // Cell and Tissue Biology. 2021. Vol. 15. № 2. P. 135-149. DOI: 10.1134/S1990519X21020085
- Rzhanova L.A., Kuznetsova A.V., Aleksandrova M.A. Reprogramming of differentiated mammalian and human retinal pigment epithelium: current achievements and prospects // Russian Journal of Developmental Biology. 2020. V. 51. №. 4. P. 212–230. DOI: 10.1134/S1062360420040062
- Kuznetsova А.V., Rzhanova L.A., Kurinov A.M., Aleksandrova М.A. Effect of basic fibroblast growth factor on signaling pathways in adult human retinal pigment epithelial cells // Cell and Tissue Biology. 2019. Vol. 13, № 4. P. 292-304. DOI: 10.1134/S1990519X19040059.
- Shafei E.V., Kurinov A.M., Kuznetsova A.V., Aleksandrova M.A. Reprogramming of human retinal pigment epithelial cells under the effect of bFGF in vitro // Bulletin of Experimental Biology and Medicine. 2017. V. 163. 4. P. 574–582). https://doi.org/10.1007/s10517-017-3852-5
- Kuznetsova A.V., Aleksandrova M.A., Kurinov A.M., Chentsova E.V., Makarov P.V. Plasticity of adult human retinal pigment epithelial cells // International Journal of Clinical and Experimental Medicine. 2016. V. 9. № 11. Р. 20892-20906.
Механизмы регенерации тканей, фиброза и рака
Повышенный уровень гиалуроновой кислоты (ГК) в плазме крови и внеклеточном матриксе является маркером заболевания при патологии печени и других воспалительных заболеваниях. Ингибирование синтеза ГК за счет подавления синтеза гиалуронансинтаз с помощью кумарина 4-метилумбеллифероном (4MU) оказывает эффект подавления фиброза, воспаления, рака и метаболического синдрома, что показано на животных моделях. 4MU является активным соединением с низкой биодоступностью и широким спектром действия, что ставит задачу поиска более специфичных и эффективных ингибиторов гиалуронансинтаз (ГАС). Мы протестировали несколько недавно синтезированных соединений кумарина и коммерческих ингибиторов синтеза хитина для ингибирования продукции ГК в анализе клеточной культуры. Производное кумарина соединение VII (10'-метил-6'-фенил-3'H-спиро[пиперидин-4,2'-пирано[3,2-g]хромен]-4',8'-дион) продемонстрировало ингибирование секреции HA клетками NIH3T3 с полумаксимальной ингибирующей концентрацией (IC50) = 1,69 ± 0,75 мкМ, превосходящей 4MU (IC50 = 8,68 ± 1,6 мкМ). Ингибиторы синтеза хитина, этоксазол, бупрофезин, трифлумурон, снизили отложение HA с IC50 4,21 ± 3,82 мкМ, 1,24 ± 0,87 мкМ и 1,48 ± 1,44 мкМ соответственно. Этоксазол снизил выработку HA и предотвратил образование коллагеновых волокон в модели фиброза печени CCl4 у мышей, аналогичной 4MU. Биоинформатический анализ выявил гомологию между хитинсинтазами и ферментами HAS, и высокую степень гомологии в порообразующем домене, содержащем предполагаемый сайт для связывания этоксазола.
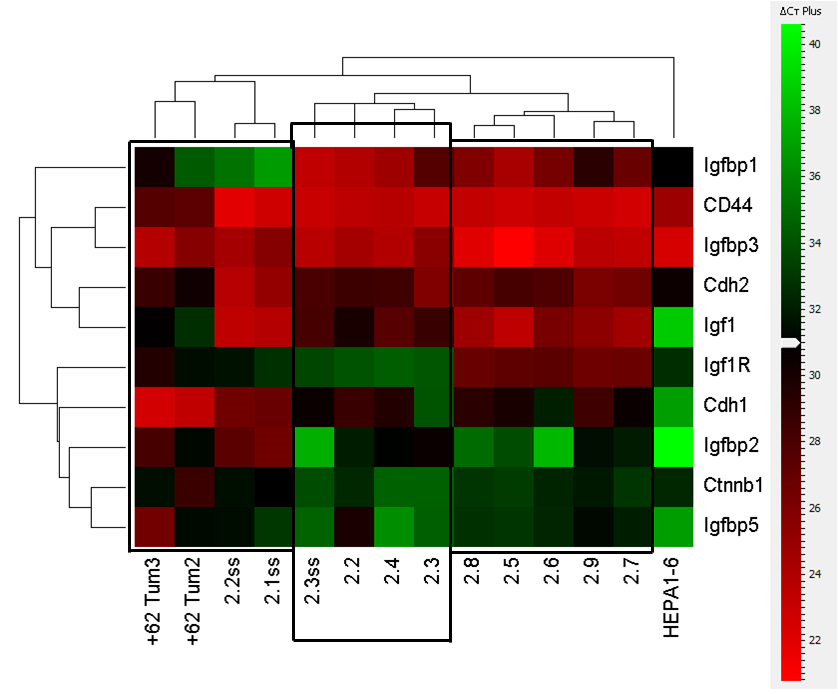
Рисунок 5.Кластерный анализ данных, полученных методом ПЦР в реальном времени, по экспрессии изучаемых генов в химически индуцированной гепатокарциноме печени (Tsitrina A.A. et all., 2023).
Избранные публикации по теме:
- Halimani N., Nesterchuk M., Tsitrina A.A., Sabirov M.1 , Andreichenko I.N., Dashenkova N.O.1, Petrova E., Kulikov A.M.1 , Zatsepin T.S., Romanov R.A., Mikaelyan A.S.1 , Kotelevtsev Y.V. Knockdown of Hyaluronan synthase 2 suppresses liver fibrosis in mice via induction of transcriptomic changes similar to 4MU treatment//Scientific Reports . 2024.Vol. 14(1). Art. no 2797. DOI: 10.1038/s41598-024-53089-x. 2024 Feb 2 - Q1 - УБС1
- Tsitrina A.A, Halimani N., Andreichenko I.N., Sabirov M, Nesterchuk M., Dashenkova N.O., Romanov R., Bulgakova E.V., Mikaelyan A., Kotelevtsev Y. 4-Methylumbelliferone Targets Revealed by Public Data Analysis and Liver Transcriptome Sequencing // International Journal of Molecular Sciences. 2023. Vol. 24. Art. no 2129. DOI: 10.3390/ijms24032129.
- Shashkovskaya V.S., Vetosheva P.I., Shokhina A.G., Aparin I.O., Prikazchikova T.A., Mikaelyan A.S.1, Kotelevtsev Y.V., Belousov V.V., Zatsepin T.S., Abakumova T.O. Delivery of Lipid Nanoparticles with ROS Probes for Improved Visualization of Hepatocellular Carcinoma // Biomedicines. 2023. Vol. 11(7). Art. no. 1783. DOI: 10.3390/biomedicines11071783.
- Abakumova T., Vaneev A., Naumenko V., Shokhina A, Belousov V., Mikaelyan A., Balysheva K., Gorelkin P., Erofeev A., Zatsepin T. Intravital electrochemical nanosensor as a tool for the measurement of reactive oxygen/nitrogen species in liver diseases // J Nanobiotechnology. 2022;20(1):497. DOI: 10.1186/s12951-022-01688-z
- Sapach A.Yu., Sindeeva O.A., Nesterchuk M.V., Tsitrina A.A., Mayorova O.A., Prikhozhdenko E.S., Verkhovskii R.A., Mikaelyan A.S., Kotelevtsev Y.V., Sukhorukov G.B. Macrophage In Vitro and In Vivo Tracking via Anchored Microcapsules // ACS Applied Materials & Interfaces. 2022. https://doi.org/10.1021/ACSAMI.2C12004
- Andreichenko I.N., Tsitrina A.A., Fokin A.V., Gabdulkhakova A.I., Maltsev D.I., Perelman G.S., Bulgakova E.V., Kulikov A.M., Mikaelyan A.S., Kotelevtsev Y.V. 4-methylumbelliferone prevents liver fibrosis by affecting hyaluronan deposition, FSTL1 expression and cell localization // Int. J. Mol. Sci. 2019. V. 20. Is. 24. Р. 6301-6318. DOI:10.3390/ijms20246301.
Разработка бесклеточных каркасов для регенеративной медицины
Проводятся исследования влияния компонентов внеклеточного матрикса на дифференцировку стволовых клеток периодонтальной связки. Разрабатываемые бесклеточные продукты востребованы для регенеративной медицины, поскольку их применение направлено на регуляцию миграции, пролиферации, дифференцировки и поддержание метаболизма резидентных стволовых клеток, что обеспечит возможность их правильного пространственного расположения и стимуляцию эндогенной регенерации поврежденных тканей. Бесклеточные терапевтические агенты, приводящие к рекрутингу/хоумингу эндогенных СК, имеют преимущество в преодолении ограничений и рисков, связанных с использованием клеточной терапии, включая образование опухолей, нежелательные иммунные реакции и передачу патогенов, а также преимущество в производстве, хранении и стандартизации.

Figure 6. Bioengineered construct (acellular scaffolds) together with periodontal cells in collagen I hydrogel (3D culture).
Избранные публикации по теме:
- Kuznetsova A.V.2, Glukhova X.A., Popova O.P., Beletsky I.P., Ivanov A.A. Contemporary approaches to immunotherapy of solid tumors//Cancers. 2024. Vol. 16. Art. no. 2270. DOI: 10.3390/cancers16122270. Published: 19 June 2024 – Q1 - УБС1
- Иванов А.А., Попова О.П., Кузнецова А.В. 2, Буторина Н.Н. 1, Данилова Т.И., Латышев А.В., Янушевич О.О. Индукция эндогенной регенерации тканей пародонта 3D-биоскаффолдами // Бюллетень экспериментальной биологии и медицины. 2025. Т. 179(1). С. 123-128. DOI: 10.47056/0365-9615-2025-179-1-123-128- УБС 3.
- Ivanov A.A., Danilova T.I., Kuznetsova A.V, Popova O.P., Yanushevich O.O. Decellularized Matrix Induced Spontaneous Odontogenic and Osteogenic Differentiation in Periodontal Cells // Biomolecules. 2023. Vol. 13(1). Art. no. 122. DOI: 10.3390/biom13010122.
- Ivanov A.A., Kuznetsova A.V., Popova O.P., Danilova T.I., Latyshev A.V., Yanushevich O.O. Influence of Extracellular Matrix Components on the Differentiation of Periodontal Ligament Stem Cells in Collagen I Hydrogel // Cells. 2023. Vol.12 (19). Art. no 2335. DOI: 10.3390/cells12192335.
|

Маркитантова
Юлия Владимировна
Руководитель лаборатории, г.н.с., к.б.н.
Область научных интересов: стратегии регенерации, молекулярно-генетические механизмы репрограммирования клеток пигментного эпителия сетчатки, эпителиально-мезенхимальный переход, нейродегенеративные патологии глаза; эндогенные защитные системы, регенеративная медицина
E-mail: yuliya.mark@gmail.com
Researcher ID (WoS): V-8476-2018
Author ID (SCOPUS): 6505995079
ORCID https://orcid.org/0000-0003-2518-0610

Григорян
Элеонора Норайровна
г.н.с., доктор биологических наук
Область научных интересов: клеточные источники регенерации; молекулярно-генетические механизмы регенерации органов и тканей у позвоночных, регенеративная медицина
E-mail: leonore@mail.ru

Симирский
Владимир Николаевич
с.н.с., к.б.н.
Область научных интересов: стратегии и молекулярно-генетические механизмы регенерации тканей глаза; эндогенные системы защиты клеток от стресса, регенеративная медицина
E-mail: simir@mail.ru

Новикова
Юлия Петровна
инж-иссл., к.б.н.
Специалист по органотипическим клеточным культурам и гистологии

Шабарина
Анна Николаевна
м.н.с., к.б.н.
Область научных интересов: эпигенетика, структура клеточного ядра и организация хроматина, ядерная оболочка
ГРУППА ЭКСПЕРИМЕНТАЛЬНОЙ НЕЙРОБИОЛОГИИ

Александрова
Мария Анатольевна
г.н.с., д.б.н.
Область научных интересов: нейрогенез у позвоночных, нейральные стволовые клетки, регуляция пластичности стволовых и прогениторных клеток, механизмы регенерации нервной ткани, трансплантация
E-mail: mariaaleks@inbox.ru

Кузнецова
Алла Викторовна
с.н.с. к.м.н.
Область научных интересов: внеклеточный матрикс, децеллюляризованный внеклеточный матрикс, регенеративная медицина, бесклеточная терапия; эпителиально-мезенхимальный переход; ассоциированные с раком фибробласты; микроокружение опухоли, молекулярные механизмы опухоле-стромальные взаимодействия
E-mail: avkuzn@list.ru

Ржанова
Любовь Александровна
н.с. к.б.н.
Область научных интересов: трансдифференцировка и репрограммирование клеток пигментного эпителия сетчатки млекопитающих и человека in vitro, регенеративная медицина
E-mail: 9303923@gmail.com

Малахова
Елена Валерьевна
ст. лаб.
Область научных интересов: пластичность клеток пигментного эпителия сетчатки и ее регуляция in vitro, регенеративная медицина
E-mail: elenamallakhova@mail.ru
ГРУППА МОЛЕКУЛЯРНО- ГЕНЕТИЧЕСКИХ МЕХАНИЗМОВ ОНТОГЕНЕЗА

Микаелян
Арсен Суренович
с.н.с. к.б.н.
Область научных интересов: клеточные и молекулярно-генетические механизмы регенерации печени, фиброза, канцерогенеза
E-mail:arsmikael@gmail.com

Дашенкова
Наталия Олеговна
н.с., к.б.н.
Область научных интересов: клеточные и молекулярно-генетические механизмы регенерации печени, фиброза, канцерогенеза
E-mail:goncharovan22@gmail.com
ГРУППА ЭМБРИОФИЗИОЛОГИИ
- НИКИШИН Денис Александрович,
с.н.с. к.б.н.
e.mail: d.nikishin@idbras.ru
- Мальченко
Людмила Александровна,
м.н.с
- Никишина Юлия Олеговна,
н.с. к.б.н.
- Алешина
Нина Максимовна,
н.с., к.б.н.
|
 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки
 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки