Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение наукиИНСТИТУТ БИОЛОГИИ РАЗВИТИЯ им. Н.К. Кольцова РАН
Koltzov Institute of Developmental Biology of Russian Academy of Sciences

|
|
Лаборатория ЭПИГЕНЕТИКИ РАЗВИТИЯКоллектив лаборатории
Основные направления исследований
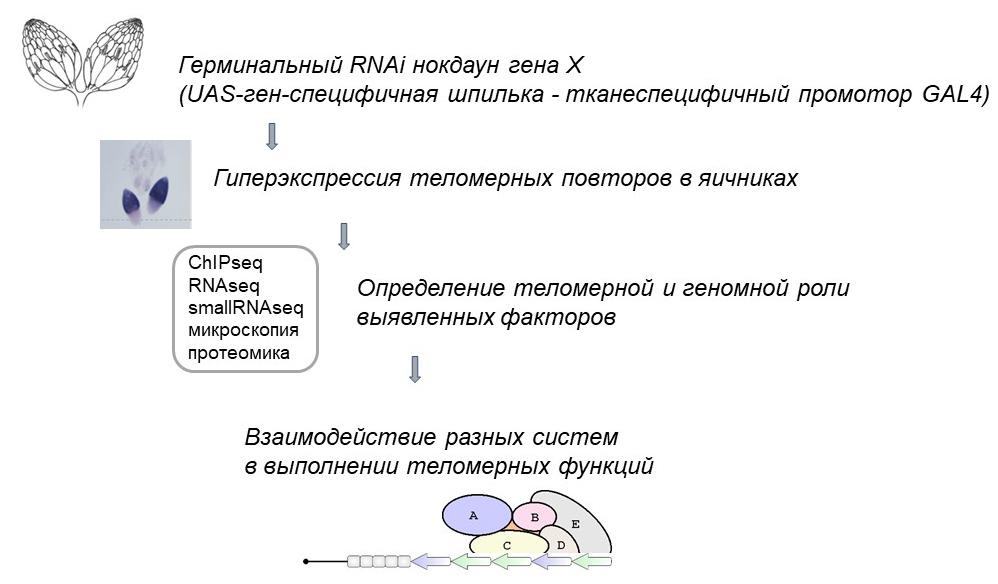
Экспериментальная стратегия отбора и исследования теломерных факторов (Morgunova et al. 2015). В нашем коллективе предложена и развивается концепция теломерного чекпойнта, согласно которой теломеры являются детектором тех нарушений, которые представляют угрозу генетической стабильности клетки, и они же запускают ответ, приводящий к гибели такой клетки или остановке развития. В то же время, дисфункция теломер и повреждения теломерной ДНК при сохранении нормальной длины теломер могут быть причиной ускоренной гибели клеток при старении.
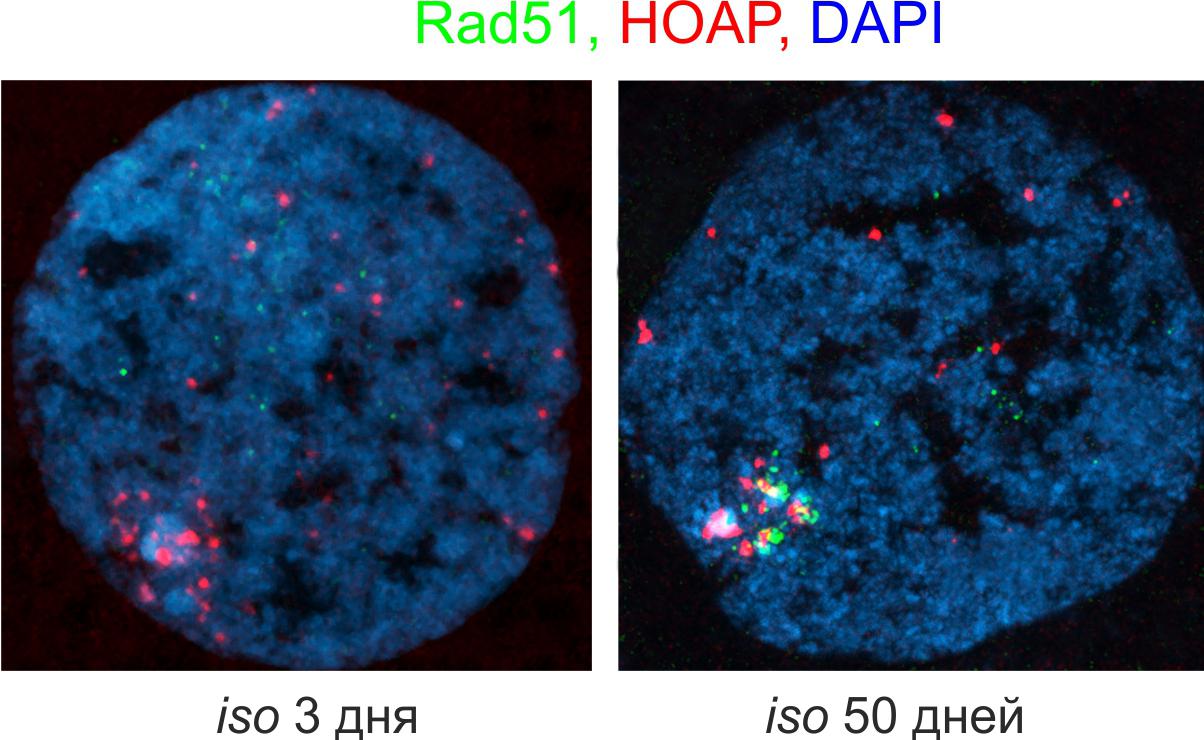
Накопление рекомбиназы Rad51 (зеленый) в теломерах (теломерный белок HOAP, красный) герминальных клеток Drosophila при старении. В эксперименте были исследованы яичники мух 3- и 50-дневного возраста изогенной линии iso-1 (Моргунова и др. 2022). В наших работах была выявлена новая сигнальная роль теломерных РНК. Показано, что при нарушении теломерного гомеостаза активируется транскрипция теломерных повторов, в результате чего образуются теломерные рибонуклеиновые комплексы (РНП), способные взаимодействовать с другими белками и РНК (Kordyukova et al. 2018, Morgunova et al. 2021). Взаимодействие теломерных РНП с ключевыми белками клеточного цикла вызывает раннюю остановку развития при дисфункции теломер и гиперэкспрессии теломерных повторов. Такой механизм обеспечивает поддержание стабильности генома в ряду поколений.
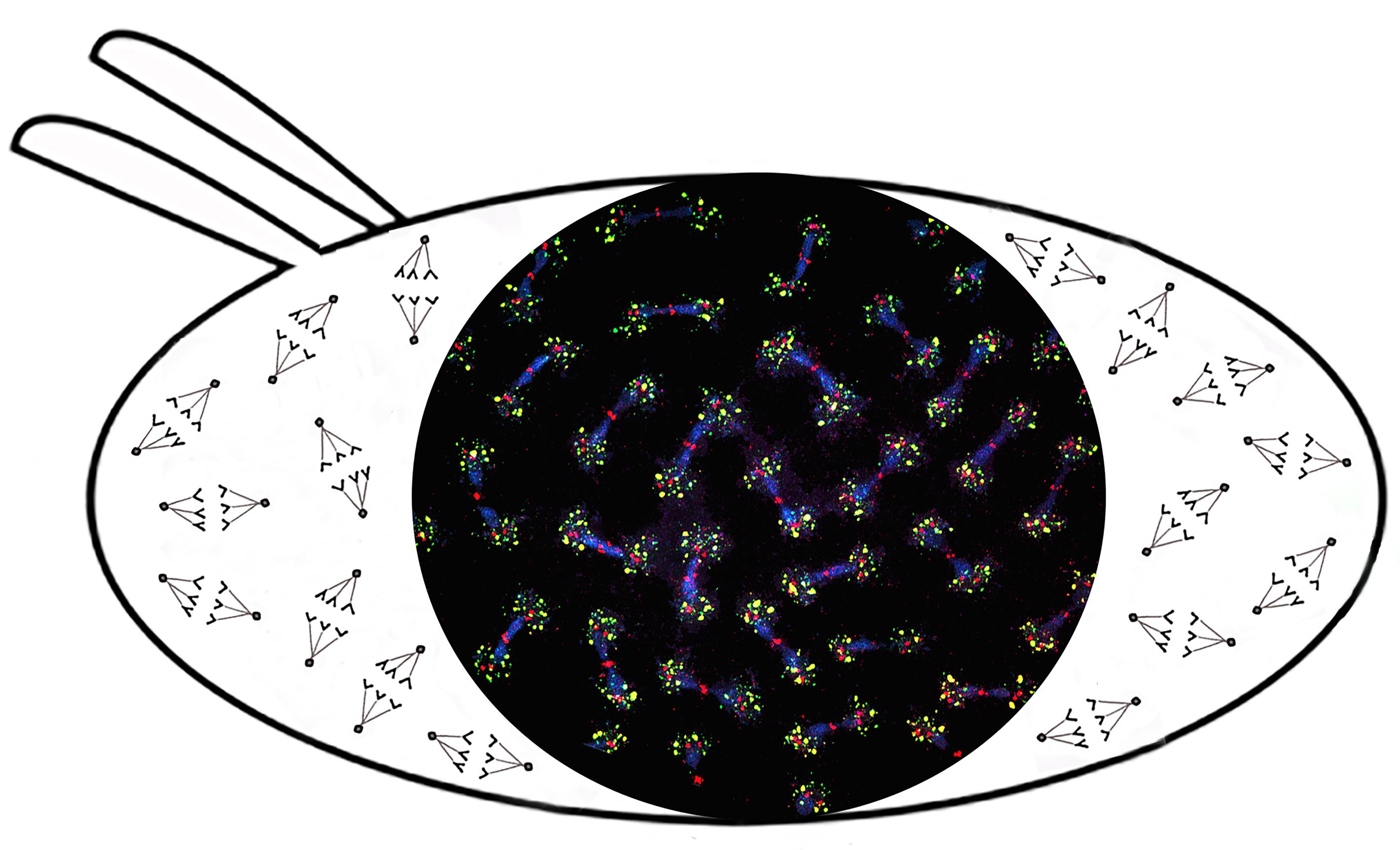
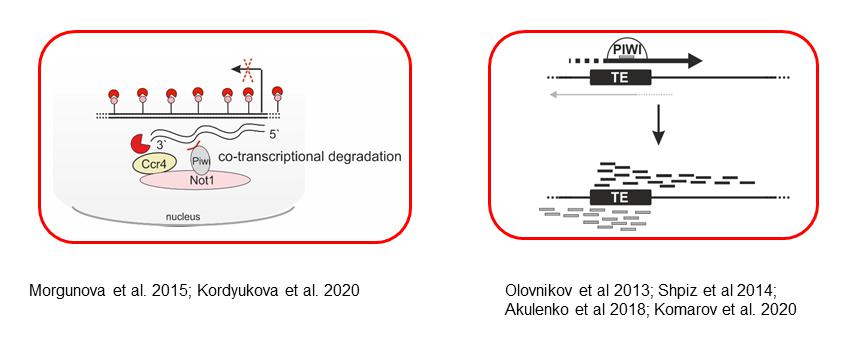
Образование агрегатов теломерных РНК (зеленый) с киназой клеточного цикла Polo (красный) вокруг центросом приводит к нарушению динамики Polo и митотической катастрофе в раннем эмбриогенезе Drosophila. ДНК окрашена синим. Представлены митотические хромосомы в эмбриональном синцитии при нокдауне Ars2, что приводит к активации транскрипции теломерных повторов (Morgunova et al. 2021). Эпигенетика коротких РНККороткие РНК, относящиеся к классу Piwi-interacting RNA (piРНК), играют ключевую роль в контроле активности мобильных элементов в гонадах животных. piРНК в комплексе с белками подсемейства Piwi семейства Argonaute взаимодействуют с комплементарными новообразованными транскриптами мобильных элементов, что приводит к привлечению факторов гетерохроматина на транспозоны и подавление их транскрипции. Мы показали, что, кроме транскрипционного сайленсинга, piРНК также привлекают ядерный деаденилазный комплекс Ccr4-Not, что приводит к котранскрипционной деградации избыточных транскриптов активных транспозонов. В наших работах выявлена новая и очень важная функция piРНК – это способность индуцировать de novo продукцию piРНК в гомологичных локусах генома. Биологический смысл этого явления состоит в умножении количества piРНК, комплементарных транскрибирующимся копиям мобильных элементов, что усиливает защиту генома от наиболее опасных активных транспозонов.
piРНК в герминальных клетках могут индуцировать деградацию транскриптов мобильных элементов в ядре (слева) и формирование de novo продукции piРНК из транскриптов активных копий транспозонов (справа). Контроль активности мобильных элементов с участием piРНК является важнейшим фактором, определяющим нормальный ход гаметогенеза и фертильность. В лаборатории проводится систематический поиск и анализ факторов, необходимых для нормального функционирования системы piРНК в ходе оогенеза дрозофилы.
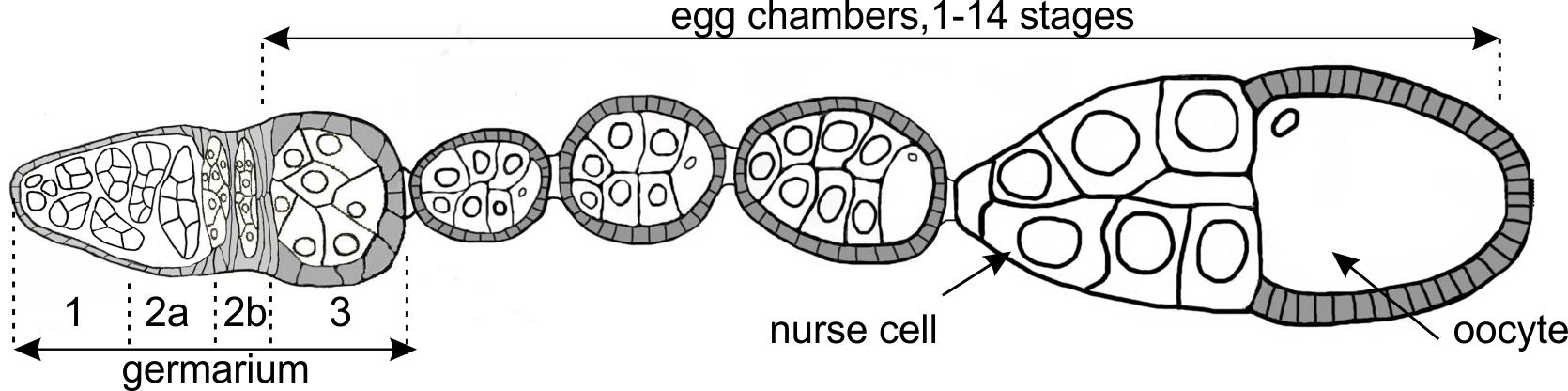
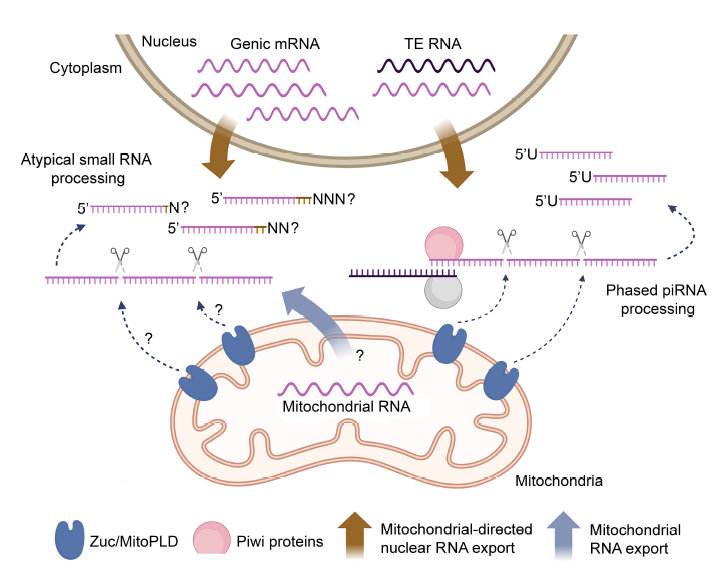
Схема основных стадий оогенеза Drosophila melanogaster. Показана схематично овариола, состоящая из гермария и яйцевых камер на разных этапах оогенеза. Гермарий показан в увеличенном виде. Мы исследуем также особенности соматического биохимического пути с участием piРНК на социально важном модельном объекте – комарах рода Anopheles. В соматических тканях комаров piРНК участвуют в противовирусном ответе. Анализ библиотек коротких РНК из различных тканей самцов и самок комаров рода Anopheles выявил наличие новых генных мишеней эпигенетической регуляции с участием piРНК в соматических тканях (Funikov et al. 2025).
Схема процессинга соматических коротких РНК у комара Anopheles coluzzii (Funikov et al. 2025) КЛЕТОЧНАЯ МОДЕЛЬ СТАРЕНИЯ НА ОСНОВЕ КЛЕТОК ПАЦИЕНТОВ С СИНДРОМАМИ УСКОРЕННОГО СТАРЕНИЯИсследования в области биологии старения человека - стремительно развивающаяся сфера науки. Согласно данным ООН к 2050 году более 2 миллиардов человек будут старше 60 лет, что приведет к значительному росту возрастных патологий. Благодаря различным животным моделям достигнут прогресс в исследовании механизмов старения, однако подобные стратегии не способны отразить биологию заболеваний человека. Перепрограммирование соматических клеток человека в индуцированные плюрипотентные стволовые клетки (иПСК) c их последующей дифференцировкой позволяет получать различные типы клеток in vitro, изучать старение человека и его возраст-ассоциированные заболевания. Технология, основанная на применении иПСК и их производных от пациентов с синдромами преждевременного старения, даёт возможность проследить динамику процесса старения на клеточном, генетическом и эпигенетическом уровнях и представляет собой адекватную модель для изучения старения человека. Подобных клеточных моделей у нас в стране нет. Наш коллектив занимается перепрограммированием фибробластов пациентов с различными прогероидными синдромами и соответствующих им контролей (клетки здоровых пациентов) в иПСК, а также характеристикой развития признаков старения на таких клеточных моделях.
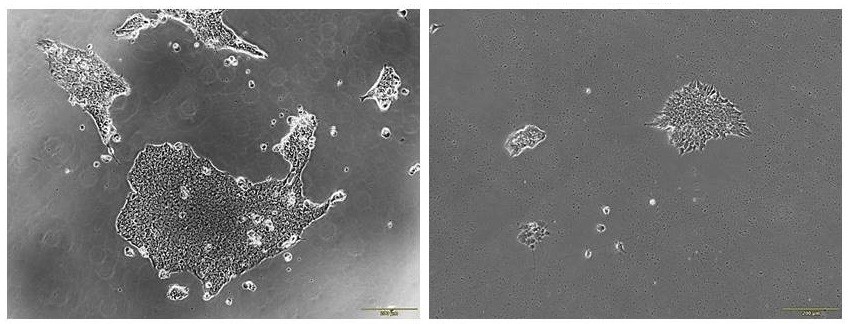
Колонии иПСК, полученные из контрольных и прогероидных клеток. Финансирование проектов№ 24-14-00043 «Молекулярные механизмы и маркеры дисфункции теломер в развитии и клеточных линиях», рук. А.И. Калмыкова Участие в крупных проектах, поддержанных Министерством образования и науки РФ Избранные публикации:
|
|