
Область научных интересов: репликация ДНК, регуляция протеома клеток, макромолекулярные синтезы в раннем развитии, репродукция вирусов.
Развитие технологий редактирования генома клеток человека является наиболее быстро развивающимся направлением клеточной биологии. Помимо хорошо зарекомендовавших себя систем на основе CRISPR–Cas с нуклеазами появились системы редактирования эпигенома, которые не предполагают введение разрывов и чужеродных последовательностей ДНК в гены-мишени.
Преимущества систем редактирования эпигенома очевидны. Исключены мутагенные эффекты вносимой чужеродной ДНК и возможные повреждения генов в разных местах генома. В основе эпигеномного редактирования лежит регулируемое изменение экспрессии собственных генов организма. Методика основана на классических идеях Уоддингтона о том, что фенотип клеток обусловлен эпигенетическими факторами. При этом редактирование эпигенома обеспечивает стабильное изменение экспрессии генов-мишений в ряду клеточных поколений, наследуемое по менделевским правилам. Исследования в области эпигеномного редактирования координируются в рамках консорциума ENCODE NIH в США, Roadmap Epigenomic project и многочисленных (более 45 тысяч) ассоциированных проектов GWAS (Genome-Wide Association Studies). Современное состояние этих исследований хорошо отражено в рецензируемой статье (далее Обзор) группы исследователей из Университета Дьюка в Дареме (Северная Каролина).
Принципиальное отличие систем редактирования CRISPR–Cas с нуклеазами от систем редактирования эпигенома показано на Рис. 1. Изменение экспрессии гена-мишени достигается введением в туже конструкцию узнавания dCas9 с gRNA не нуклеазной активности, а белка-эффектора (или группы эффекторных белков), которые меняют экспрессию гена-мишени.
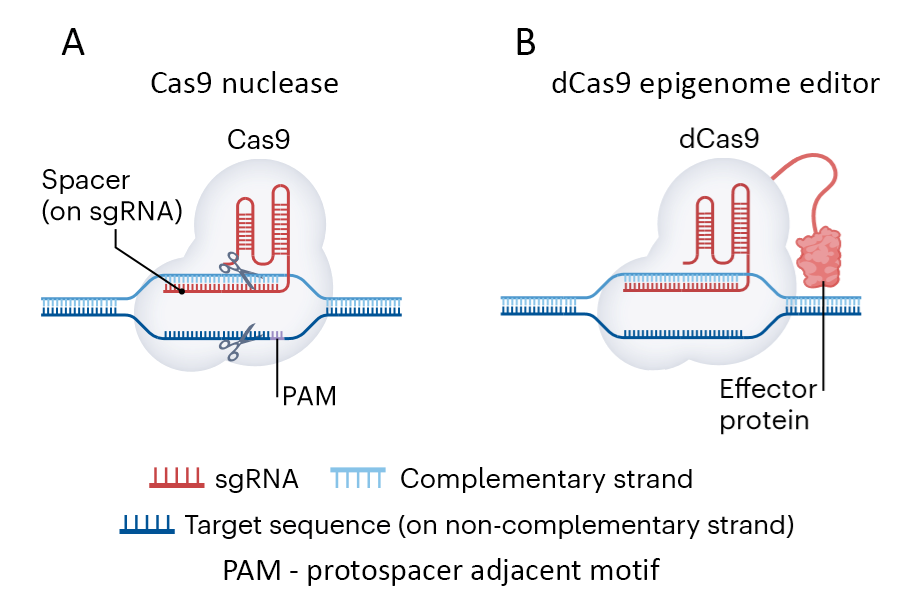
Рис. 1. Отличие системы редактирования CRISPR с Cas9, обладающей нуклеазной активностью, (А) от системы эпигенетического редактирования с dCas9 без нуклеазной активности. но связанной с белковым эффектором, выступающим в роли эпигенетического редактора (В).
Механизмы действия эффекторных белков на экспрессию генов различны, как и различны способы регуляции транскрипции генов. Белки-эффекторы могут менять пространственную структуру генома и степень компактизации хроматина в области гена-мишени за счет изменения локализации транскриционно-ассоциированных доменов (ТАД), связывания некодирующих РНК, связывания ингибирующих или активирующих транскрипционных факторов (ТФ) или введения эпигенетических меток в ДНК и гистоны. Метилирование цитозина в ДНК оказывает ингибирующее действие на транскрипцию (без изменения кодирующих свойств основания), а деметилирование стимулирует транскрипцию. Различные эпигенетические модификации аминокислот в гистонах, в частности лизинов (К) (ацетилирование, метилирование, убиквитинирование и др.), меняют «гистоновый код» в области генов-мишений и оказывают ингибирующее или активирующие действие на их экспрессию (Рис. 2).
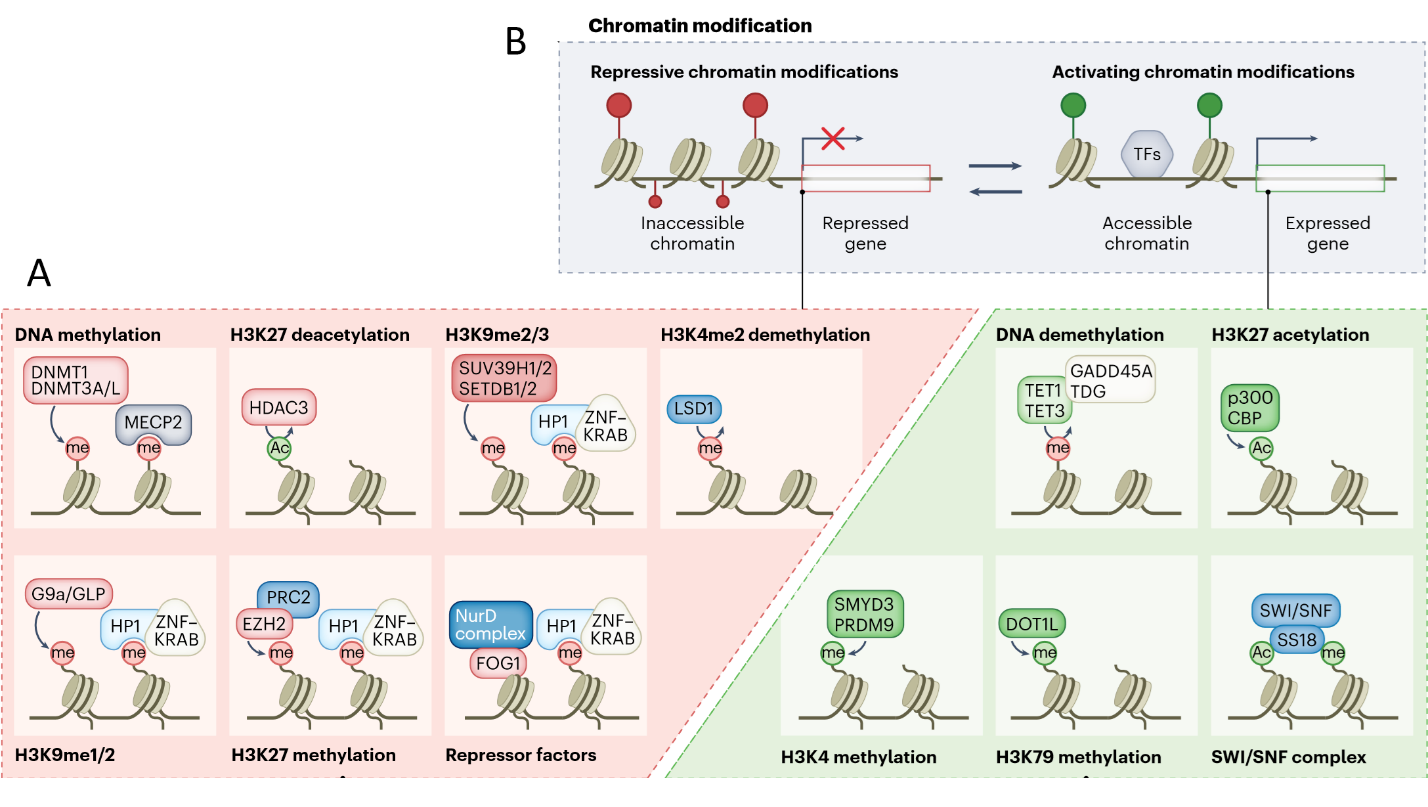
Рис. 2. А. Схематическое изображение эпигенетических модификаций в ДНК и гистонах и их ингибирующее (красный цвет) и стимулирующее (зеленый цвет) влияние на экспрессию генов. В. Иллюстрация ингибирующего (деметилирование гистона Н3К4me2) и стимулирующего (ацетилирование гистона Н3К27) влияния на экспрессию гена в результате модификации структуры хроматина.
Список белковых эффекторов для внесения эпигенетических меток в ДНК и гистоны весьма обширен. В метилировании ДНК участвуют факторы DNMT1 и DNMT3A/L, а в деметилировании TET1, TET3, GADD45A, TDG. Белок MECP2 (reader) участвует в узнавании метилированных оснований ДНК. Деацетилирование гистона Н3К27 оказывает ингибирующее действие на экспрессию и осуществляется деацетилазами гистонов HDAC, а активирующее ацетилирование – факторами р300 и CBP. Многочисленны факторы, оказывающие ингибирующее действие на экспрессию (указаны в скобках): деметилирование H3K4me2 (LSD1); метилирование H3K9me2/3 (SUV39H1/2, SETDB1/2), H3K9me1/2 (G9a/GLP), H3K27 (EZH2). Активирующее действие оказывает метилирование H3K4 (SMYD3, PRDM9) и H3K79 (DOT1L). В регуляции экспрессии генов также участвуют факторы, связывающиеся с модифицированными гистонами (HP1, ZNF–KRAB, PRC2, NurD complex, FOG1, SWI/SNF, SS18). Большой набор факторов, модифицирующих ДНК и гистоны, позволяет выбрать эффекторы наиболее оптимальные для тонкой регуляции экспрессии генов-мишеней. Экспериментально показана регуляторная эффективность для целого ряда комплексных dCRISPR конструкций на основе dCas9: SAM (комплекс HSF1, p65, MCP, MS2, VP64), SunTag (GCN4, scFV, Effector protein), Castillo (PUF, PBS, Effector protein), CEMs (FKBP, CEM, Endogenous epigenetic factor), CRISPR—DREAM (eNRF2, STAT1, MRTF-A, MCP, MS2), CRISPR-Display (Recruitment of proteins, ncRNA, lncRNA), FIRE-Cas9 (Effector protein, Frb, RAP, Fkbp, MCP, MS2). Дополнительную информацию о компонентах этих регуляторных комплексах можно найти в Обзоре и цитируемых оригинальных работах.
Первая и наиболее важная проблема с модификацией эпигенома заключается в идентификации клеточных факторов, участвующих в регуляции интересующего вас гена-мишени. Для этого необходимо провести эпигенетический скрининг регуляторных элементов данного гена с помощью CRISPR-технологии, который должен включать три составляющих компонента: (1) сконструированный вами эпигенетический CRISPR-модификатор. Это может быть dCas9 сшитый с выбранным вами эффектором, (2) библиотека gRNA к выбранным последовательностям генома, (3) система анализа результатов CRISPR-скрининга. Каждый из указанных составляющих скрининга требует выбора из большого числа вариантов.
Выбор эффектора зависит от того, требуется ли активировать экспрессию гена или подавить его активность, и способа, которым планируется регулировать экспрессию (изменение структуры хроматина, химическая модификация оснований в гене, использование транскрипционных факторов, ингибиторов и пр.). В одном из недавних исследований было идентифицировано более 200 транскрипционных активаторов, регулирующих экспрессию 13571 генов человека (Alerasool et al. 2022. Mol. Cell 82, 677–695). Получена библиотека (атлас) из 3548 ORF (открытых рамок считывания) для всех аннотированных изоформ ТФ в стволовых эмбриональных клетках человека с разрешением одиночных клеток (Joung et al. 2023. Cell 186, 209–229). Приведенный в Обзоре каталог апробированных эпигенетических активаторов и репрессоров включает 27 отдельных факторов и их комбинаций. Выбор gRNA зависит от масштаба проекта. Рекомендовано использование небольших библиотек от 3 до 6 индивидуальных gRNA, что делает проекты менее трудоемкими и более финансово рентабельными. Если речь идет об одном гене-мишени, то CRISPRa gRNAs обычно позиционируют в пределах 300 по перед сайтом инициации транскрипции (TSS), а CRISPRi gRNAs позиционируют в пределах от 50 по перед и 300 по после TSS. Анализ экспрессии гена осуществляется методом HCR–FlowFISH (hybridization chain reaction fluorescence in situ hybridization coupled with flow cytometry) или более простым способом традиционными ПЦР и Вестерн-блоттингом. Эффективен сортинг на основе уровня флуоресценции активированных клеток. Если скрининг проводится с набором некодирующих РНК к определенным участкам генома, что ориентировано обычно на изменение структуры хроматина, то анализ экспрессии зависит от целей эксперимента. Возможно секвенирование индивидуальных клеток (scRNA-seq), которое выявляет связь определенных gRNA и mRNA разных генов, что позволяет получить полную картину влияния индивидуальных gRNA на экспрессию разных генов. Также важен анализ выживания и пролиферации клеточных популяций (сell fitness). Сравнение набора gRNA в исходной популяции (клетке) и конечной популяции дает важную информацию о возможности применения этой конструкции для генотерапии. Скрининг на основе выживания и пролиферации клеток позволяет, в частности, выявить гены ответственные за быстрый рост злокачественных клеток.
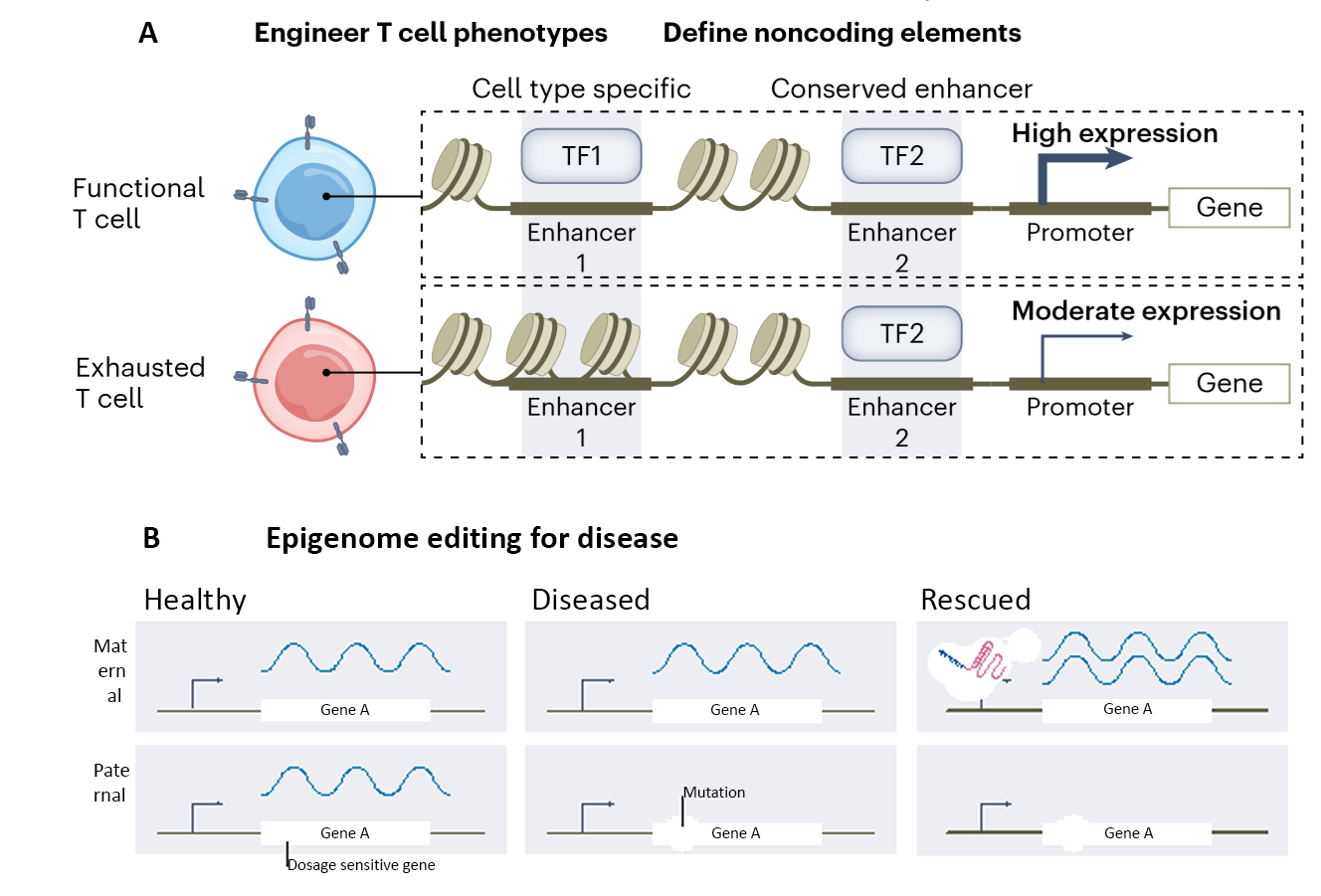
Рис. 3. А. Эпигенетическая модификация увеличивает терапевтический потенциал Т-клеточной иммунотерапии, предотвращая старение и истощение Т-клеток. B. Технология CRISPRa предотвращает патологию, связанную с геплонедостаточностью белкового продукта или аберрантного подавления экспрессии гена.
Известно, что гаплонедостаточность одного из примерно 300 генов обуславливает серьезные метаболические и неврологические нарушения. Редактирование может купировать различные формы заболеваний, связанных с нарушениями эпигенетической регуляции. К ним относятся, помимо гаплонедостаточности, заболевания, связанные с повышенной экспрессией генов, их дупликацией, а также с пониженной экспрессией гена или отсутствием экспрессии. Заболевания, связанные с репрессией генов на одной из Х-хромосом (X-linked disorders), мутациями в промоторах и энхансерах также можно корректировать с помощью редактирования эпигенома. Возможно одновременное эпигеномное редактирование ряда генов (комбинаторное редактирование). В рецензируемом Обзоре приведен список, включающий 18 патологий человека от ожирения до неврологических расстройств, для которых экспериментально показана эффективность эпигенетического редактирования.
Как у каждой сложной клеточной технологии, у редактирования эпигенома имеются методологические проблемы. Клетки разного типа (эпигенетический контекст) могут подвергаться редактированию с разной эффективностью, что может затруднить выработку эффективного протокола редактирования. Доставка конструкции для редактирования в системах in vivo осуществляется с помощью вирусов (AAV, аденовирус, лентивирус) или невирусными векторами (внеклеточные везикулы, липидные наночастицы, электропорация и пр.). Эффективность этих методов зависит от строения и состава клеточных оболочек (в частности, от наличия рецепторов для вирусов). Доза модификатора, время экспозиции (а также, стадия развития в случае организма), специфичность и безопасность протоколов (отсутствие побочных эффектов) являются критическими факторы для медицинских приложений. И самое важное – насколько используемый протокол обеспечивает долговременную модификацию эпигенома. К счастью, клетками и организмами в ходе эволюции выработаны механизмы эпигенетического наследования. Так, модифицированные гистоны корректно переносятся специфическими шаперонами при репликации генома, как на лидирующей, так и запаздывающей нитях ДНК (Toda et al. Mol Cell. 2024. Jul 23:S1097-2765(24)00573-2. doi: 10.1016/j.molcel.2024.07.002.; Yu et al. Cell. 2024 Jul 25:S0092-8674(24)00766-9. doi: 10.1016/j.cell.2024.07.006.).
До сих пор лишь одна из 20 одобренных FDA клеточных терапий основана на редактировании генома. Широкое использование технологий эпигенетического редактирования CRISPRa и CRISPRi в научных исследованиях позволяет надеяться на быстрый прогресс в практическом использовании этих технологий в медицинской практике.
Новость подготовил
© В.С.Михайлов
27.08.2024