
Область интересов: регенерация тканей, клеточная дифференцировка, сигнальный каскад YAP/TAZ, эпигенетика.
Явление эпителио-мезенхимного перехода (epithelial-mesenchymal transition, EMT) давно находится в центре внимания исследовательских проектов в контексте изучения механизмов эмбриогенеза, регенерации тканей, канцерогенеза и других патологий. Ему посвящено множество как исследовательских, так и обзорных научных публикаций. Один из самых новых обзоров, суммирующих самые последние достижения в области EMT, был опубликован в апреле 2024 года в журнале Molecular cell biology, принадлежащей когорте Nature reviews.
Эпителио-мезенхимный переход – процесс, встречающийся как в норме, так и при различных патологиях, описывающий смену клеточного фенотипа от эпителиального к мезенхимному через серию промежуточных стадий. Эпителиальные клетки теряют апико-базальную полярность, разрушают контакты с соседними клетками, приобретают особенности мезенхимных клеток, включая инвазивность: способность распространяться через ремоделированную базальную мембрану и реорганизовать внеклеточный матрикс. Запуск EMT обеспечивается EMT-ассоциированными транскрипционными факторами (EMT-TF). Развитие технологий, основанных на анализе единичных клеток, позволило выявить целую плеяду EMT-состояний, существующих между архетипичными эпителиальным и мезенхимным фенотипами. Частичные EMT-ассоциированые фенотипы включают инвазивный (миграторный), типичный для эмбриональных и неопластических клеток, и неинвазивный, возникающий при фибротических процессах (рис. 1).
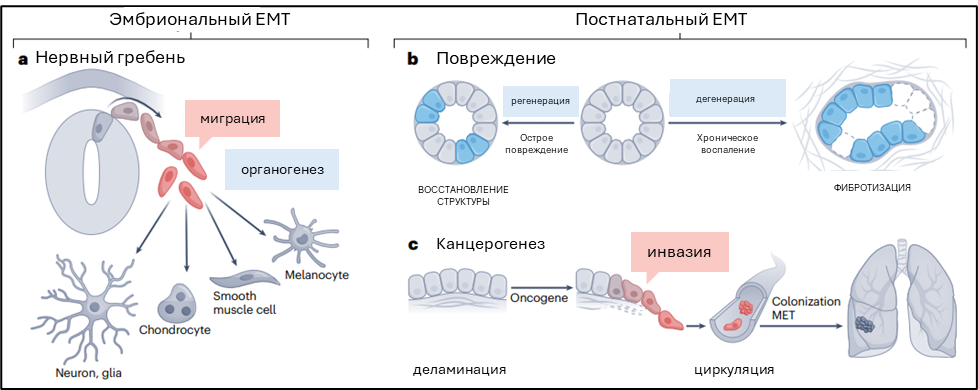
Рисунок 1. Эпителио-мезенхимный переход в развитии и патологии. a. EMT обеспечивает клеточную деламинацию и миграцию в ходе эмбрионального развития в разных тканях: клетки нервного гребня подвергаются EMT и эмигрируют из нервной трубки в необходимые локации, где в дальнейшем дифференцируются. b. Во взрослом организме (не при канцерогенезе) EMT репрессирован при гомеостазе. После повреждения активируется EMT для обеспечения клеточной пластичности, которая необходима для протекания репаративных процессов. При нарушении процессов регенерации и хроническом воспалении, EMT становится длительным и приводит к дегенерации ткани вместо восстановления. с. EMT активируется в клетках раковых опухолей, приводя к повышению инвазивности и метастазированию. MET – mesenchymal -epithelial transition, мезенхимно-эпителиальный переход.
Молекулярная регуляция EMT
EMТ требует активации множества сигнальных каскадов (рис.2). Среди основных сигнальных путей, обеспечивающих EMT, ключевыми являются TGFβ, каскад, ассоциированный с тирозин-киназным рецепторами, WNT, NOTCH. Дополнительные пути включают JAK-STAT, NF-κB, их активация зависит от внешних и внутренних факторов, в том числе повреждение клеток, стресс, гипоксия и провоспалительные цитокины.
Регуляция EMT осуществляется активацией одного или нескольких EMT-TF, чаще всего принадлежащих семействам SNAIL, TWIST, ZEB и PPRX (рис.2). Члены семейства SNAIL являются потенциальными транскрипционными репрессорами, в том числе первыми описанными репрессорами экспрессии E-кадгерина, потеря экспрессии которого является ключевым событием в ЕМТ. SNAI1 задействуют модификаторы хроматина к промоторам генов эпителиального фенотипа, что приводит к разрушению межклеточных контактов, потере апико-базальной полярности и эпителиального фенотипа. Ацетилирование SNAIL1 или его связывание с р65 позволяет переключить активность с репрессирующей на активирующую, обеспечивая экспрессию мезенхимных генов, вовлеченных в ECM, изменение иммунного статуса и приобретение инвазивного фенотипа. Факторы семейства ZEB также являются потенциальными репрессорами эпителиальной программы, которые напрямую связывают или рекрутируют деацетилазы гистонов к промотру гена Е-кадгерина. ZEB1 функционирует как транскрипционный активатор при взаимодействии с эффектором каскада Hippo – YAР, а также факторами семейства АР-1 - FOSL1 и JUN, инициируя запуск мезенхимной трансдифференцировки. Факторы семейства TWIST являются важнейшими активаторами генов мезенхимного фенотипа. Белок PRRX1 функционирует аналогично, взаимодействует с TWIST1, стимулируя приобретение инвазивного фенотипа в эпителии и активации фибробластов при фиброзе и канцерогенезе. Им противостоят репрессоры EMT, к которым относятся семейства транскрипционных факторов OVOL и GRHL, а также набор микроРНК (miR) – let7, miR-34 и miR-200 (рис.2).
Все вышесказанное подчеркивает комплексность и тонкость регуляции активации программы EMT, основанной на взаимодействии позитивных и негативных регуляторов.
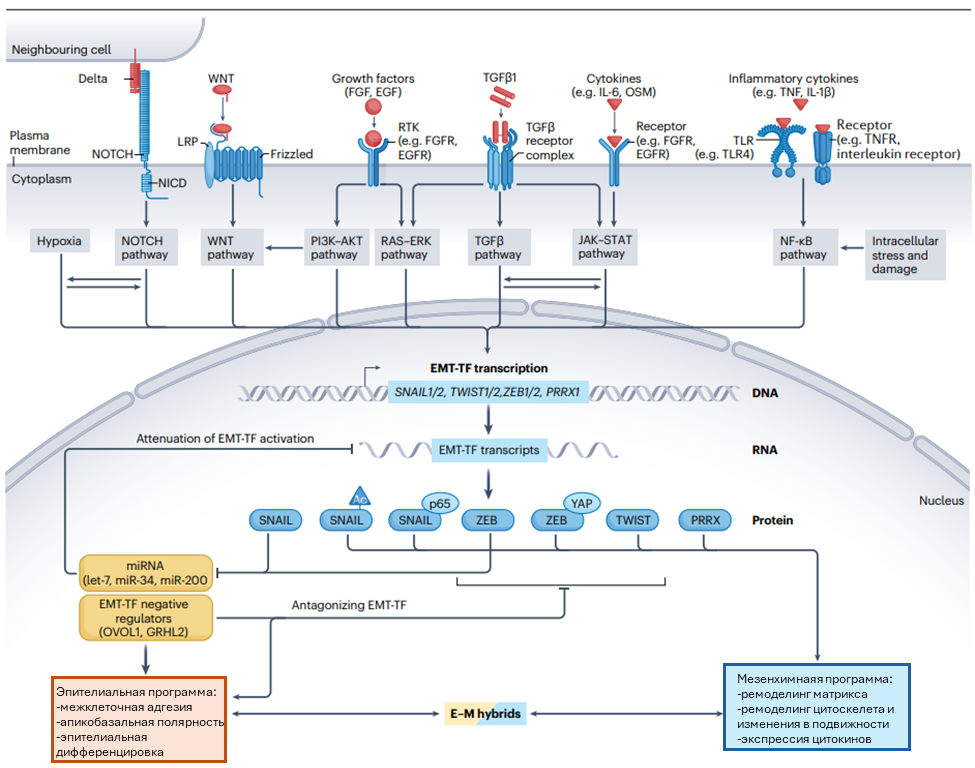
Рисунок 2. Молекулярные механизмы регуляции EMT. EMT инициируется активацией одного или нескольких сигнальных каскадов, стимулирующих активацию EMT-TF, включающих SNAIL, ZEB, TWIST и PRRX. Важнейшим аспектом регуляции EMT является посттранскрипционный контроль, обеспеченный микроРНК, нацеленных на транскрипты EMT-TF. Потеря программы эпителиального фенотипа ассоциируется с активацией мезенхимных генов, включающих ремоделирование цитоскелета, деградацию внеклеточного матрикса и инвазивность. Репрессия эпителиального фенотипа протекает под контролем транскрипционных факторов, принадлежащих семействам SNAIL и ZEB, действие которых координируется с активаторами мезенхимной программы TWIST и PRRX1. Множественные петли негативной обратной связи между EMT-TF и эпителиальными микроРНК, а также факторами, поддерживающими эпителиальную идентичность OVOL и GRHL, позволяют существовать множественным и обратимым стадиям EMT.
Эпителио-мезенхимный переход в эмбриональном развитии
Способность клеток переключаться между эпителиальным и мезенхимным состояниями является ключевой в эволюции в аспекте происхождения новых клеточных типов, тканей и даже органов. Первыми явлениями ЕМТ в развитии является миграция клеток из первичной полоски в ходе гаструляции и клеток нервного гребня по краям нервной трубки.
Частичный или полный ЕМТ определяет клеточную миграцию
Эмбриональные клетки подвергаются частчному или полному ЕМТ, степень которого определяется клеточной судьбой, путем миграции и финальной локацией. Клетки эпибласта в ходе гаструляции подвергаются ЕМТ и деламинируют из первичной полоски, в дальнейшем специализируясь в несколько клеточных типов. Предшественники как антериорной мезодермы, так и дефинитвной эндодермы активируют программу ЕМТ, однако предшественники дефинитивной эндодермы сохраняют некоторые эпителиальные маркеры, что указывает на частичный и обратимый EMT, что соотносится с коротким путем миграции, быстрым восстановлением полярности и интеграцией в гипобласт. Выраженность миграции определяется взаимодействие между транскрипционными факторами SNAIL1 и FOXA2. FOXA2 инициирует ЕМТ репрессируя WNT на ранних стадиях формирования эндодермы, и SNAIL2 на более поздних стадиях, в то же время в мезодермальных клетках SNAIL1 взаимодействует с FOXA, стимулируя более выраженный ЕМТ.
В трофобласте ЕМТ способствует инвазивности материнского эндометрия и подлежащего миометрия в ходе имплантации. Как и в случае предшественников эндодермы клетки трофоэктодермы сохраняют эпителиальные маркеры, в том числе экспрессию кератина 7. За инициацию ЕМТ в трофоэкстодерме, в том числе программы инвазивности (экспрессия металлопротеиназ и PAPPA) и иммуносупрессивности (экспрессия TGFB, PDL1, TIGIT), отвечает SNAIL1. Аналогичный механизм задействуется при канцерогенезе в других тканях.
EMT способствует клеточной пластичности
Дериваты нервного гребня формируются уже после полной спецификации нейральной пластинки. Однако дифференцировочной пластичности этих клеток дотаточно, чтобы формировать не только нейральные, но и мехенхимные производные. Клетки нервного гребня могут мигрировать одиночно или кластерно. При достижении места назначения они подвергаются vезенхимно-эпителиальному переходу (МЕТ). В некоторых случаях, например, при формировании клапанов сердца, смена ЕМТ-МЕТ происходит несколько раз.
При завершении органогенезов клетки утверждают свою дифференцировочную программу и начинают функционировать как единая ткань. Процессами дифференцировки управляют антагонисты ЕМТ: GATA3, GATA6, KLF4, HNF4a, OVOL1/2 и GRHL2. ЕМТ и МЕТ дополняют друг друга, координируя морфогенетические процессы. Нарушения в их регуляции приводят к канцерогенезу и дегенеративным возрастным заболеваниям.
ЕМТ в восстановлении тканей взрослого организма
В тканях взрослого организма пролиферативный потенциал ограничен, чтобы заполнить утраченную при травме клеточную массу необходима активация более специализированных процессов. Именно ЕМТ позволяет вернуть клеточную пластичность. Дедифференцировка клеток способствует возвращению к более высоко пролиферативному состоянию, что позволяет получить нужное количество клеток для замещения потерянных тканей и функций. С другой стороны, повреждение клеток при травме запускает механизмы клеточной гибели и способствует формированию сценесцентного стареющего фенотипа. В этом случае ЕМТ сохраняет клеточную жизнеспособность (рис.3).
Один из EMT-TF – SNAIL - активируется под воздействием стресса или сигналов к апоптозу для репресии р53, ключевого активатора клеточной гибели (рис.3). В этом случае SNAIL1 и SNAIL2 напрямую ингибируют членов каскада р53. Таким образом, EMT-TF обеспечивает защиту от клеточной гибели.
Формирование сценесцентного фенотипа клеток характеризуется остановкой клеточного цикла, накоплением ингибиторов пролиферации p16INK4 и p144ARF и медиаторов клеточного стресса р53, р19ARF, PAI1 и NF-κB. Активация EMT-TF, в частности TWIST, приводит к метилированию гена и последующей репрессии транскрипции Cdkn2a, кодирующего как p16INK4, так и p144ARF.
Дедифференцировка и последующее восстановление специализации необходимо для корректного восстановления функциональности и структуры органов. Для амфибий при утрате конечностей характерно формирование бластемы, гетерогенной популяции мультипотентных прогениторных клеток, которые в будущем формируют новую конечность. Эксперименты по отслеживанию клеточной судьбы указывают на то, что источником клеток бластемы является скорее дифференцированная ткань, прошедшая ЕМТ, чем резидентные стволовые клетки. С усложнением эволюционной специализации организмов механизмы регенерации все менее эффективны в восстановлении утраченных структур. У млекопитающих регенеративный потенциал более ограничен.
ЕМТ в регенерации тканей млекопитающих может протекать зависимо и независимо от вспомогательных клеток (рис.3с, d). В независимом варианте ЕМТ способствует регенерации инициируя непосредственную дедифференцировку соматических, кратковременно откатывая их до состояния предшественников (рис 3с). При травме почек эпителий канальцев подвергается ЕМТ для активации пролиферации, что соотносится с изменением клеточной морфологии: потере кубоидной формы и приобретению более вытянутого фенотипа. Прошедшие ЕМТ клетки меняют профиль экспрессии маркеров с дифференцированных на эмбриональные. ЕМТ протекает частично: клетки не становятся инвазивными и способными к миграции, как эмбриональные или опухолевые. Подобное поведение типично и для клеток других органов при повреждении, в частности печени и почек.
Другой вариант вовлеченности ЕМТ в процесс регенерации подразумевает привлечение дополнительных клеток в поврежденную область. Этот механизм основан на изменении в паракринном сигналинге при активации ЕМТ (рис. 3d). Ярчайшим примером такого поведения является задействование глиальных, эндотелиальных и иммунных клеток в области повреждения нервов. Важно, что после миграции в необходимую область, клетки должны пройти обратную дифференцировку для восстановления тканевых и органных функций.
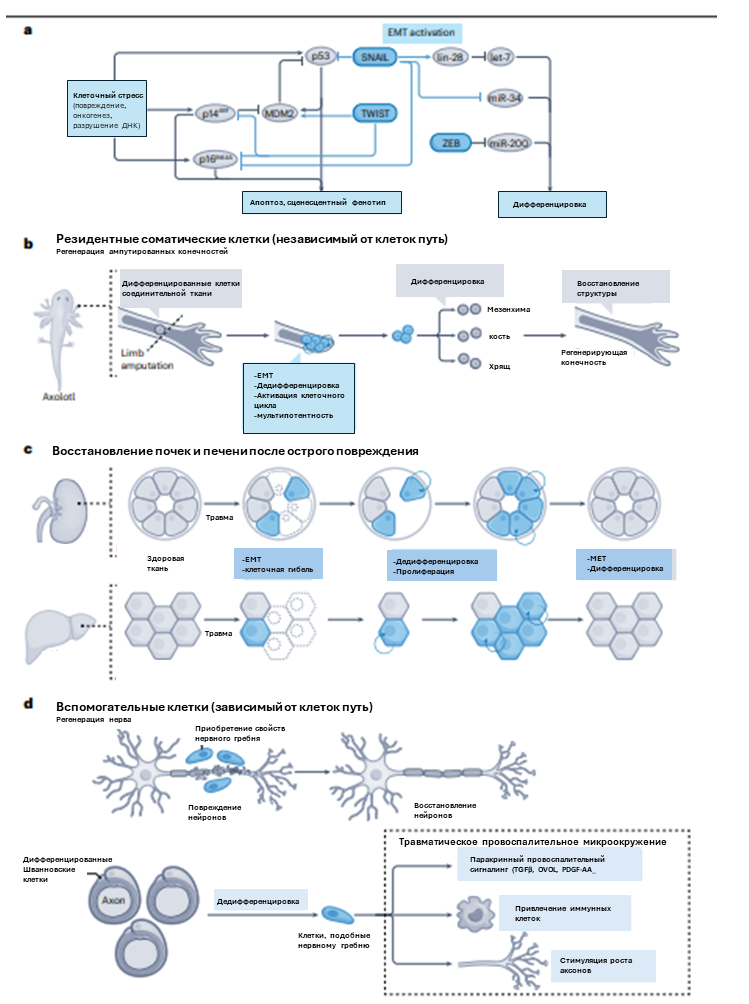
Рисунок 3. а. ЕМТ в регенерации тканей. Инициация ЕМТ посредством ЕМТ-TF ингибирует клеточную гибель и приобретение сценесцентного фенотипа. EMT-TF репрессирует микроРНК, блокирующие дедифференцировку, сохраняя или стимулируя формирование низкодифференцированного состояния. b. ЕМТ обеспечивает восстановление тканей по независимому от клеток принципу запуская эпиморфоз. Репаративная регенерация ампутированных конечностей у акслотля основана на активации ЕМТ в клетках соединительной ткани, приводя к дедифференцировке, возвращению в клеточный цикл и формированию бластемы. с. После повреждения резидентные эпителиальные клетки почечных канальцев или гепатоцитов печени подвергаются серии ЕМТ-МЕТ. Временный ЕМТ способствует клеточной дедифференцировке и пролиферации до начала МЕТ, который запускает механизмы дифференцировки и восполнения утраченных тканей. d. ЕМТ стимулирует регенерацию по альтернативному пути. После повреждения переферического нерва шванновские клетки временно активируют ЕМТ и дедифференцируются приобретая фенотип нервного гребня, для ремоделинга микроокружения, активации иммунных клеток, секреции факторов роста, необходимых для роста аксонов.
Сравнение эмбрионального и постнатального ЕМТ
Инвазивность
В отличие от механизмов ЕМТ, активирующихся в эмбриогенезе и при канцерогенезе, ЕМТ в тканях взрослого организма не придает клеткам значительной подвижности и инвазивности. Репрограммирование способствует их временной экспансии в пределах одной ткани.
Рубцевание
Регенерация постнатальных тканей ассоциирована с формированием рубца. ЕМТ протекает совместно с процессом активации фибробластов и последующей дифференцировки в миофибробласты, сопровождающейся увеличением продукции внеклеточного матрикса и повышением жесткости ткани.
В эмбриональных тканях регенерация протекает без формирования рубцов. Низкая интенсивность рубцевания сопряжена со снижением количества миофибробластов, а следовательно, и меньшим изменениям в структуре внеклеточного матрикса. Восстановленная постнатальная ткань содержит большое количество низкоорганизованных волокон коллагена I типа, в то время как эмбриональный матрикс восстанавливается за счет коллагена III типа и гиалуроновой кислоты. Такой матрикс способствует более быстрому восстановлению дифференцированного состояния клеток после завершения регенеративных процессов.
Цитокины
В эмбриогенезе провоспалительное окружение в поврежденной ткани значительно менее выражено в сравнении с постнатальным состоянием. Незрелая иммунная система является причиной меньшей представленности иммунных клеток, в том числе макрофагов, в области повреждения. Снижено содержание TGFβ1 и TGFβ2 за счет повышения экспрессии TGFβ3, что подавляет процесс активации фибробластов. К тому же в эмбриональных ранах экспрессируется противовоспалительный и иммуносупрессивный Il10.
Метаболизм
В клетках, прошедших ЕМТ, наблюдается эффект Варбурга – метаболитическое переключение к анаэробному гликолизу с окислительного фосфорилирования. Недавние исследования указывают, что эффект Варбурга является следствием реактивации эмбриональных процессов. Переключение на гликолитический метаболизм активирует некоторые сигнальные каскады, в том числе YAP/TAZ, способные контролировать экспрессию EMT-TF, в том числе SNAIL и ZEB. Ингибирование захвата глюкозы в восстанавливающейся ткани приводит к снижению интенсивности процессов регенерации, что является следствием подавления ЕМТ, снижением экспрессии TGFβ и Snail.
Доминирование гликолиза над окислительным фосфорилированием в эмбриональном и постнатальном ЕМТ указывает на схожесть этих механизмов. Эффект Варбурга не специфичен именно для раковых клеток, однако связан с клеточной дифференцировочной пластичностью.
ЕМТ в тканях взрослого организма при дегенерации и фиброзе
Сигнальный каскад YAP/TAZ
Активация паралогов YAP и TAZ, эффекторов пути Hippo, дедифференцирует клетки до состояния прогениторов: подобное описано для клеток печени, почек, кишечника. YAP индуцирует экспрессию SNAIL1 и репрессируя HNF4, способствующий поддержанию дифференцированного состояния. При повреждении почек временная аккумуляция YAP в ядре приводила к дедифференцировке, появлению экспрессии мезенхимных маркеров, однако последующему восстановлению, включающему экспрессию специализированных маркеров дифференцировки. Таким образом, активация YAP и EMT – один из первых этапов, способствующих успешной регенерации (рис.4а).
Длительное состояние ЕМТ приводит к фиброзу
Роль ЕМТ в фибротических изменениях до сих пор остается обсуждаемым вопросом. Недавние исследования, основанные на анализе единичных клеток, подтвердили, что эпителиальные клетки не являются источником миофибробластов в легких, почках и печени. Между тем, факт, что длительный и необратимый ЕМТ коррелирует с фиброзом, не подвергается сомнению (рис.4b).
Предполагаются некоторые механизмы патологических обратных связей, объясняющих корреляцию между ЕМТ и фибротической прогрессией. Оверэкспрессия SNAIL1 вызывает длительный ЕМТ в почечном эпителии, что в итоге приводит к фиброзу почек, в то же время делеция Snail1 или Twist тормозит развитие фибротических изменений. Пострадавшие и прошедшие ЕМТ клетки почечного эпителия секретируют TGFβ, который в свою очередь стимулирует трансформацию фибробластов в миофибробласты, которые в свою очередь выделяют цитокины для привлечения макрофагов, стимулируя фиброгенез и воспаление – типичные признаки фиброза. Усилению фиброза способствует активация сигнального каскада YAP/TAZ, опосредованная увеличившейся жесткостью регенерирующией ткани. YAP/TAZ стимулирует продукцию TGFβ1, под воздействием которого повышается экспрессия белка TAZ, запускающего прогрессию ЕМТ, чем обеспечивает положительную обратную связь.
Хроническое воспаление приводит к длительному ЕМТ и препятствует восстановлению ткани
Хроническое воспаление является одним ключевых аспектов тканевого фиброза (рис.4). Программа ЕМТ в эпителиальных клетках, запускающаяся в ответ на повреждение ткани, приводит к активации иммунных клеток, необходимых для формирования провоспалительного микроокружения (рис.4b). Активация пути YAP при воспалении и под воздействием жесткого рубцового внеклеточного матрикса увеличивает длительность ЕМТ и поддерживает формирование патологической ситуации. Например, в модели длительной ишемии-реперфузии почек, длительное накопление YAP в ядрах сопутствует увеличению числа макрофагов. Длительный ЕМТ приводит к формированию необратимого фенотипа, что в итоге блокирует клеточную дифференцировку и дальнейшую регенерацию.
Резюмируя, инициация ЕМТ крайне важна для регенерации тканей после повреждения, однако хроническое воспаление, нарушение активности сигнального каскада YAP/TAZ, метаболитические нарушения являются причиной увеличения длительности ЕМТ и последующего тканевого фиброза, что нарушает способность тканей и органов выполнять свои функции (рис.4).
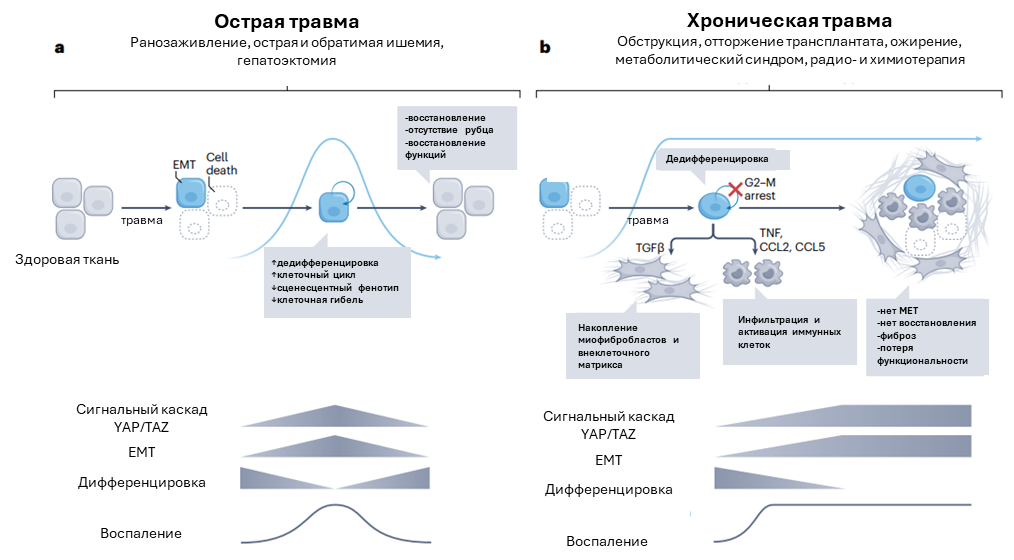
Рисунок 4. ЕМТ в постнатальных тканях: восстановление или деградация. а. При острой травме ЕМТ активируется временно для стимуляции клеточной дедифференцировки, пролиферации и жизнеспособности. Временный ЕМТ согласуется с временной активацией других восстановительных процессов, включая воспаление, сигнальный каскад YAP/TAZ и метаболитические изменения. b. При хроническом воспалении ЕМТ становится стабильным и необратимым, его функции переключаются с прорегенеративных на дегенеративную, обеспечивая необратимую дедифференцировку и остановку клеточного цикла. Более того, ЕМТ стимулирует секрецию TGFβ и провоспалительных цитокинов поврежденными эпителиальными клетками, стимулируя активацию миофибробластов и привлечение иммунных клеток. EMT приводит к формированию положительной обратной связи между воспалением, YAP/TAZ и метаболитическими нарушениями, стимулируя фибротическую прогрессию.
Воздействие на ЕМТ в терапевтических целях
Ингибирование ЕМТ для терапии фибротических изменений
Фиброз является существенной причиной поражения множества органов, приводящей к серьезным заболеваниям и гибели. ЕМТ является привлекательным механизмом, на блокировку которого могут быть направлены разрабатываемые средства противофибротической терапии (рис.5).
Одно из направлений работы - воздействие на сигнальный каскад TGFβ. К разрабатываемым стратегиям относится использование антисмысловых нуклеотидов, моноклональных антител, конкурентных лигандов для рецепторов или ингибиторов TGFβR-ассоциированных киназ (рис. 5а). Использование инкапсулированных микроРНК в микровезикулах в настоящее время рассматривается как наиболее безопасный подход. Генетическая терапия, основанная на экспрессии ингибиторных SMAD, продемонстрировала хорошие результаты в терапии почек и печени на мышиных моделей. Тем не менее каскад TGFβ достаточно важен в поддержании тканевого гомеостаза, поэтому терапия в перспективе обладает значительными побочными эффектами.
Другой более безопасной мишенью для разрабатываемых препаратов были выбраны EMT-TF. Поскольку транскрипционные факторы – внутриклеточные белки, основным подходом, лежащим в основе разрабатываемых препаратов, является применение антисмысловых нуклеотидов. Длительное применение антисмысловых нуклеотидов против Snail1 существенно сократило выраженность ЕМТ, последующий фиброз и воспаление, чем замедлило патологические изменения в почках в мышиной модели. Существуют препараты, снижающие экспрессию EMT-TF. Метформин ингибирует активацию TGFβ, редуцируя фиброз в почках у мышей. Другим действием метформина является непосредственное влияние на эффекторы ЕМТ через петли обратной связи SNAIL-miR-34 и ZEB-miR-200. Непосредственное использование miR-200 активирует let-7c, ингибирующую сигнальный каскад TGFβ и последующий ЕМТ. Использование мезенхимных клеток, продуцирующих экзосомы, содержащие let-7, снижает выраженность фибротических изменений в почках.
Обратить ЕМТ можно посредством стимуляции клеточной дифференцировки. Стимуляция экспрессии HNF4 в поврежденных гепатоцитах снижает выраженность хронического воспаления при циррозе. Активация этого гена также крайне важна для корректной регенерации почечного эпителия.
Другой мишенью является сигнальный каскад YAP/TAZ. Ингибитор этого каскада, вертепорфин, снижает экспрессию TGFβ, подавляет воспаление и активацию миофибробластов на модели фиброза почек у мышей. Подкожная инъекция малых интерферирующих РНК к TAZ препятствует фибротическим изменениям в печени. Совместное ингибирование YAP на фоне активации HNF4 может способствовать более эффективному восстановлению тканевых структур.
Альтернативной стратегией может служить индукция ферроптоза, достаточно специфического механизма клеточной гибели, выявленного у опухолевых клеток. Также можно воздействовать напрямую на метаболизм. Эмпаглифлозин, препарат, блокирующий захват глюкозы, обращает фибротические сигнатуры в почечных канальцах и активацию миофибробластов в почках. Ингибирование гексокиназы и фосфофруктокиназы сокращает популяцию миофибробластов при почечном и легочном фиброзе. Терапия, направленная на блокирование гликолиза, выглядит наиболее эффективной стратегией разработки антифибротических препаратов.
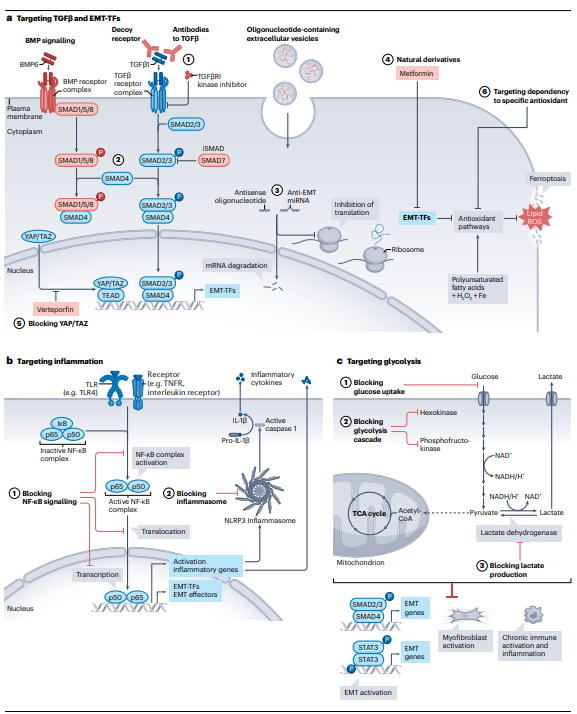
Рисунок 5. Воздействие на ЕМТ для блокировки фибротических изменений. а. Резюме стратегий, разработанных для ингибирования сигнального каскада TGFβ, EMT-TF и других уязвимых мест. b. Стратегии, направленные на подавление провоспалительных процессов.
Активация ЕМТ для стимуляции регенерации тканей
Успешная регенерация требует формирования пула низкодифференцированных клеток. На мышиных моделях идет подбор условий стимуляции реактивации дифференцировочных программ (рис. 3b). Одной из новых уникальных моделей являются иглистые мыши Acomys cahirin благодаря своим уникальным способностям к регенерации тканей: восстановлению хряща после повреждения и блокированию развития фиброза почек при уретральной обструкции. К тому же в сравнении с обычными лабораторными мышами у иглистых наблюдается значительное снижение клеток со сценесцентным фенотипом. Суммарно, это делает акомисов весьма перспективными животными для разработки стратегий управления регенративным потенциалом.
Стимуляция ЕМТ для регенерации в норме не восстанавливающихся тканей – другое направление подобных исследований. С этой целью изучают неонатальные ткани, в которых клетки сохранили высокий регенеративный потенциал. Такие исследования проводятся на кардиомиоцитах, которые не регенерируют во взрослом организме, но весьма пластичны в неонатальном периоде, когда воспроизводят механизмы регенерации по пути, типичному для рыб и амфибий (рис.6). В этот период за активацию механизмов дедифференцировки отвечает инициация пути ERBB2-YAP. Оверэкспрессия ERBB2 во взрослых кардиомиоцитах стимулирует ЕМТ и последующую дедифференцировку (рис.6). Это указывает на репрессию ЕМТ в некоторых взрослых тканях, препятствующую полноценной регенерации. Разрабатывая терапию, направленную на активацию ЕМТ, необходимо учитывать важность сохранения временного характера. Для этого можно использовать доставку эффекторов ЕМТ в наночастицах, вирусы, не интегрирующиеся в клеточный геном, оптогенетику и системы, основанные на использовании дегронов.
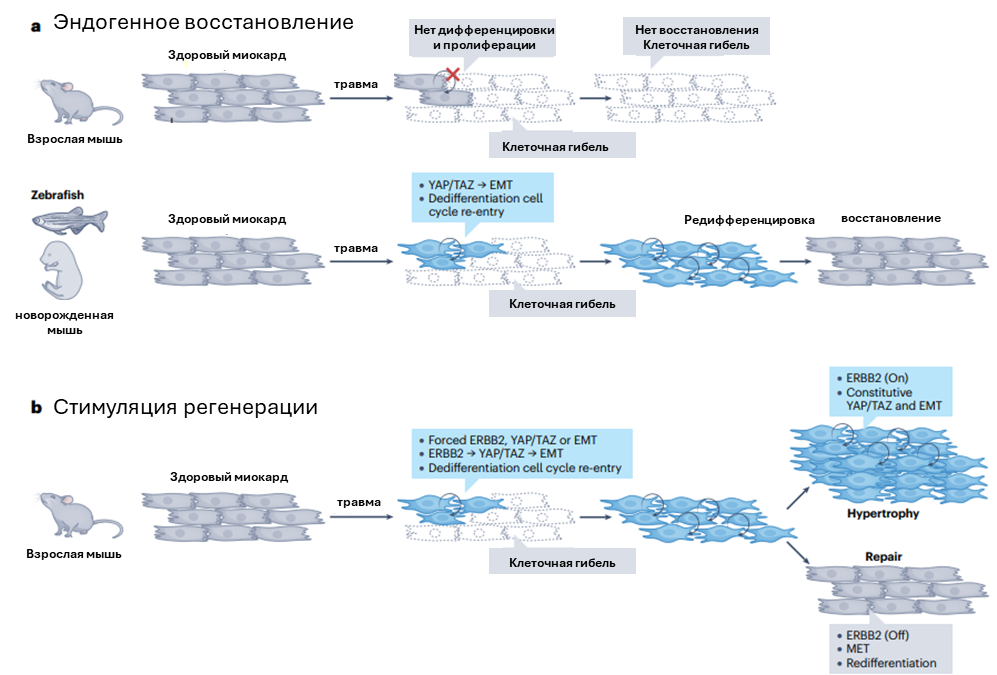
Рисунок 6. Временная активация ЕМТ для стимуляции восстановления нерегенерирующих тканей. а. В отличие от модельных рыб и неонатальных мышей, взрослая ткань сердца млекопитающих не обладает способностью к регенерации при повреждении миокарда. b. Активация ERBB2 в постнатальных кератиноцитах индуцирует ЕМТ, ассоциированный с дедифференцировкой и восстановлением пролиферации. Длительная оверэкспрессия ERBB2 в свою очередь приводит к тканевой гипертрофии.
Заключение и перспективы
Способность к восстановлению тканей и регенерации сокращается с эволюционным усложнением и возрастом. Ткани содержат пулы стволовых клеток, которые отвечают за поддержание регенерации в гомеостазе. При повреждении задействуются альтернативные пути восстановления, включая воспаление и ЕМТ. ЕМТ лежит в основе дедифференцировки соматических клеток, необходимой для достижения эпиморфной пластичности с целью восстановления утраченных тканей. Активация ЕМТ важна не только для нерегенерирующих тканей, таких как сердце или мозг, но и для органов, содержащих стволовые ниши. ЕМТ в таких тканях может способствовать восстановлению структуры ниши при ее повреждении.
Возрастные изменения ассоциированы с накоплением клеток со сценесцентным фенотипом. Стратегии, направленные на терапии возрастных заболеваний, включают в себя метаболитическую реактивацию таких клеток, или их удаление, или репрограммирование. Запуск ЕМТ в таких клетках может задействовать все подходы разрабатываемой терапии.
Хотя в настоящее время разница между регенеративными и дегенеративными аспектами ЕМТ становится все более очевидна благодаря мультиомиксным технологиям, более детальное изучение сигнальных сетей EMT-TF, запускаемых при репарации или дегенерации, позволит определить новейшие подходы к управлению морфогенезом в нормальной или патологической стволовой нише, что безумно важно в развитии современных медицинских подходов.
Новость подготовила
© Е.П. Калабушева
12.09.2024