для манипулирования полом потомства у мышей
Yosef I, Edry-Botzer L, Globus R, Shlomovitz I, Munitz A, Gerlic M, Qimron U. A genetic system for biasing the sex ratio in mice. EMBO Rep. 2019. 20(8):e48269.https://doi.org/10.15252/embr.201948269.
Douglas C, Maciulyte V, Zohren J, Snell DM, Mahadevaiah SK, Ojarikre OA, Ellis PJI, Turner JMA. CRISPR-Cas9 effectors facilitate generation of single-sex litters and sex-specific phenotypes. Nat Commun. 2021. 3;12(1):6926. https://doi.org/10.1038/s41467-021-27227-2.
Yosef I, Mahata T, Chen Y, Bar-Joseph H, Shalgi R, Munitz A, Gerlic M, Qimron U Engineering mice for female-biased progeny without impacting genetic integrity and litter size. bioRxiv 2023.11.21.568055; doi: https://doi.org/10.1101/2023.11.21.568055.

Область интересов: сперматогенез, сеть семенника, клетки Сертоли, развитие семенника, биология сперматогониальных стволовых клеток
Во многих отраслях сельского хозяйства, таких как молочная промышленность, птицеводство, производство шерсти, шелка и др., а также научных исследованиях, касающихся репродуктивной системы, рака молочной железы или простаты, используются животные преимущественно одного или только одного пола. В этой связи, технология контролирования пола получаемого потомства имеет не только важное экономическое значение, но и позволит разрешить многие этические проблемы, связанные с избавлением от нежелательных потомков.
В стенах нашего института проблемой манипулирования полом потомства в 1940-е гг. занимался академик Борис Львович Астауров на своем излюбленном объекте биологии развития тутовом шелкопряде (Bombyx mori). Коконы шелкопряда используются для производства шелка. Известно, что в коконах мужских особей содержится примерно на четверть больше шелка, чем в женских и, следовательно, получение только самцов экономически более выгодно. Борис Львович нашел два способа решения проблемы. Первый – температурное воздействие на только что оплодотворенные яйца, приводящее к инактивации женского ядра зиготы. В этом случае оплодотворение завершалось слиянием двух ядер спермиев, в результате чего все зародыши были самцами, так как мужской пол у шелкопряда гомогаметный и определяется двумя одинаковыми половыми хромосомами (ZZ). Второй способ получения андрогенного, т.е. мужского потомства шелкопряда – это инактивация женского ядра яйцеклетки рентгеновским облучением с последующим оплодотворением .
У некоторых беспозвоночных, а также позвоночных животных с наружным оплодотворением, имеющих промысловое значение (например, ракообразные, рыбы), пол потомства часто определяется температурным фактором или кислотностью окружающей среды, в которой происходит оплодотворение, что легко позволяет получать особей нужного пола. Такой подход, однако, не может быть использован для получения только самцов или самок у млекопитающих, у которых пол определяется набором половых хромосом. У млекопитающих гетерогаметным полом является мужской и определяется наличием двух половых хромосом (XY), а женский пол, наоборот, гомогаметный (XX). Так как гаметы гаплоидны и несут только одну из половых хромосом то, следовательно, у самцов могут быть сперматозоиды двух типов, содержащие только X или только Y хромосому. При этом Y хромосома, как правило, меньше X хромосомы, что приводит к небольшим различиям в весе и размере между “X” и “Y” гаметами. Интересно, что такие различия у некоторых видов, например, у крупного рогатого скота, достаточно существенны, что позволяет отсортировать сперму перед проведением искусственного осеменения, но используемая технология является очень дорогостоящей и не подходит для других видов сельскохозяйственных животных. В этом случае единственным альтернативным методом контроля соотношения полов у потомства может стать генетическая селекция. Генетическая селекция может быть достигнута, например, путем встраивания в одну из половых хромосом отца гена «самоубийства». Если, к примеру, мы встроим такой ген в Y хромосому, будут погибать все потомки мужского пола, а если в X – то женского. Такая модель потребует также наличия еще гена «триггера», приходящего от матери, который бы включал ген «самоубийства» в образующемся после оплодотворения зародыше. Вариации этого подхода с использованием CRISPR-Cas9 технологии направленного редактирования генома были уже использованы для манипуляции полом потомства у рыбки данио-рерио (Yin et al., 2015. https://doi.org/10.1534/genetics.115.176917), комаров (Galizi et al., 2016. https://doi.org/10.1038/srep31139), шелкопряда (Zang et al., 2018. https://doi.org/10.1073/pnas.1810945115) и дрозофилы (Fasulo et al., 2020. https://doi.org/10.1371/journal.pgen.1008647). У млекопитающих такой подход до недавнего времени осуществить не удавалось из-за определенных сложностей с экспрессией генов, расположенных на половых хромосомах. В настоящем обзоре мы рассмотрим три недавних исследования, отражающих эволюцию в подходе к генетической селекции потомства по полу у лабораторных мышей.
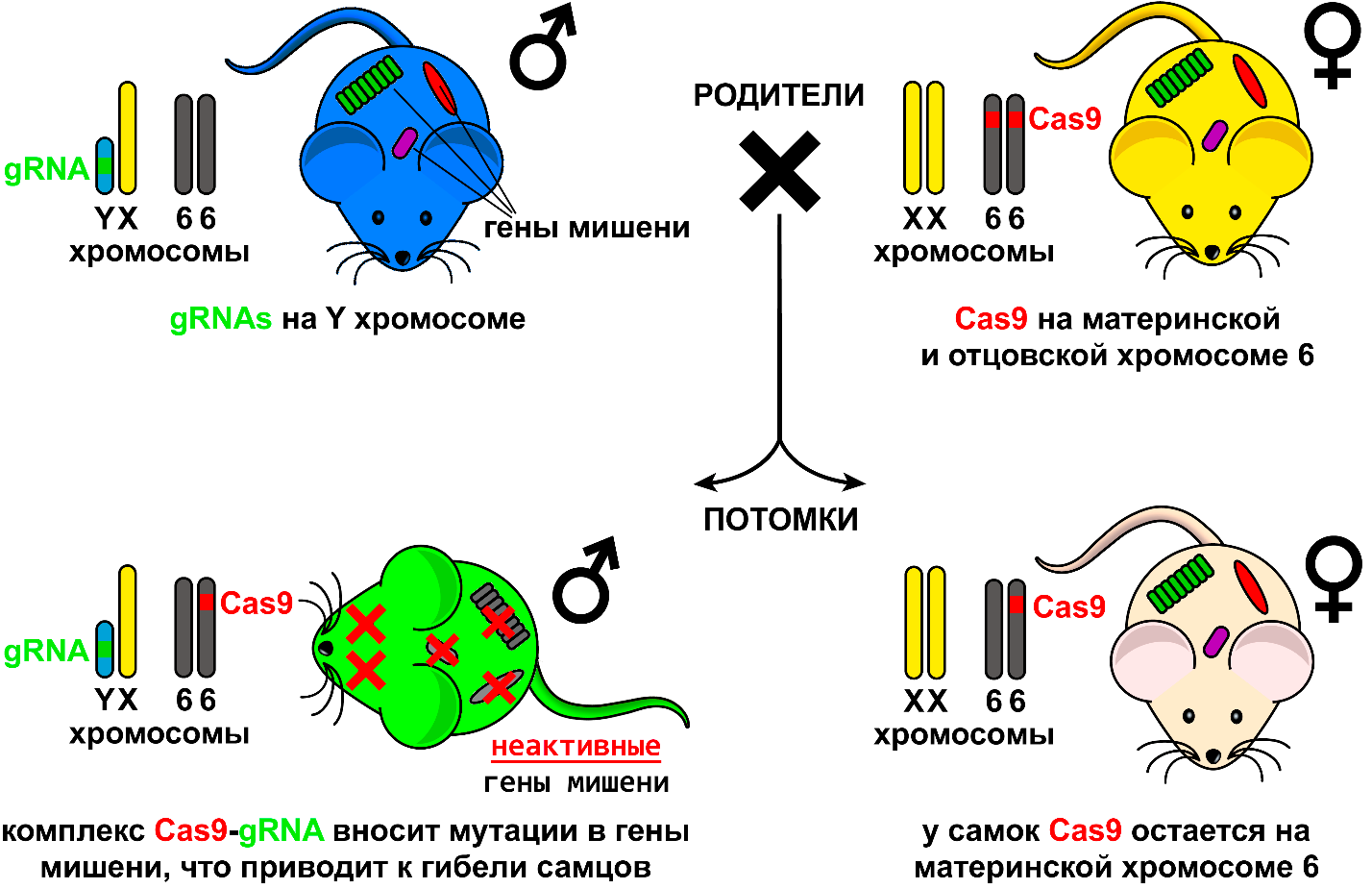
Статья (Yoself et al., 2019. https://doi.org/10.15252/embr.201948269) исследователей с кафедры клинической иммунологии медицинского факультета Тель-Авивского университета стала первой работой, где авторы попробовали создать технологию получения потомства из одних самок путем генетической селекции. Для этого они получили трансгенных самок, встроив им в отцовскую и материнскую хромосому 6 ген CRISPR-Cas9, выступающий в роли гена «самоубийства» (см. рис. 1). При этом конструкция вставки позволяла трансгену экспрессироваться в любом типе клеток. Ген CRISPR-Cas9 кодирует бактериальную нуклеазу белок Cas9, способный делать двуцепочечный разрез ДНК в области гена мишени, репарация такого разрыва генетическим аппаратом клетки приводит к мутации и выключению гена. Для того чтобы нуклеаза могла найти нужную область на ДНК, ей необходима т.н. направляющая РНК (gRNA – ген «триггер»), содержащая последовательность, комплементарную той области, в которой необходимо произвести разрез. Для достижения успеха авторы использовали три такие последовательности gRNA, нацеленные на три важных для развития зародыша гена. Все три последовательности были встроены в Y хромосому самца. Как видно, авторы поменяли ген «триггер» и ген «самоубийства» местами в своей модели относительно теоретической схемы, описанной выше, и, как станет видно ниже, это решение привело к рождению генетически модифицированных самок. Теоретически скрещивание трансгенных самцов и самок должно было приводить к гибели всех потомков только мужского пола на ранних сроках эмбрионального развития, так как только в этом случае клетки экспрессировали ген, кодирующий нуклеазу и направляющую РНК одновременно (см. рис. 1). Однако, на практике этот подход привел лишь к частичному успеху, и некоторые самцы все же выживали, хотя и несли сильные нарушения развития и после рождения довольно быстро погибали. Неполная элиминация мужских особей может объясняться неполной специфичностью используемых gRNA, а также вероятностным характером возникающих в генах мутаций. Так, авторы использовали только по одному варианту gRNA для каждого из трех генов мишеней и не тестировали эффективность различных последовательностей перед проведением основного эксперимента. Соотношение полов в помете у контрольных мышей (без трансгена), было статистически одинаковым: 58% самцов и 42% самок (всего 84 мышонка, в среднем 6.75 мышонка на помет), в опыте соотношение сильно смещалось в пользу самок: 8% самцов и 92% самок (всего 113 мышат, в среднем 3.75 мышонка на помет). Сразу бросается в глаза, что количество потомков на помет в опыте почти в два раза меньше, чем в контроле (55.8%), что обусловлено гибелью потомков мужского пола. Такая потеря в количестве потомков неизбежна при выбранном подходе и при его переносе на сельскохозяйственных животных снизит экономическую выгоду. Кроме этого, к недостаткам метода можно также отнести то, что получаемые самки были трансгенными, так как несли ген CRISPR-Cas9 в одной из своих хромосом (см. рис. 1). Сложности с использованием генетически модифицированных животных для производства пищевых продуктов также являются серьезным ограничением на пути внедрения этой технологии. Наконец необходимо отметить и этический аспект: рождение небольшого количества самцов с сильными аномалиями развития. В случае переноса технологии на сельскохозяйственных животных это может свисти на нет все преимущества от ее использования.
Рис. 1. Схема эксперимента по получению потомства из одних самок по данным работы (Yoself et al., 2019).
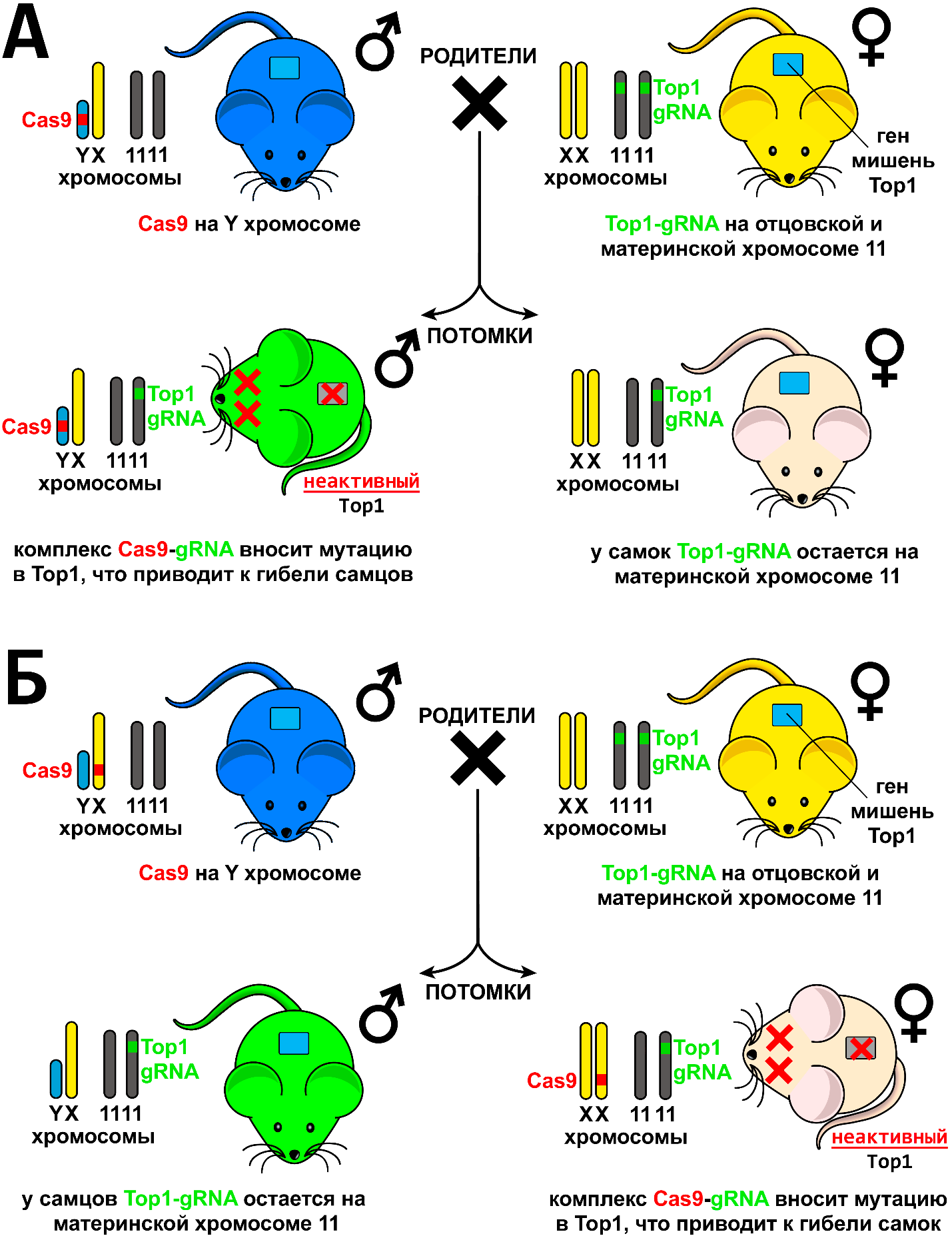
В следующей работе (Douglas et al., 2021. https://doi.org/10.1038/s41467-021-27227-2) ученые из института Фрэнсиса Крика в сотрудничестве с Кентским университетом использовали технологию редактирования генов для создания пометов мышей, состоящих только из самок и только из самцов, со 100% эффективностью. Авторы также использовали две линии трансгенных мышей, но в отличие от предыдущей работы перенесли ген Cas9 с аутосомы на половую хромосому, а gRNA, необходимую для нацеливания, наоборот с половой хромосомы на 11 хромосому. В результате этого изменения получаемые потомки, и самки, и самцы (см. схему на рис. 2А, Б), будут нести только gRNA в одной из своих хромосом, которая не кодирует трансгенных белков. Кроме этого, авторы изменили ген
Рис. 2. Схемы получения потомства только из самок (А) и только из самцов (Б) по данным статьи (Douglas et al., 2021).
мишень сосредоточившись на одном гене – Top1, кодирующем топоизомеразу 1, необходимую для процесса репликации ДНК и деления клеток. Мутации в этом гене приводят к гибели зародышей на очень ранней стадии развития, примерно 16-32 клетки. Наконец, были протестированы несколько последовательностей gRNA и выбрана наиболее эффективная из них. Для получения пометов только из одних самок ген Cas9 встраивали в Y хромосому самца (см. рис. 2А), а пометов только из самцов – в X хромосому (см. рис. 2Б). В обоих экспериментах были получены пометы, состоящие на 100% только из самок или самцов, тогда как в контроле соотношение между полами было примерно одинаковым. В этой работе среднее число мышат в помете в экспериментах с получением как самок, так и самцов по сравнению с контролем составило 61%, что немного выше, чем в предыдущей работе. Это, вероятно, связано с гибелью зародышей на более ранней стадии до имплантации в матку. В этом случае компенсация происходит за счет того, что количество оплодотворенных яйцеклеток у мышей, как правило, чуть больше, чем количество имплантировавшихся в матку зародышей и количество мышат в помете. Этот сдвиг в 16% по сравнению с 50%-ным теоретическим показателем даст преимущество этой технологии по сравнению с предыдущей только в случае ее реализации, например, на свиньях, у которых пометы также большие. В случае же реализации технологии на коровах, у которых рождается только один теленок, использование технологии генетической манипуляции полом потомства в этом виде может привести к отсутствию потомства вообще, если зародыш был мужского пола. Учитывая сложности с получением трансгенных линий, использование такого подхода будет экономически невыгодно, хотя авторы технически значительно продвинулись по сравнению с первой работой.
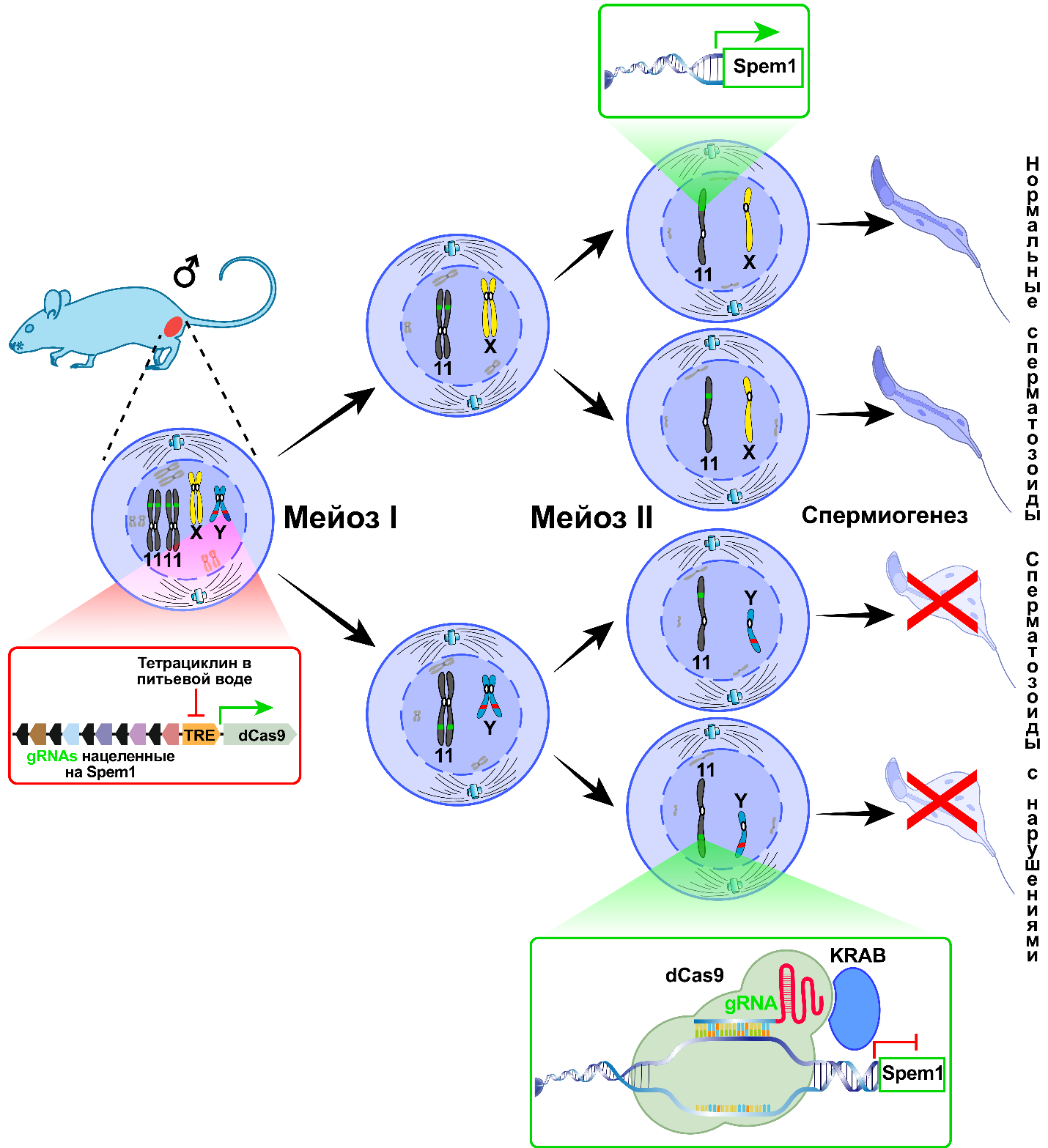
Наконец, в последнем, еще не опубликованном исследовании, пока выложенном в виде препринта на сайте https://www.biorxiv.org/ (Yoself et al., 2023. https://doi.org/10.1101/2023.11.21.568055) предложен наиболее оптимальный вариант метода селекции по половому признаку. Работа выполнена под руководством Уди Кимрона (Udi Qimron) из Тель-Авивского университета и по сути является переосмыслением первоначального подхода, представленного в исследовании 2019 г. В этой статье авторы также сосредоточились на получении пометов только из одних самок, но решили, что оптимальнее будет проводить селекцию сразу сперматозоидов, так чтобы у самцов на выходе получались только гаметы с половой хромосомой X (см. рис. 3). В результате оплодотворения такими сперматозоидами яйцеклеток обычных не трансгенных самок в помете будут только самки, причем теоретически размер помета не должен отличаться от контроля. Еще одним преимуществом такого подхода является получение только одной трансгенной линии – самцов, что экономичнее, чем при других подходах. В этот раз авторы встроили единую генетическую конструкцию с направляющими РНК и нуклеазой в хромосому Y самца. При этом были сделаны следующие улучшения: во-первых, количество gRNA, учитывая прошлый неудачный опыт, было увеличено с 1 на ген до 5. Каждая из gRNA кодировала последовательность, комплементарную различным участкам одного гена мишени – Spem1, расположенного на 11 хромосоме. Во-вторых, авторы вместо гена Cas9 взяли его модифицированную форму (dCas9), не обладающую нуклеазной активностью, и соединили этот белок с белком KRAB. Именно KRAB будет блокировать экспрессию гена мишени без внесения изменений в последовательность гена на эпигенетическом уровне (детали этого подхода можно прочитать в другой новостной статье на сайте института: http://idbras.ru/DevBiolNews/list.htm). Здесь необходимо пояснить чем продиктована необходимость использования dCas9. Дело в том, что авторы встроили 5 gRNA, dCas9 и KRAB в определенный локус на Y хромосоме – Uty, позволяющий активную экспрессию встроенной конструкции в любом типе клеток. В результате, если бы был использован обычный Cas9 ген, то его нуклеазная активность привела бы к возникновению мутаций в Spem1 во всех клетках организма и его выключению. Ген Spem1 кодирует белок – Spermatid maturation 1, необходимый для развития мужских гамет на самой последней стадии их созревания – спермиогенезе. Мутации в этом гене у мышей приводят к мужскому бесплодию и образованию аномальных, неспособных к оплодотворению яйцеклетки гамет (Zheng et al., 2007. https://doi.org/10.1073/pnas.0701669104). Чтобы этого избежать, был использован подход с блокированием экспрессии Spem1. Этот ген активен только в гаплоидных мужских половых клетках, которые несут только один набор хромосом, в том числе и половых. В результате блокирование экспрессии Spem1 происходит только в клетках с Y хромосомой, они не могут закончить свое развитие, погибают или приобретают серьезные аномалии. Авторы также предусмотрели возможность размножения полученных ими трансгенных самцов, встроив под промотор dCas9 тетрациклин-зависимый транс-активатор. В результате добавление тетрациклина в питьевую воду самцам блокировало экспрессию dCas9 и образовывались как “X”, так “Y” содержащие гаметы. Согласно полученным результатам, 100%-ной селекции не получилось: при естественном оплодотворении было получено 83% самок, а в случае искусственного оплодотворения с последующим переносом эмбрионов в матку этот показатель достигал 91%. Однако, согласно данным литературы (Zheng et al., 2007), мутантные по Spem1 самцы полностью стерильны. В случае же блокирования экспрессии этого гена только в Y-содержащих гаметах часть из них может нормально развиться, вероятно, за счёт наличия цитоплазматических мостиков между развивающимися мужскими половыми клетками. Эти мостики разрушаются только после завершения развития гамет. Вероятно, что часть SPEM1, синтезированного в X-клетках, попала в Y-клетки по этим мостикам и позволила
Рис. 3. Схема селекции спермы по половому признаку для получения пометов мышей, состоящих только из одних самок по (Yoself et al., 2023). Мейоз – особый тип деления, характерный только для развивающихся мужских и женских половых клеток, приводящий к редукции числа хромосом вдвое и образованию гаплоидных гамет. В красном прямоугольнике представлена структура генетической конструкции, вставленной в Y хромосому. В зеленых прямоугольниках изображен ген Spem1, активный в гаплоидных клетках, содержащих X хромосому (сверху), и заблокированный в Y содержащих клетках (снизу).
им нормально развиться. В конце хотелось бы отметить, что при таком подходе количество мышат в получаемых пометах не отличалось от контроля и полученные самки не несли в своем геноме каких либо трансгенных генетических конструкций.
Таким образом на сегодняшний день все подходы к генетической селекции пола у млекопитающих, пока разработанные только на мышах, не являются совершенными. Для возможного переноса технологии на сельскохозяйственных животных имеет смысл рассматривать только два последних варианта. В первом случае авторы получили пометы только из самок и только из самцов со 100%-ным выходом, но их технология требует вносить генетические модификации как в самцов, так и в самок и приводит к снижению числа потомков в помете по сравнению с генетически не модифицированными мышами той же линии. Кроме этого получаемые потомки содержат в своем геноме гены, кодирующие gRNA. Вторая технология лишена всех недостатков первой, но не дает 100%-ного выхода и была реализована только для получения пометов исключительно из самок. Второй подход все же выглядит более перспективным, но с его реализацией на других видах животных могут возникнуть сложности. Динамика экспрессии и функция гена Spem1 изучены только на мышах, поэтому неизвестно, приведет ли его инактивация у других животных к тому же эффекту, что и у мышей. Вполне возможно, что у других видов млекопитающих Spem1 начинает экпрессироваться еще на стадии мейоза, тогда его экспрессия будет заблокирована как в Y, так и в Х содержащих гаметах. Также есть вероятность, что у других животных функция Spem1 не настолько важна для формирования сперматозоидов или продублирована функциями других генов. То есть потребуется поиск другого гена-мишени.
Новость подготовил © 02.10.2024 Кулибин А.Ю.