CRISPR-Cas
Небезизвестная система адаптивного иммунитета бактерий и архей CRISPR-Cas, повсеместно использующаяся для манипуляций над генами, давно завоевала свое почетное место среди самых важных открытий XXI века [Makarova и др., 2011]. Для решения биоинженерных задач чаще всего используется система CRISPR-Cas, эффекторный белок которой называется Cas9 [Jiang, Doudna, 2017]. Она самая “простая”: находит нужный участок ДНК, разрезает его, — и готово, ген “выключен”. Но, конечно, это не всегда протекает так гладко. Часто бывает очень сложно избежать нецелевой (off-target) активности Cas9, это важно настолько, насколько важно не выключить что-то нужное по пути, ведь это может привести к неожиданным последствиям. Это одна из главных проблем системы CRISPR-Cas, особенно в терапевтической практике.
На решение этой проблемы было потрачено немало усилий и были опробованы самые разнообразные подходы. Один из наиболее эффективных способов снизить off-target активность — это тщательная оптимизация последовательностей направляющих, гидовых РНК (gRNA) [Manghwar и др., 2020]. Исследователи выбирают gRNA с высокой специфичностью к целевым участкам ДНК и минимальным уровнем совпадений с другими последовательностями. Использование программных инструментов для предсказания возможных off-target эффектов позволяет исследователям заранее выявить и избежать потенциальных проблемных областей генома, минимизируя нежелательные эффекты.
Использование двух gRNA, направляющих Cas9 к двум близко расположенным сайтам на ДНК, тоже может значительно повысить точность вносимого разреза. Этот метод известен как «двойная направляющая», и он уменьшает вероятность off-target активности, так как только в случае одновременного связывания двух gRNA происходит активация Cas9.
Кроме того, различные варианты Cas сами по себе имеют разную off-target активность. Вообще таких белков известно немало. Так системы CRISPR-Cas делятся на два класса (классы 1 и 2) и шесть типов (типы I–VI). Самый широко использующийся класс 2 включает типы II, V и VI и охватывает одиночные мультидоменные эффекторные белки Cas, такие как Cas9 (тип II) и Cas12 (тип V) [Makarova и др., 2011].
Однако, одним из самых интересных решений для молекулярно-генетических исследований для многих представляется уход от разрезания ДНК вообще и попытка лишь регулировать экспрессию генов, повышая или снижая её [Bendixen, Jensen, Bak, 2023].
Система CRISPR-Cas9 была адаптирована и превращена в технологию генной модуляции, известную как модулирующая CRISPR (CRISPRmod), которая включает в себя технологии интерференции (CRISPRi) или активации (CRISPRa) генов. Эти методы используют деактивированную нуклеазу Cas9 (dCas9), которая связывается с целевой геномной областью с той же эффективностью, что и обычная Cas9, но не может генерировать двухцепочечный разрыв ДНК (DSB) и вместо этого приводит к РНК-направленному транскрипционному контролю целевой области. CRISPRi использует dCas9 вместе со слитыми репрессорными доменами и со стандартной гидовой РНК для нацеливания на промоторные области для транскрипционной репрессии или нокдауна гена. Напротив, CRISPRa использует dCas9, слитый с доменами активации транскрипции, которые могут быть направлены в промоторные области либо с помощью стандартной гидовой РНК, либо с помощью специальных направляющих РНК, которые привлекают дополнительные эффекторы для активации транскрипции и повышения экспрессии целевого гена.
Эти CRISPRa системы позволяют регулировать экспрессию генов без серьезных и необратимых изменений в геноме. Это особенно важно в контексте лечения заболеваний, где временная активация или подавление генов может быть более безопасной альтернативой по сравнению с постоянными изменениями.
Кроме того, они позволяют подстраивать уровень экспрессии гена. Это полезно для исследований, где важно наблюдать за эффектом увеличения экспрессии гена, а не за полным его отключением. Такая точность обеспечивает более глубокое понимание функций генов и их роли в различных биологических процессах.
CRISPRa также можно использовать для одновременной активации нескольких генов. Это особенно полезно в исследованиях, связанных с регуляторными сетями, где взаимодействие между различными генами определяет клеточное поведение.
Такие молекулярные регуляторы также широко применяются к различным ортогональным системам из семейства Cas12. Однако традиционные эффекторные системы CRISPR-Cas имеют ограничения в регуляции экспрессии генов, включая низкую активность или неподходящий размер для упаковки в аденоассоциированные вирусы (AAV).
Новинка из Южной Кореи
Исследования, проведенные учеными из ряда ведущих институтов Южной Кореи, представили усовершенствованную систему CRISPR-Cas12f для точной и эффективной регуляции экспрессии генов [Oh и др., 2024]. В основе новой системы лежит небольшой и высокоэффективный фермент CRISPR-Cas12f выделенный из архейного организма Candidatus Woesearchaeota, который был модифицирован так, чтобы он мог работать в клетках млекопитающих. Ученые разработали оптимизированную версию системы, названную eCWCas12f-VPR, которая демонстрирует значительно более высокую эффективность по сравнению с существующими системами CRISPRa на базе Cas9 и Cas12a.
Ключевым достижением южнокорейских коллег является способность eCWCas12f-VPR специфически активировать экспрессию целевых генов, избегая повреждения ДНК, что делает ее перспективной для применения в генотерапии и других биологических исследованиях. Система также демонстрирует высокую точность при работе с различными генами, что значительно снижает риск активации нежелательных участков генома.
Эти результаты открывают новые горизонты в области регуляции генной экспрессии и подчеркивают потенциал использования eCWCas12f-VPR в разработке методов лечения генетических заболеваний и других биомедицинских приложениях.
Рассмотрим подробно этапы их работы и методы проверки новой технологии. Что же они сделали?
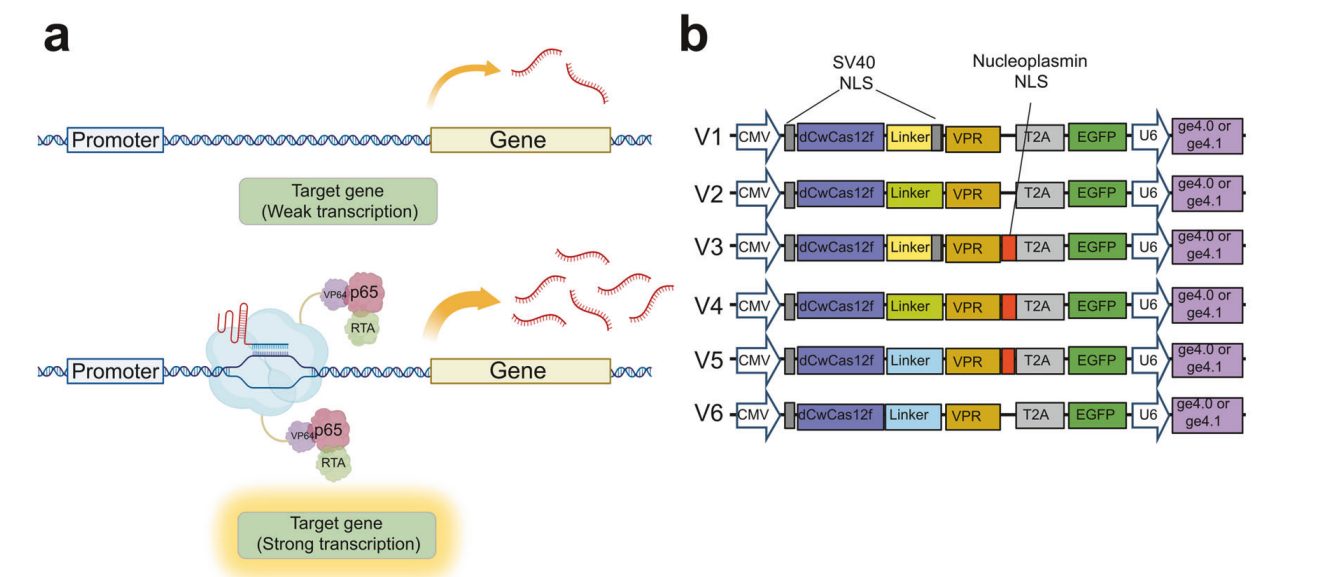
Для создания эффективной CRISPRa, способной индуцировать экспрессию целевых генов внутри клеток, к С-концу dCRISPR-Cas12f были добавлены факторы транскрипции VP64, p65 и Rta (все вместе они называются VPR). Таким образом, все три фактора транскрипции нацелены на один и тот же ген, а это приводит к повышенной экспрессии генов-мишеней (рисунок 1а). Система CRISPR-Cas12f, в отличие от ранее описанного эффектора Cas12, имеет относительно небольшой размер, что важно для основной функции связывания и расщепления целевой ДНК в рамках одной системы, без необходимости собирать сложный комплекс из нескольких белков. В идеале она распознает целевую ДНК в гомодимерной форме, что позволяет привлечь две копии модуля VPR к участку перед целевым геном на каждую молекулу Cas12f. Кроме того, область протоспейсера очень чувствительна к несоответствиям между гидовой РНК и ДНК-мишенью, что приводит к исключительной специфичности к мишени. Для оптимизации работы системы dCWCas12f-VPR в пределах последовательностей целевой ДНК использовались различные конфигурации линкеров и последовательностей сигналов ядерной локализации (NLS) для соединения dCWCas12f и VPR (рисунок 1б).
Рис. 1. Оптимизация CRISPR-активатора на основе dCWCas12f для направленной транскрипционной активации.
а. Схематическое изображение системы транскрипционной активации с использованием модуля dCWCas12f-VPR.
б. Различные версии транскрипционного активатора на основе dCWCas12f с разной длиной линкеров (16, 32 и 33 аминокислоты) и последовательностями сигнала ядерной локализации (NLS), а также с использованием двух различных структур направляющей РНК (ge4.0 и ge4.1).
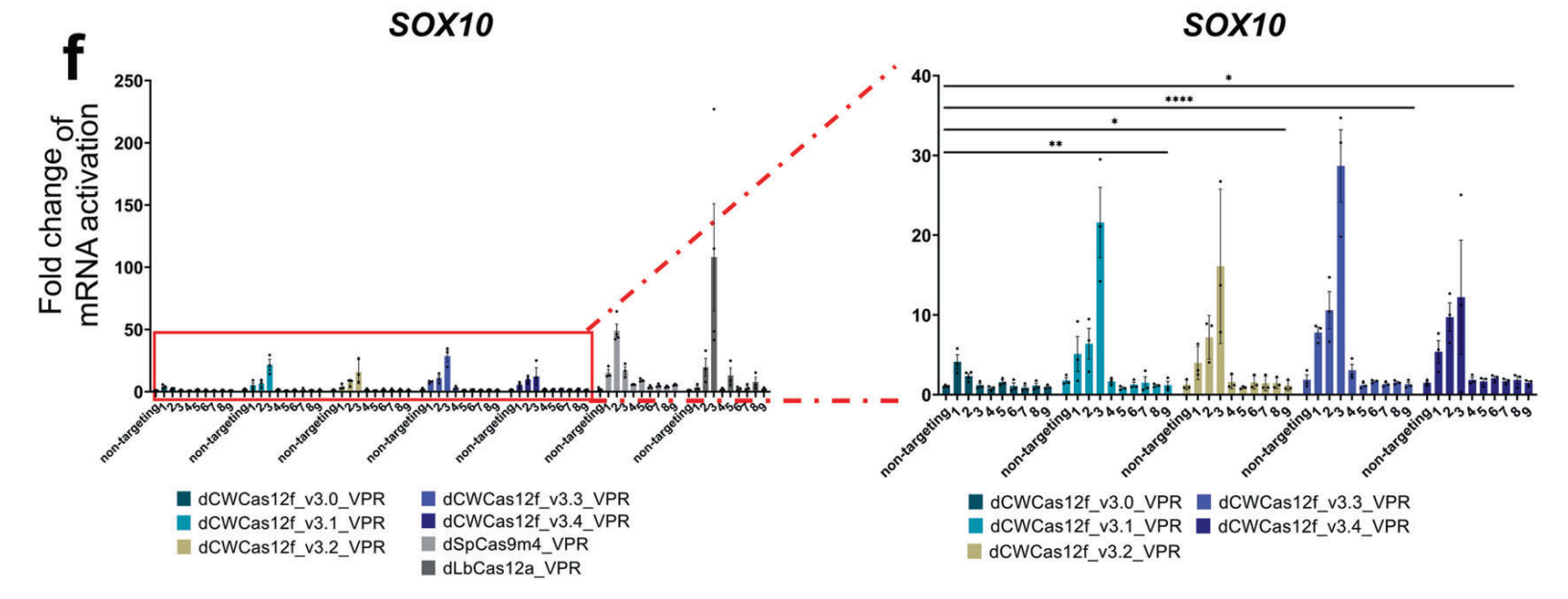
Сравнение различных версий dCas12f-VPR показало, что eCWCas12f-VPR обладает высокой эффективностью активации по сравнению с другими системами.
Далее ученые исследовали, может ли система eCWCas12f-VPR универсально индуцировать экспрессию генов в различных геномных локусах (CD2, CXCR4, HBB, IL1RN, ASCL1 и HBG) в клетках человеческого происхождения. Чтобы напрямую сравнить регуляторные эффекты модуля CRISPR-Cas на экспрессию генов с существующими CRISPR-активаторами, сопоставили его с хорошо охарактеризованной системой Cas12a. Во всех протестированных генных локусах система eCWCas12f-VPR продемонстрировала в целом более высокую эффективность усиления экспрессии генов по сравнению с такой системой, как LbCas12a-VPR. Применение систем LbCas12a-VPR и eCWCas12f-VPR приводило в среднем к 29,72-кратной и 965,46-кратной индукции экспрессии генов соответственно (рисунок 2). Примечательно, что для некоторых генов-мишеней, для которых существующая система LbCas12a-VPR была не способна индуцировать значительную амплификацию гена, система eCWCas12f-VPR была эффективна в индуцировании экспрессии гена.
Также результаты показали, что активация экспрессии генов с помощью eCWCas12f-VPR была более эффективной (в среднем в 478,37 раз), чем с помощью хорошо зарекомендовавшей себя системы dSpCas9m4-VPR. Для локуса PAM, богатого тимином (TTTV), eCWCas12f-VPR продемонстрировала более высокую или равную эффективность индукции экспрессии гена по сравнению с dSpCas9m4-VPR, что подчеркивает его потенциал как инструмента для активации гена-мишени, богатого тимином.
Рис. 2. Сравнительный анализ активации эндогенной экспрессии генов в клетках HEK293FT с использованием различных версий CRISPR-активатора: dCWCas12f-VPR (v3.0, v3.1, v3.2, v3.3, v3.4), dSpCas9m4-VPR и dLbCas12a-VPR.
Использование Cas-OFFinder и последующая проверка с помощью qPCR и RNA-seq показали, что eCWCas12f-VPR обладает высокой специфичностью, минимизируя активацию ненужных генов. RNA-seq анализ подтвердил, что глобальные изменения в экспрессии генов минимальны, что свидетельствует о низкой off-target активности.
Кроме того, была продемонстрирована успешная доставка системы eCWCas12f-VPR с помощью AAV векторов, что показывает её потенциал для применения в качестве клинических исследованиях. Чтобы исследовать активацию экспрессии генов, специфичную для мишени, с использованием системы eCWCas12f-VPR, загруженной в рекомбинантные векторы аденоассоциированного вируса серотипа 2 (rAAV2), была разработана система доставки на основе двух rAAV2: один для eCWCas12f-VPR, а другой для экспрессии соответствующей sgRNA. Каждый rAAV2 был сконструирован так, чтобы экспрессировать eCWCas12f-VPR под контролем малого промотора CMVd1 и sgRNA под контролем промотора U6, соответственно. В результате одновременной трансдукции в клетки HEK293FT система eCWCas12f-VPR увеличила экспрессию гена HBG в 6,55 раза, что демонстрирует эффективность этой системы в активации эндогенных генов при доставке через AAV-векторы.
Что дальше
Работа южнокорейских ученых демонстрирует успешную разработку и оптимизацию усовершенствованной системы CRISPRa на базе Cas12f (eCWCas12f-VPR), которая сочетает в себе высокую эффективность и специфичность в регуляции экспрессии генов. Подтверждение низкой off-target активности и успешная доставка с помощью AAV векторов делают эту систему перспективным инструментом для применения в генотерапии и биомедицинских исследованиях. Данная разработка расширяет возможности существующих CRISPR-технологий, предлагая более безопасные и точные методы манипулирования генной экспрессией.
В этом исследовании домен VPR использовался как транc-активатор, соединённый с системой CRISPR-Cas12f для индукции специфической экспрессии генов. Однако существуют и другие. Например, такой домен, как KRAB, наоборот, способен эффективно и специфично подавлять экспрессию генов [Jiao, Zhou, Sun, 2025].
Система eCWCas12f-VPR, использованная в этом исследовании, обладает высокой компактностью, что позволяет внедрять ее в эффективные системы доставки, включая AAV-векторы. Это потенциально обеспечивает высокоэффективный контроль экспрессии генов благодаря результативной доставке в биологические системы.
Способность системы eCWCas12f-VPR значительно усиливать экспрессию целевых генов при доставке через AAV подчёркивает её потенциал для будущего лечения наследственных заболеваний человека. Это особенно важно для заболеваний, при которых экспрессия генов нарушена без изменения их кодирующих последовательностей. Например, при ICF-синдроме, вызванном дефицитом DNMT3B, наблюдается глобальное нарушение метилирования и выключение множества генов [Gao и др., 2022]. При β-талассемии мутации в промоторе HBB снижают транскрипцию, хотя сам ген остается интактным [Testa, Leone, Cappellini, 2024]. А при синдроме Кабуки или синдроме Рубинштейна–Тайби дефекты ремоделирования хроматина приводят к нарушению экспрессии целых каскадов генов [Adam, Hudgins, 2005; Hennekam, 2006]. Кроме того, такой подход может быть полезен при заболеваниях, связанных с нарушениями импринтинга, как при синдроме Прадера-Вилли, Ангельмана, Беквита-Видеманна, а также некоторых видах рака, пузырном заносе и синдроме Рассела-Сильвера [Eggermann и др., 2023]. Применение компактной системы eCWCas12f-VPR в подобных случаях может открыть новые подходы к терапии, позволяя избирательно «включать» или «выключать» экспрессию ключевых генов и восстанавливать нормальное функционирование клеток.
Разработанная в этом исследовании система eCas12f-VPR создаёт основу для будущих приложений в различных биомедицинских областях, включая молекулярный скрининг, идентификацию функций генов, моделирование заболеваний. Более того, эта технология таргетного и специфического контроля экспрессии генов, вероятно, станет фундаментом для разработки генотерапий, применимых к человеку.
Список литературы:
1. Adam M. P., Hudgins L. Kabuki syndrome: a review // Clin Genet. 2005. Т. 67. № 3. С. 209–219.
2. Bendixen L., Jensen T. I., Bak R. O. CRISPR-Cas-mediated transcriptional modulation: The therapeutic promises of CRISPRa and CRISPRi // Mol Ther. 2023. Т. 31. № 7. С. 1920–1937.
3. Eggermann T. и др. Imprinting disorders // Nat Rev Dis Primers. 2023. Т. 9. № 1. С. 33.
4. Gao L. и др. Structure of DNMT3B homo-oligomer reveals vulnerability to impairment by ICF mutations // Nat Commun. 2022. Т. 13. № 1. С. 4249.
5. Hennekam R. C. M. Rubinstein–Taybi syndrome // Eur J Hum Genet. 2006. Т. 14. № 9. С. 981–985.
6. Jiang F., Doudna J. A. CRISPR-Cas9 Structures and Mechanisms // Annu Rev Biophys. 2017. Т. 46. С. 505–529.
7. Jiao L., Zhou Q., Sun D. CRISPR-Based Regulation for High-Throughput Screening // ACS Synth. Biol. 2025. Т. 14. № 6. С. 1890–1904.
8. Makarova K. S. и др. Evolution and classification of the CRISPR-Cas systems // Nat Rev Microbiol. 2011. Т. 9. № 6. С. 467–477.
9. Manghwar H. и др. CRISPR/Cas Systems in Genome Editing: Methodologies and Tools for sgRNA Design, Off‐Target Evaluation, and Strategies to Mitigate Off‐Target Effects // Adv Sci (Weinh). 2020. Т. 7. № 6. С. 1902312.
10. Oh Y. и др. Highly efficient and specific regulation of gene expression using enhanced CRISPR-Cas12f system // Gene Ther. 2024. Т. 31. № 7–8. С. 358–365.
11. Testa U., Leone G., Cappellini M. D. Therapeutic Gene Editing for Hemoglobinopathies // Mediterr J Hematol Infect Dis. 2024. Т. 16. № 1. С. e2024068.
Новость подготовил
Артур Ли
30.09.2025