Комментарий к статье Gordana Vunjak-Novakovic, Kacey Ronaldson-Bouchard, and Milica Radisic Organs-on-a-chip models for biological research J.Cell . 2021 Sep 2;184(18):4597-4611.
DOI: 10.1016/j.cell.2021.08.005
 © Буторина Нина Николаевна, старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, к.б.н.
© Буторина Нина Николаевна, старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, к.б.н.
Область научных интересов - мезенхимные стромальные клетки, гемопоэтические стволовые клетки, их роль в роцессах регенерации, экспансия и культивирование на биоматериалах, дифференцировка в различные типы клеток.
В основу тканевой инженерии, сформировавшейся как особое направление исследований в конце 1980-х годов, было положено применение принципов и методов биоинженерии. В конце 1990-х годов лаборатория Шулера представила научному сообществу идею ‘‘human-body-on-a-chip’, или ‘человеческого тела на чипе’. Это послужило фундаментом для создания новой биоинженерной конструкции ‘Органы на чипе’ (Organs-on-a-chip, OOC). В отличие от органоидов, которые формируются спонтанно и повторяют развитие, ‘органы на чипе’ спроектированы для отображения некоторых специфических функций целых органов. Немаловажную роль в продвижении и воплощении этой научной идеи сыграло быстрое развитие области микрофлюидики в сочетании с изобретением мягкой литографии и возможностью создания прототипов устройств с использованием полидиметилсилоксана (PDMS), мягкого материала на основе силикона. Термин OOC предполагает, что мини-органы выращиваются на чипе, но цель так и не была достигнута, а созданные системы содержат небольшие тканевые конструкции, предназначенные для воспроизведения только одного или нескольких специфических функциональных свойств целого органа, таких как барьерная функция кожи, сосудистая сеть легких, сократимость мышц или метаболизм печени. Простота этих моделей является основным преимуществом, поскольку она позволяет напрямую оценивать влияние генетических факторов и факторов окружающей среды на функции клеток и тканей. Подходы тканевой инженерии, применяемые в ООС, такие как культура клеток на каркасах, физические сигналы (гидродинамические, механические, электрические), микропроизводство межклеточных пространств и каналов обеспечивают оптимальную скоординированность структуры тканей и фенотипа при изучении функций на уровне органов, несмотря на то, что зачастую включают только несколько типов клеток из состава нативного органа (Рис.1). Такие исследования могут помочь продвинуться в понимании эпигенетической регуляции заболеваний.
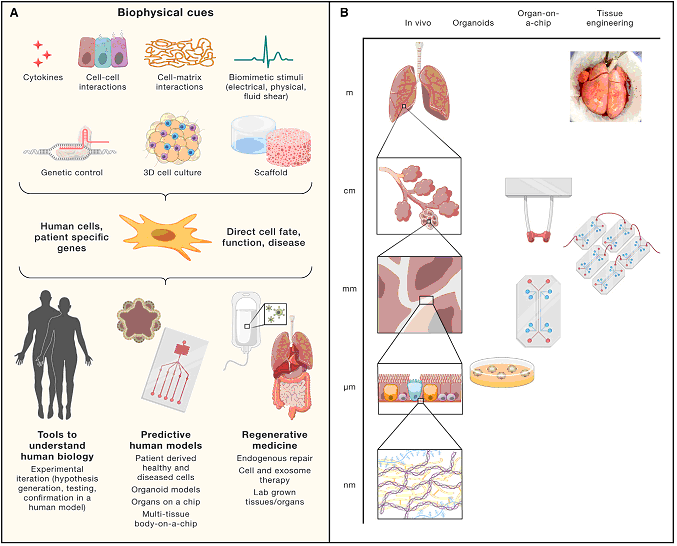
(A) OOC основаны на использовании клеток, биоматериалов и систем культивирования (биореакторов) для создания специфической среды интересующей ткани или органа.
(B) Структуры, изготовленные из живых клеток, в устройствах OOC имеют размер от микрометров до миллиметров, в то время как регенеративная инженерия воссоздает структуры от миллиметров до сантиметров.
Большинству клеток требуется каркас, который разработан таким образом, чтобы имитировать состав, структуру и биомеханику нативного тканевого матрикса. Его роль является лишь временной, и он должен разлагаться со скоростью, позволяющей осаждать и реконструировать новый экстрацеллюлярный матрикс. Интенсивные исследования привели к эволюции используемых для каркаса материалов (таких как нейлон, полиэфиры) в материалы, которые разлагаются с заданной скоростью и обладают биологически активными свойствами. Наиболее востребованными являются децеллюляризованные ткани, включая минерализованный костный матрикс в качестве каркаса для костной ткани или фибрин для формирования мышц. Новый класс адаптивно-чувствительных биоматериалов позволит перейти от заданных свойств каркасов к каркасам, которые могут изменяться в ответ на сигналы клеток и окружающей среды для обеспечения функционального восстановления сложных тканевых структур.
Для того, чтобы клетки образовали функциональные тканевые единицы, необходимы определенные условия и продолжительность культивирования. Разрабатываются всё новые подходы, основанные на имитации естественной среды обитания органов, включая использование потока среды для имитации перфузии крови и электрических и механических стимулов для ускорения созревания мышц, нервных тканей или костей. Системы культивирования (биореакторы) предназначены для контроля условий окружающей среды; обмена кислородом, питательными веществами и метаболитами; и обеспечения молекулярных и физических регуляторных факторов. Требования к конструкции и эксплуатации биореактора для ООС могут отличаться от требований к созданию крупных трансплантатов для регенеративной медицины. Небольшие размеры тканей в ООС позволяют контролировать сигналы микроокружения на коротких диффузионных расстояниях, поддерживая жизнеспособность и функции тканей. Динамические механические напряжения могут регулироваться в такой конструкции за счет специфического для органа давления, механического напряжения и пульсирующего кровотока, наряду с обеспечением пространственно-временной регуляции биохимических сигналов и градиентов концентрации. При необходимости, можно создать специфическую патологическую среду, если цель состоит в том, чтобы создать модель травмы или заболевания для оценки терапевтических методов.
Предпосылкой для создания устройств ООС с одним органом послужила концепция соответствия «функция-форма», т.е. создание структуры клеточной матрицы, имитирующей структуру в нативном органе, приведет клетки к принятию соответствующей функции. (Рис.2). Основываясь на функции, которую клетки в ООС должны моделировать, различные системы OOC можно в широком смысле классифицировать как устройства с барьерной функцией и устройства с паренхиматозной функцией.
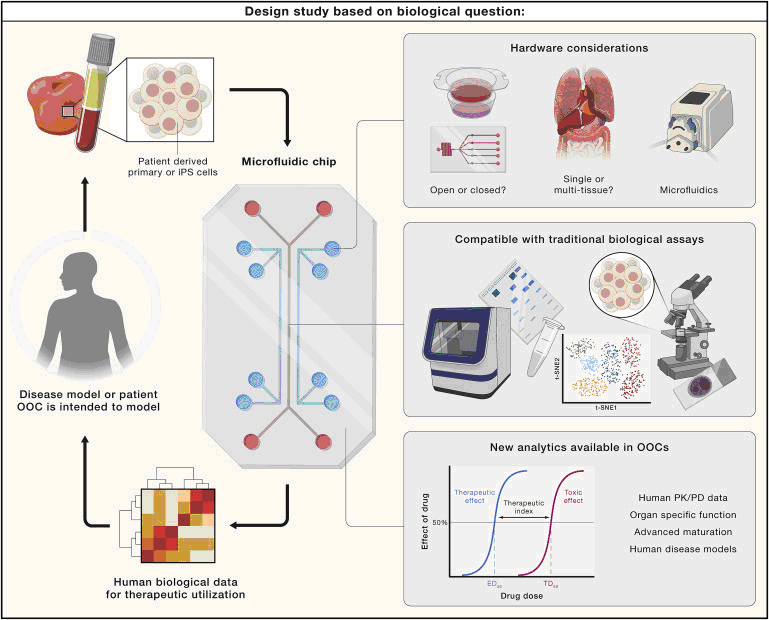
С технической точки зрения такие конструкции подразделяют на закрытые устройства с герметичными каналами и потоком, приводимым в действие насосом, и открытые устройства, которые заполняются потоком, приводимым в действие силой тяжести, или используются качающиеся платформы. Каждая конструкция имеет свои преимущества и недостатки. Поток, приводимый в действие насосом, легко регулируется, но работа закрытой системы, отбор проб жидкости и клеток более сложные, чем в открытых устройствах, позволяющих легко извлекать ткани и материалы. Первой была разработана барьерная функция с использованием метода OOC в устройстве легких на чипе, так как они могут воспроизводить различные эпителиальные барьеры. Соответствие условий при создании архитектурно сложной формы было достигнуто с помощью методов 3D-печати, микрофлюидики и стереолитографической печати с использованием фотополимеризующихся гидрогелей и пищевых красителей в качестве фотопоглощающих веществ. Возможность воссоздания паренхиматозной функции ткани нашло отражение в разработке экспериментальных систем, типа "нерв на чипе", модели сердечной мышцы, скелетных мышц и нервно-мышечного узла (NMJ) на чипе, печени на чипе, лимфатического узла на чипе, человеческого глаза на чипе, конструкции АнгиоЧип. Применение различных электрических сигналов, как в случае модели сердечной мышцы, скелетных мышц позволяет очертить целый ряд электрофизиологических реакций; включение разного рода химических агентов в модели печени на чипе выявляет особенности метаболической функции, определяет степень токсичности лекарств, конструкция АнгиоЧипа отделяет спроектированную сосудистую сеть и паренхиматозную ткань, обеспечивая возможность ремоделирования при сохранении просветов открытых сосудов, позволяет учитывать наличие нанопор и микроотверстий в стенках сосудов.
Экспериментальный подход с использованием генетически определенных клеток, специфичных для доноров открывает целый ряд возможностей для индивидуальных исследований и анализа влияния генетических и экологических факторов. OOC были неоценимы для исследований ОРВИ- SARS-CoV-2 и других вирусных инфекций, связанных с дисфункцией органов. ООС позволяют отделить влияние инфекции SARS-CoV-2 на основные функциональные типы клеток в органе от косвенного воздействия воспалительных цитокинов.
Мультиорганные модели ООС созданы для изучения системного развития и функционирования множества связанных тканей, прогрессирования заболеваний и возможности создания условий для терапевтического скрининга. В таких системах одноорганные модели могут быть соединены жидкостным способом через рециркулирующую среду, которая обеспечивает связь посредством секретируемых факторов, внеклеточных везикул и циркулирующих клеток. Соединение нескольких тканей с помощью сосудистой перфузии оказывает влияние на каждую ткань, а также на всю многоорганную модель. (Рис. 3) В настоящее время разрабатываются системы, обеспечивающие тканеспецифичную нишу для каждого тканевого модуля, имитирующие системную сосудистую сеть и включающие маршрутизацию питательных сред и биосенсоров для онлайн-считывания. Были разработаны такие сложные мультиорганные ООС, как компоненты ниши костного мозга человека, женская репродуктивная система, физиомиметическая мультиорганная платформа, содержащая модули кишечника и печени для создания многоорганной модели язвенного колита у человека, считается, также, что возможно смоделировать обратную гормональную связь между печенью и поджелудочной железой. Эти достижения открывают перспективы для разделения поведения отдельных органов во время гомеостаза и выявления факторов, приводящих к метаболическим и гормональным заболеваниям
Мультиорганные платформы, включающие в себя человеческие ткани и биоинженерные инструменты предоставляют возможность для моделирования перехода от здорового состояния к больному. Включение микробиома пациента в мультиорганные модели позволяет прогнозировать, как пациент будет реагировать на лекарственную терапию. Кроме того, разработанные микрофлюидные модели позволяют изучать различные компоненты метастатического процесса, включая попадание раковых клеток в кровоток (интравазация), изменения, происходящие во время циркуляции, и инвазию раковых клеток в ткани-мишени (экстравазация).
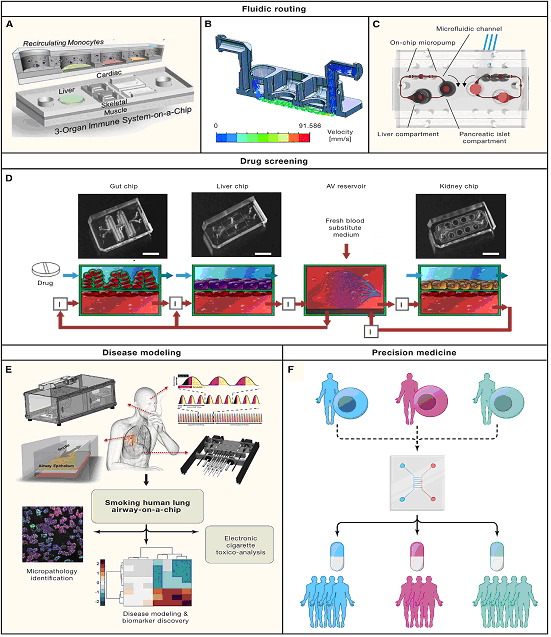
(А–С) OOCs могут быть соединены жидкостным способом через рециркулирующую среду;
(D–F) Устройства с несколькими ООС могут использоваться для скрининга лекарств (D), моделирования заболеваний (E) и подходов к точной медицине
Мульти-OOC - это способ оценки эффективности, иммуногенности и уровня фармакокинетики/фармакодинамики (PK/PD) в физиологически значимых для человека условиях до начала клинических испытаний, позволяющий уточнить клинические стратегии. Модели с несколькими органами обычно включают интересующий орган-мишень и органы, связанные с метаболизмом лекарств (т. е. печень и почки) и нецелевой токсичностью (т. е. печень, сердце) Изначально стимулом для разработки этих моделей ООС была необходимость определения токсичности лекарств для человека и оптимизации дозировки лекарств для быстрого определения терапевтических показателей для человека —концентраций лекарств. ООС точно описывают адсорбцию, распределение, метаболизм, выведение и токсичность лекарственного средства (ADMET). Мульти-ООС смогли точно смоделировать как целевые эффекты терапии рака, так и побочную токсичность препаратов для сердца и печени. Система была разработана таким образом, чтобы препарат сначала проходил через печеночный модуль, где он превращался в свою активную форму и впоследствии доставлялся в нижележащие тканевые модули через жидкостную рециркуляцию. При системных заболеваниях (раке, аутоиммунных заболеваниях, фиброзе, инфекции и воспалении) вариабельность проявления болезни у пациентов и результатов терапии затрудняет разработку успешных стратегий. Использование клеток, полученных от пациентов, в мульти-ООС позволит биологам помочь в понимании возникновения, прогрессирования и разработке методов лечения заболеваний на индивидуальной основе.
Очевидны актуальность и перспективы использования OOC, но для широкого применения этой системы необходимо решить ряд проблем. Создание новейших ООС и повышение их производительности требует массового производства стандартизированных, недорогих и настраиваемых устройств. ООС должны стать такими же доступными, как и планшеты для культивирования клеток. Первые шаги в этом направлении были сделаны, несколькими компаниями (Emulate, inSphero, Mimetas, Tissuse, Nortis и CN Bio), которые теперь предлагают OOC для культивирования одного или нескольких типов тканей. Ожидается, что биологические эксперименты послужат стимулом к разработке OOC, что повысит их производительность и потребует массового производства таких устройств.
Новость подготовила © Буторина Н.Н.
30.09.2021