Tsvetkov P, Coy S, Petrova B, et al (2022) Copper induces cell death by targeting lipoylated TCA cycle proteins. Science 375:1254–1261
Tsvetkov P, Detappe A, Cai K, et al (2019) Mitochondrial metabolism promotes adaptation to proteotoxic stress. Nat Chem Biol 15:681–689

© Карпова Ярослава Дмитриевна, научный сотрудник лаборатории биохимии процессов онтогенеза. Кандидат биологических наук. Область научных интересов: протеасомы в развитии иммунной системы и клеточной малигнизации.
Активные ионы меди являются необходимым структурным или каталитическим кофактором многих ферментов, участвуя в широком спектре клеточных процессов: дыхательной цепи, антиоксидантной защиты, биосинтезе и других. Однако в некоторых случаях избыток ионов меди может быть токсичным для клетки и организма. В отличие от ферроптозиса, программируемой клеточной смерти от избытков ионов железа, клеточная реакция и определенные молекулярные механизмы ответа на аккумуляцию ионов меди были до сих пор не описаны. Работа Цветкова и других проливает свет на данный вопрос, подробно описывая каскад происходящих процессов, приводящих к программируемой клеточной смерти, инициируемой избытком ионов меди, который был назван купроптозисом (cuproptosis).
В своей работе авторы использовали элескломол, или бис-(тиогидроазид) амид, для доставки меди в клетки. Изначально этот агент был разработан Synta Pharmaceuticals для использования в качестве химиотерапии из-за продемонстрированного токсичного воздействия на раковые клетки. Однако клинические испытания не завершились успехом. В настоящей работе было показано, что цитотоксичность элескломола является медь-опосредованной. Другие ионы металлов не оказывали влияния на выживаемость клеток при их воздействии в комбинации с элекскломолом. Было показано связывание элескломолом двухвалентных ионов Cu++ во внеклеточном пространстве и формирование мембранно-проникающего комплекса, который при попадании в митохондрии высвобождал уже восстановленный одновалентный ион Cu+ (1). Цветков и др. показали, что токсичное действие, вызывающее клеточную смерть, определяется активностью ионов меди, связано с уровнем ферродоксина 1 (ferrodoxin-1) и активностью дыхательной цепи в митохондриях. Интересно, что молекулярный механизм такой клеточной смерти оказался отличным от классического апоптоза, ферроптоза или некроптоза.
В своей прошлой работе авторы обнаружили, что нокаут всего одного гена, кодирующего ферродоксин 1, способен сделать клетки полностью толерантными к действию элескломола (2). В настоящей работе авторы использовали CRISPR/Cas9 скрининг (скрининг мутаций, полученных с помощью технологии генного редактирования CRISPR/Cas9) для идентификации других молекул-эффекторов исследуемого процесса. Для этого Cas9 экспрессирующие клетки были инфицированы вирусами, кодирующими коллекцию гидовых РНК (gRNAs) к 19,114 генам. Была подобрана такая концентрация вирусов, чтобы одна клетка получила одну gRNA. Таким образом, была получена смесь клеток, каждая из которых имела одну мутацию в одном гене. Далее клетки культивировали с двумя ионофорами меди: элескломолом и DDC, после чего выделили и секвенировали ДНК. Определение пропорции клеток, экспрессирующих различные gRNAs, выявило мутации каких генов помогают клеткам пережить избыток меди и успешно делиться, а каких усиливают токсичный эффект (Рис. 1). Данный скрининг выявил важность ферментов синтеза липоевой кислоты и белков-мишеней для пост-трансляционной модификации липоевой кислотой (липолирования): DLAT, PDHA1 и PDHB. Эти белки являются частью пируват дегидрогеназного комплекса PDH. Когда авторы использовали ингибиторы митохондриального переносчика пирувата, они обнаружили появление устойчивости к токсичному воздействию меди, что подтвердило важность PDH комплекса в обеспечении купроптозиса и его связь с FDX1, циклом Кребса, синтезом и активностью липоевой кислоты. Авторы показали, что медь напрямую связывается с липолированными белками цикла Кребса, что приводит к их агрегации, дезактивации, протетоксичному стрессу и смерти клетки.
Результаты данной работы не только представляют значительный фундаментальный интерес, но могут иметь и практическое применение. Авторы показали, что уровни ферродоксина 1 и липолированных белков сильно варьируют между различными раковыми опухолями человека. Клеточные линии с большим количеством липолированных белков демонстрируют наибольшую чувствительность к индукции купроптозиса, что предполагает использование основанной на ионах меди терапии против опухолей с таким метаболическим профилем.
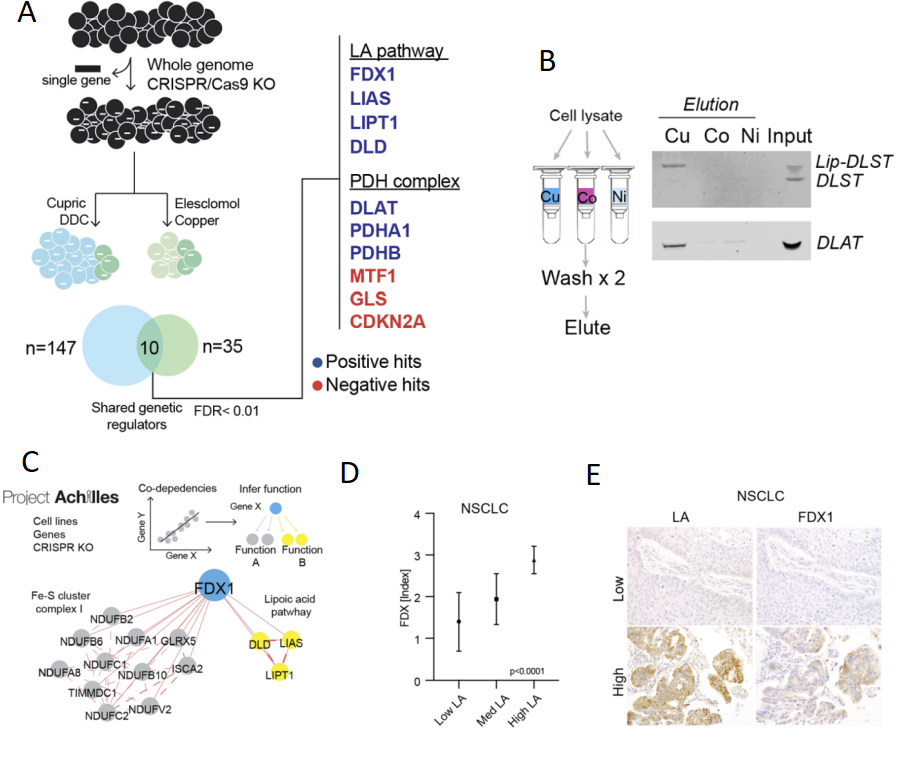
Рис. 1.
(A) Полногеномный CRIPSR/Cas9 скрин с позитивной селекцией и использованием двух ионофоров меди (Cu-DDC and Cu-элескломол) в OVISE клетках. Белки, мутации которых повышают устойчивость к купроптозису, выделены синим. Белки, мутации которых усиливают токсичный эффект избытка ионов меди, выделены красным. (В) Прямое взаимодействие ионов меди и DLST белка, модифицированного липоевой кислотой. (C) Анализ корреляции зависимости генов из проекта Ахиллес, представлена корреляция для делеции гена FDX1. Связь с комплеком I и биогенезом липоевой кислоты продемонстрирована на рисунке (D). Коллекция гистологических срезов легочной карциномы (Non-small cell lung carcinoma (NSCLC) (n=57)) была покрашена антителами к ферродоксину 1 и липоевой кислоте. Полуколичественная оценка интенсивности окрашивания указывает на корреляцию в их уровне. Примеры срезов с иммуногистохимическим окрашиванием на ферродоксин 1 (FDX-1) и липоевую кислоту (LA) представлены на (Е).
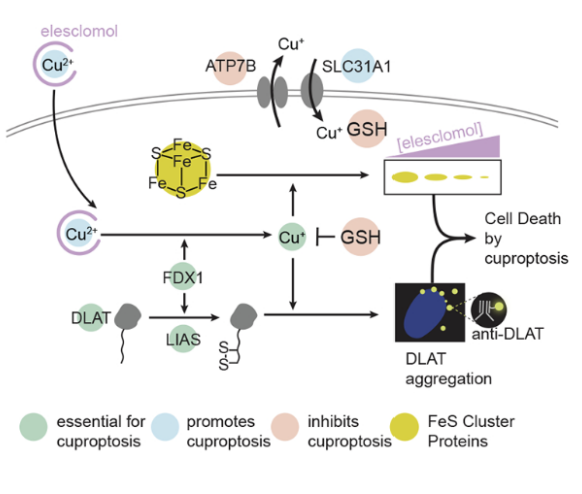
Рис. 2.
Схема купроптозиса, предложенная авторами. Избыток меди приводит к аггрегированию липолированных белков, дестабилизации железо-серных кластеров и клеточной смерти.
1. Tsvetkov P, Coy S, Petrova B, et al (2022) Copper induces cell death by targeting lipoylated TCA cycle proteins. Science 375:1254–1261
2. Tsvetkov P, Detappe A, Cai K, et al (2019) Mitochondrial metabolism promotes adaptation to proteotoxic stress. Nat Chem Biol 15:681–689
Новость представила ©Карпова Я.Д.
30.08.2022