 © Баклушинская Ирина Юрьевна, ведущий научный сотрудник лаборатории эволюционной генетики развития, доктор биологических наук.
© Баклушинская Ирина Юрьевна, ведущий научный сотрудник лаборатории эволюционной генетики развития, доктор биологических наук.
Статья, вышедшая 13 сентября в престижном журнале Nature Communications вызвала широкий резонанс в средствах массовой информации , в том числе и в нашей стране. Чем же настолько заинтересовала публикация с весьма сложным названием? И почему заметка редактора (Gretchen Vogel) одного из ведущих журналов (Science) имеет название ‘Motherless babies!’ How to create a tabloid science headline in five easy steps (Дети без матери! Как за пять легких шагов сотворить таблоидно-научный заголовок. Попробуем разобраться, обоснованно ли такое внимание или это мыльный пузырь, родившийся в муках перевода "с научного" на "газетный" язык.
Начнем с анализа результатов, полученных биологами из Великобритании и Германии, под руководством проф. Perry из университета Bath. Работа, несомненно, очень масштабная и, в хорошем смысле, провокационная, но в большинстве газетных публикаций, как это нередко бывает, суть ее искажена практически до неузнаваемости.
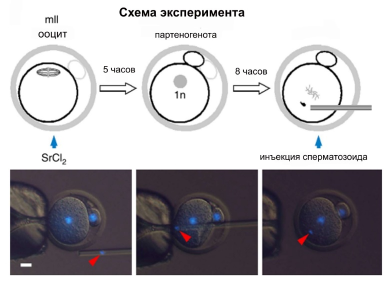
Проблема, к решению которой попытались приблизиться авторы, – самая фундаментальная, это в прямом смысле основа жизни – оплодотворение и репрограммирование, т.е. изменение потенций клеток, происходящее в ходе оплодотворения. Две высокоспециализированные клетки, сперматозоид и ооцит, по образному выражению авторов, умирают, чтобы дать жизнь тотипотентному эмбриону. В данной работе в качестве клеток, которым была отведена главная роль, использовали сперматозоиды и не ооциты, а так называемые партеногеноты – результат первого митотического деления ооцита (получены при воздействии хлорида стронция на ооцит). Ранее считалось, что, пройдя митоз, эти клетки утрачивают некие факторы, характерные для ооцита и необходимые для активации генома сперматозоида, поэтому нормальное развитие после оплодотворения сперматозоидом партеногеноты невозможно. Причиной таких затруднений, по-видимому, является особая структура хроматина, т.н. тороидальный хроматин, характерный для мужских гамет млекопитающих, который, как считалось, поддается репрограммированию только под воздействием ооцита. Но проведенное исследование впервые позволило продемонстрировать пластичность перепрограммирования терминально дифференцированных сперматозоидов и высказать предположение о том, что состояние тотипотентности может быть достигнуто использованием различных механизмов, среди которых эпигенетические, вероятно, играют ведущую роль.
Важно подчеркнуть, что партеногеноты - это гаплоидные клетки, и тот факт, что они несут половину набора хромосом, и позволил после оплодотворения гаплоидной же мужской гаметой получить диплоидный эмбрион и даже взрослых, способных к размножению, мышей. Именно этот момент был упущен в большинстве газетных публикаций, авторы которых почему-то решили, что данное исследование открывает путь для получения детей в пробирке из диплоидных клеток кожи, без участия яйцеклеток (напомним, исходно использовался ооцит) и, соответственно, материнского генома. Но, как известно, пока не разработан способ «обойти» мейоз. Получение in vitro мужских гамет было осуществлено раньше, чем женских
(Sato T, et al. (2011)),
эти работы идут очень активно,
см.
обзор А.Ю. Кулибина на нашем сайте).
Получение женских гамет стало возможно совсем недавно также путем создания искусственных гонад, в культуре были воспроизведены все фундаментальные процессы оогенеза: мейоз, рост ооцитов, геномный импринтинг
(
Morohakua, et al., 2016
см.
обзор А.Ю. Кулибина на нашем сайте
).
|
Авторы статьи использовали метод искусственного оплодотворения в виде инъекций сперматозоидов в партогеноты (phICSI). Был получен и проанализирован колоссальный материал: в каждом варианте, а также в разных контролях, использовали сотни клеток, было проведено огромное количество операций по трансплантации эмбрионов суррогатным матерям-мышам. Первый этап эксперимента – получение партеногеноты, т.е двух гаплоидных клеток из одной яйцеклетки, что было достигнуто благодаря использованию хлорида стронция в трех разных группах экспериментов: 7, 10, 13 часов воздействия. Группы партеногенот, полученные таким образом, анализировали раздельно, наиболее близкими к различным контрольным группам оказалась последняя группа, именно в этих экспериментах показан практически нормальное ремоделирование хроматина спермы и экспрессия в полученных эмбрионах (на стадии бластоцисты) основных маркеров активности отцовского генома (в том числе Nanog и Oct4). Также в этой группе выше оказался процент доживания до взрослого состояния (8.1%). Были также поставлены контрольные эксперименты для подтверждения того, что геномы всех клеток эмбрионов являются бипарентальными. В итоге сделан вывод о том, что инъекция спермы в партеногенетический двуклеточный эмбрион ведет к тотипотентности, бипарентальным бластомерам и обеспечивает нормальное развитие для небольшого, но значимого числа особей. Также была проведена оценка возможности партеногенот к репрограммированию нуклеосомального хроматина, для чего использовали сперматоциты на стадии круглых сперматид. Оказалось, что оптимальное временное окно для репрограммирования отцовского хроматина отличается от того, что было получено для зрелой спермы. И процент рождения детенышей при подсадке таких эмбрионов суррогатным матерям, также отличается (2.6%).
Анализ нарушений программ развития и эпигенетических изменений у эмбрионов, полученных при инъекции спермы в партеногеноты показал, что возможны нарушения репрограммирования. Также было показано, что транскриптом полученных эмбрионов отличается от нормального, а нарушение регуляции экспрессии факторов плюрипотентности может вносить свой вклад в нарушение развития эмбрионов, полученных при оплодотворении партеногенот нормальной спермой.
Эти результаты свидетельствуют о трудности моделирования процессов оплодотворения и развития, но главный результат в том, что впервые было показано, что партеногеноты могут, как и ооциты, ремоделировать хроматин спермы, а пути достижения тотипотентности могут быть разными.
Несомненно, "трудности перевода" в данном случае превратили очень интересные для биологов развития результаты в мыльный пузырь рассуждений о ненужности яйцеклеток. В заметке в Science рассмотрены "шаги" этих превращений: слишком специальное название было интерпретировано в Nature Communications пресс-релизе так: Mouse sperm injected into a modified, inactive embryo can generate healthy offspring [сперма мыши, введенная в модифицированный, инактивированный эмбрион, может генерировать здоровое потомство]. Кроме того, был дан яркий заголовок: "Mouse sperm generate viable offspring without fertilization in an egg" [сперма мыши генерирует жизнеспособное потомство без оплодотворения яйца]. Таким образом, все подходы, использованные в работе, были искажены. В экспериментах, описанных в исходной статье, жизнеспособное потомство было получено в результате оплодотворения сперматозоидом гаплоидной клетки-потомка яйцеклетки, партеногеноты (а не эмбриона (диплоидного у мыши), и тем более, не дифференцированной диплоидной клетки кожи.
В интервью Science один из ведущих специалистов в области детерминации пола и биологии развития Dr. Lovell-Badge, сказал, что он шокирован реакцией прессы, которая не имеет ничего общего с тем, что было показано в хорошо технически выполненном исследовании. Вместе с тем, даже это исследование не приблизило нас к пониманию того как получить гаплоидные клетки из диплоидных, и тем более не показало, что яйцеклетки не нужны для получения потомства в пробирке. Более того, наличие целого ряда отклонений в развитии полученных эмбрионов и отсутствие длительного наблюдения за следующими поколениями, напоминают нам о том, что любое вмешательство в природные процессы имеет последствия.
Copyright © 29.09.2016 Bakloushinskaya I.Yu.