
 © Люпина Юлия Вячеславовна, ведущий научный сотрудник лаборатории биохимии процессов онтогенеза, доктор биологических наук. Область научных интересов: протеомика, структура и функции белков, контроль клеточного протеома, связывающие белки, макромолекулярные комплексы в развитии, эволюция белков.
© Люпина Юлия Вячеславовна, ведущий научный сотрудник лаборатории биохимии процессов онтогенеза, доктор биологических наук. Область научных интересов: протеомика, структура и функции белков, контроль клеточного протеома, связывающие белки, макромолекулярные комплексы в развитии, эволюция белков.
© Михайлов Виктор Сергеевич, главный научный сотрудник. Доктор биологических наук, профессор. Область научных интересов: репликация ДНК, репарация ДНК, ДНК-полимеразы, ДНК-связывающие белки, макромолекулярные синтезы в раннем развитии, репродукция вирусов.
Факторы транскрипции, связанные с миокардином (MRTF), впервые были обнаружены в кардиомиоцитах млекопитающих. Однако, дальнейшие исследования установили, что у всех многоклеточных животных MRTF-A и -B (известные как MAL и MKL1/2) являются коактиваторами транскрипции, зависящей от фактора сывороточного ответа (SRF), а комплекс MRTF/SRF регулирует большую группу генов, участвующих в ремоделировании цитоскелета, контрактильности, организации внеклеточного матрикса и других процессах. Члены семейства факторов транскрипции, связанных с MRTF, активно изучаются в процессах при эпителиально-мезенхимальном переходе клеток у многоклеточных животных [1, 2].
Губки (тип Porifera), древнейшие из ныне существующих многоклеточных животных, обладают уникальной способностью к постоянному ремоделированию камер их водоносной системы и трансформациям клеточных типов, а также скоординированным движениям внутренних структур во время сокращений тела. Будучи прикрепленными животными, губки должны активно прокачивать воду через систему многочисленных внутренних каналов для питания, газообмена, удаления отходов и полового размножения. Однако ничего не было известно о структурно-функциональной организации их сократительных модулей. Понимание того, как губки сокращаются, имеет ключевое значение для выявления эволюционных основ происхождение миоцитов и движения у многоклеточных животных. Водоносная система губок разделена на входные полости, каналы и камеры, выстланные жгутиковыми клетками (хоаноцитами), которые генерируют направленный ток воды и фагоцитируют бактерии, и отводящие каналы, которые направляют поток воды с отходами к месту выведения - оскулуму. Сокращения тела губки препятствуют закупорке каналов и поддерживают ток воды. В начале цикла сокращения входные поры закрываются, а каналы сужаются, и внутреннее давление воды увеличивается для вытеснения отходов.
Выращенные из геммул в лаборатории небольшие и прозрачные ювенильные пресноводные губки Ephydatia muelleri являются удобной моделью для изучения механизма сокращения. Авторы статьи, Colgren& Nichols, установили, что у Ephydatia muelleri циклы сокращения двухфазные. Во время фазы I объем полостей уменьшается, а входные каналы водоносной системы сужаются, поскольку вода вытесняется в отводящие каналы, которые увеличиваются в диаметре. Во время фазы II объем полостей и диаметр входного канала водоносной системы увеличиваются по мере сужения выводного канала в направлении оскулума. Авторы статьи изучили организацию сократительного модуля Ephydatia muelleri, состоящего из актина, миозина II поперечнополосатых мышц и трансгелина. Сокращение губки регулируется высвобождением внутриклеточных запасов Ca2+ в начале биохимического пути, включающего миозинкиназу легкой цепи (MLCK) и активирует фактор транскрипции MRTF как часть индуцируемого окружающей средой транскрипционного комплекса. Регулируемая актином MRTF-активность вызывает сокращение выстилающих каналы клеток, формирующихся из стволовых клеток, которые способны динамически перестраиваться в ответ на поток воды в отсутствие внутренних пространственных сигналов типичных для эмбриогенеза животных. Авторы пришли к выводу, что сократительный модуль губки имеет элементы гомологии с сократительными тканями других животных, включая мышцы, что указывает на происхождение от общей многофункциональной ткани животных.
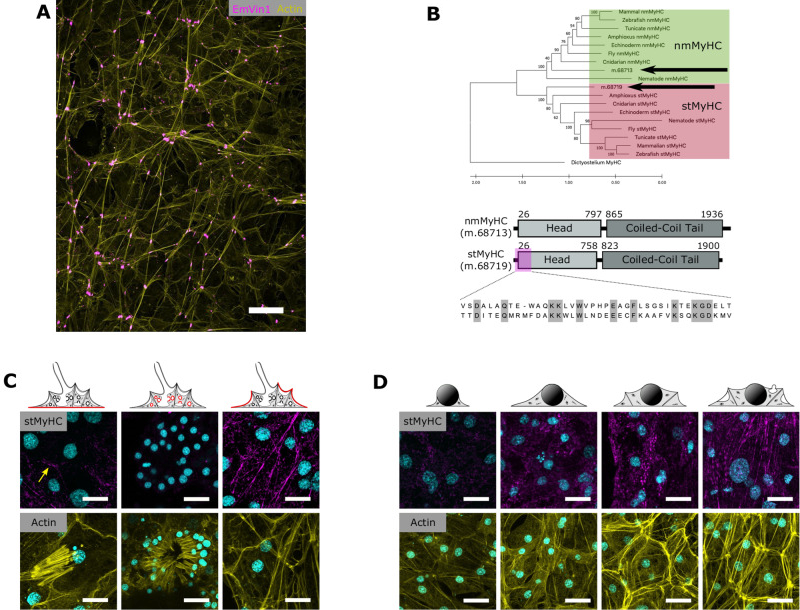
Рис. 1.
Организация пучков актомиозина. А. Организация актиновых пучков (желтого цвета) в поврежденных тканях с клеточными соединениями, отмеченными окрашиванием винкулином (пурпурный). B. Белки MyHC II типа, обнаруженные у E. muelleri (помечены стрелками), относятся либо к кладе stMyHC, либо к кладе nmMyHC. Филогения определялась методом максимального правдоподобия. Нижние панели показывают структуру двух белков MYHC типа II, обнаруженных у E. muelleri, и расположение эпитопа, используемого для создания антител к stMyHC. С. Иммуноокрашивание stMyHC в базопинакодерме (слева), камере хоаноцитов (в середине) и пораженных тканях (справа). Образцы окрашивали на ДНК (пурпурный), stMyHC (голубой; вверху) и актин (желтый; внизу). Желтая стрелка показывает окрашивание границ клеток в базопинакодерме. D Развивающаяся серия актиновых пучков в несущих пинакоцитах, окрашенных на ДНК (пурпурный), stMyHC (голубой; вверху) и актин (желтый; внизу). Линейки шкалы 25 мкм в A и 10 мкм в С, D.
Ранее было установлено, что выстилающие каналы губок эндотелиоподобные клетки - пинакоциты играют основную роль в сокращении, а также экспрессируют гены, участвующие в сокращении [3]. В данной статье авторы выявили у E. muelleri пинакоциты, содержащие линейные актиновые пучки, которые располагаются между соседними клетками, демонстрируя общетканевую организацию (рис. 1А). Затем они получили специфические антитела к белку stMyHC и проверили связаны ли эти пучки актина с миозином II, проведя иммуноокрашивание на stMyHC (рис. 1CD). Окрашивание усиливалось на протяжении всего развития губки. В полностью дифференцированных клетках тела губки stMyHC был организован в линейные структуры, напоминающие пучки. Далее авторы обработали губок ингибитором полимеризации актина, латрункулином В, и наблюдали потерю окрашивания stMyHC, которая отражала динамику разборки пучков актина.
E. muelleri имеет белки гомологи кальмодулина, MLCK и ортолог RLC (регуляторная легкая цепь миозина) с консервативными функциональными остатками (рис. 2АB). Авторы статьи предположили и затем доказали, что сокращения тела губки E. muelleri зависят от высвобождения запасов Ca2+ из клеток, которые расположены ниже течения тока воды и активируются NO-сигналингом. Сначала была определена концентрация чернил Sumi, блокирующая поток воды в губках, обработанных L-NAME (т.е. в губках с дефицитом синтеза NO). Очистку чернил и восстановление потока определяли путем последующей обработки губок DiI. Было обнаружено, что обработанные ML-7 губки не способны очищать чернила и восстанавливать текучесть воды, а тапсигаргин не мог заставить их сокращаться (рис. 2CD). У позвоночных RLC является субстратом для MLCK во время сокращения гладких мышц. Чтобы проверить фосфорилирование RLC во время сокращения авторы окрашивали губок на фосфорилированный RLC (pRLC) и наблюдали сократительные пучки на поверхности губки. Их длина отрицательно коррелировала с окрашиванием pRLC, что указывает на то, что повышенное фосфорилирование RLC связано с их сокращением. Повышенный уровень Ca2+ активирует MLCK, что приводит к повышению уровня фосфорилирования RLC, связанного с сократительными пучками актина пинакодермы у губок.
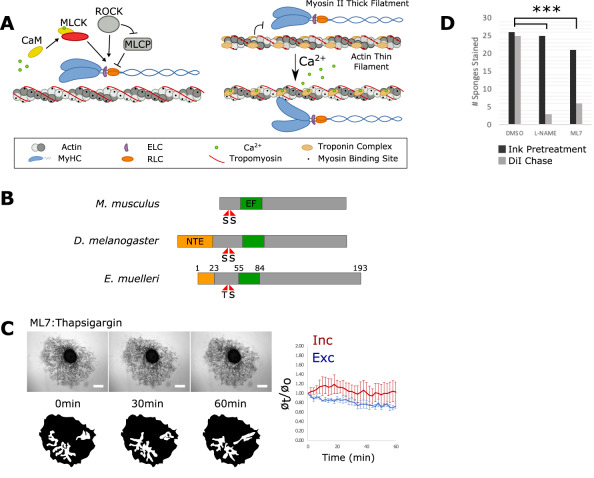
Рис. 2.
А. Сокращения мышечной ткани требуют активности MLCK. Быстро сокращающиеся миоциты регулируются комплексом тропонин С/Тропомиозин, тогда как медленно сокращающиеся миоциты регулируются MLCK. B. Предсказанная доменная структура RLC E. muelleri. С. Тапсигаргин 1 нМ оказывал ограниченное действие на губок, предварительно обработанные 1 мкм МL 7 для ингибирования активности MLCK. D. Губки обрабатывали чернилами Sumi для блокирования тока воды и затем DiI для проверки восстановленного потока в качестве показателя сократительной активности. Соотношение губок, которые окрашивались положительно на DiI, было значительно ниже после обработки 50 мкг/мл L-NAME и 1 мкм МL-7 по сравнению с контролем. Линейки шкалы 500 мкм.
Для поиска консервативных механизмов регуляции сократительных клеток у губок и двустворчатых, авторы исследовали транскрипционный фактор MRTF. E. muelleri обладает единственным ортологом MRTF, который имеет RPEL повтор, что предполагает возможность регуляции его активности путем взаимодействия с G-актином, как и у билатеральных животных. Используя специально полученные антитела, авторы обнаружили, что этот белок имеет преимущественно цитоплазматическую локализацию в недифференцированных археоцитах (стволовые клетки) и ядерную - в пинакоцитах, где он предположительно действует как транскрипционный кофактор. Известные мишени регуляции MRTF у билатеральных включают семейство трансгелинов (в частности, кальпонин, SM22alpha, MP20), которые могут быть специфичными для мышц. E. muelleri имеет три паралога трансгелина. Авторами обнаружено, что трансгелин 2 (EmTAGLN2) локализован в сократительных пучках в пинакоцитах. Поскольку активность MRTF регулируется G-актином авторы модулировали его активность с помощью фармакологических соединений. N-циклопропил-5-(тиофен-2-ил)изоксазол-3-карбамид (ISX) является активатором MRTF38–40 и стимулирует дифференцировку кардиомиоцитов in vivo, а также управляет экспрессией секреторных программ и дифференцировкой нейронов через транскрипционный фактор NeuroD1. Так как у губок отсутствуют NeuroD1, авторы предположили, что он может действовать в первую очередь на MRTF. Была проведена оценка экспрессии EmTAGLN2 (прогнозируемая MRTF-мишень) в ответ на обработку CCG-207319 и ISX. Обработка CCG-207319 вызывала снижение экспрессии EmTAGLN2, тогда как обработка ISX приводила к увеличению экспрессии EmTAGLN2. Авторы подтвердили этот результат обработкой цитохалазином D — мощным активатором MRTF посредством конкурентного связывания G-actin44 — и аналогичным образом наблюдали увеличение экспрессии EmTAGLN2. Губки, у которых ингибировали MRTF, имели пониженную способность очищать чернила Sumi - указание на сниженную сократительную активность
Чтобы проверить влияние активации MRTF на дифференцировку сократительной ткани, авторы диссоциировали ювенильных губок и обработали DMSO или ISX обогащенные археоцитами клеточные фракции, которые поместили в среду, свободную от точек прикрепления, что позволяет образовывать первичные агрегаты – примморфы, но задерживает дифференцировку клеток. Через три дня у контрольных примморфов отсутствовали сократительные пучки, тогда как у примморфов, обработанных ISX, развились линейные актиновые пучки, которые выравнивались по адгезивным бляшкам. Они окрашивались антителами к pRLC и содержали повышенные уровни stMyHC. Тапсигаргин не оказывал влияния на контрольные примморфы, но вызывал сокращения в образцах, обработанных ISX (рис. 3С).
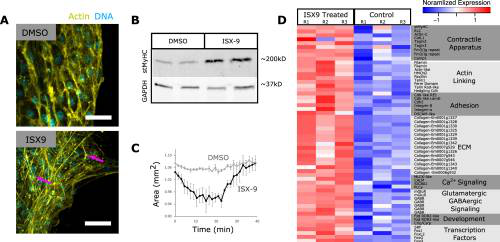
Рис. 3.
MRTF стимулирует дифференцировку сократительной ткани у примморфов. А. Примморфы, обработанные 50 мкм ISX или DMSO и окрашенные фаллоидином
(желтый) и DAPI (голубой). Линейки шкалы 10 мкм. B. Вестерн-блоттинг, показывающий повышенный уровень stMyHC в образцах, обработанных ISX. C. Динамика сокращения примморфов, обработанных ISX, в ответ на тапсигаргин. D. Тепловая карта транскриптов с дифференциальной экспрессией в образцах, обработанных ISX.
Для характеристики транскрипционного ответа примморфов на активацию MRTF, авторы секвенировали мРНК из примморфов, обработанных ISX или DMSO (рис. 3D). Анализ дифференциальной экспрессии 16 712 транскриптов показал, что 1390 были повышены, а 1091 - понижены. Гены с измененной регуляцией - потенциальные мишени для регуляции MRTF. Образцы, обработанные ISX, показали повышенную экспрессию генов, участвующих в сокращении, передаче сигналов, развитии и адгезии. Активированные и связанные с сокращением гены включали stMyHC, что было подтверждено методом вестерн-блоттинга (рис. 3B), и компоненты Ca2+-зависимого пути MLCK, включая MLCK-подобную серин/треонинкиназу, кальмодулин, натрий/кальциевый обменник 1 (SLC8A1) и фосфолипазу С гамма (PLCy) (Рис. 3D). Повышенная регуляция сигнальных генов включала метаботропные глутаматные рецепторы и субъединицы ГАМК-рецепторов, что указывает на роль глутаматергической и ГАМКергической сигнализации в сократительном поведении. Повышенные факторы развития включали миогенный фактор транскрипции SRF. Четыре фактора транскрипции Forkhead показали повышенную экспрессию, включая Fox-L2 FoxG, который экспрессируется в миоцитах беспозвоночных, FoxO и FoxJ1. Некоторые из генов с наибольшей экспрессией принадлежали к семейству коллагена, что позволило предположить участие пинакоцитов в секреции внеклеточного матрикса. Целых четырнадцать коллагенов имели повышенную экспрессию в образцах, обработанных ISX. Молекулы адгезии, включая кадгерины, интегрины и молекулу адгезии клеток с синдромом Дауна, также имели повышенные уровни экспрессии. Хотя многие активированные гены соответствуют профилю транскрипции пинакоцитов на основе данных scRNA-seq, повышенная регуляция силикатеина — маркера склероцитов — предполагает, что обработка примморфов ISX также вызывала дифференцировку и других типов клеток.
Обобщая полученные авторами данные, можно заключить, что E. muelleri содержит сократительный модуль с элементами, гомологичными сократительным тканям других
животных. Пучки актомиозина, содержащие stMyHC и трансгелин, демонстрируют общетканевую организацию пинакодермы, которая выстилает каналы водоносной системы губки. Сокращение зависит от высвобождения запасов Ca2+ и регуляции MLCK stMyHC, а также от стадии развития губки. Сократительный модуль, по-видимому, зависит от активности MRTF. Результаты данной статьи подтверждаются данными других исследователей, полученными при секвенировании единичных клеток родственного вида пресноводной губки Spongilla lacustrisi [4], которые указывают на то, что пинакоциты и миопептидоциты родственны с миоцитами других животных. Секвенирование единичных клеток морской губки Amphimedon queenslandicaтакже выявило коэкспрессию ключевых компонентов сократительного аппарата на основе актина в пинакоцитах [5].
Полученные результаты показывают, что сократительный модуль мышечных тканей сформировался еще до появления современных животных. Возможная роль MRTF в определении сократительных процессов у E. muelleri помогает объяснить пластичность и регенеративную способность губок. Очевидно, что без внутренних пространственных сигналов, характерных для эмбриогенеза, губки могут развиваться из обогащенных археоцитами агрегатов и геммул, а взрослые ткани могут перестраиваться в ответ на динамику потока воды. MRTF является регулируемым актином источником силы, определяющей пластичность и регенерацию у многоклеточных животных, в том числе и у губок. Результаты авторов могут послужить основой представлений об организации сократительных тканей у первых животных, а также о последовательности событий, которые привели к появлению первых мышц. Очевидно, что миоэпителий современных животных сохраняет особенности древнего мышечного предшественника. Первые животные, несомненно, были водными, поэтому миоэпителий, возможно, функционировал для поддержания натяжения тканей в контексте гидростатического скелета или, возможно, функционировал подобно перистальтике при гребле анемона Nematostella vectensis, или при сужении канала у E. muelleri.
1. Morita T., Mayanagi T., Sobue K. Dual roles of myocardin-related transcription factors in epithelial mesenchymal transition via slug induction and actin remodeling. J Cell Biol 179(5):1027-42 (2007).
2. Gasparics&Sebe, MRTFs- master regulators of EMT, Dev Dyn. 247(3):396-404 (2018).
3. Nickel, M., Scheer, C., Hammel, J. U., Herzen, J. & Beckmann, F. The contractile sponge epithelium sensu lato–body contraction of the demosponge Tethya wilhelma is mediated by the pinacoderm. J. Exp. Biol. 214, 1692–1698 (2011).
4. Musser, J. M. et al. Profiling cellular diversity in sponges informs animal cell type and nervous system evolution. Science 374, 717–723 (2021).
5. Sebé-Pedrós, A. et al. Early metazoan cell type diversity and the evolution of multicellular gene regulation. Nat. Ecol. Evol. 2, 1176–1188 (2018).
Новость представлена © Ю. В.Люпиной и В. С. Михайловым
29.07.2022