
 © Чернышева Мария Борисовна, к.б.н., младший научный сотрудник лаборатории Клеточной Биологии ИБР РАН им. Н.К. Кольцова. Область научных интересов: биология развития, регенеративная медицина, панкреатические бета-клетки.
© Чернышева Мария Борисовна, к.б.н., младший научный сотрудник лаборатории Клеточной Биологии ИБР РАН им. Н.К. Кольцова. Область научных интересов: биология развития, регенеративная медицина, панкреатические бета-клетки.
© Ручко Евгений Сергеевич, аспирант лаборатории Клеточной Биологии ИБР РАН им. Н.К. Кольцова. Область научных интересов: регенерация бета-клеток островков Лангерганса.
Статья А. Rubio-Navarro и его соавторов в журнале Nature cell biology посвящена исследованию гетерогенности популяции бета-клеток поджелудочной железы при развитии сахарного диабета (СД) 2-го типа. Ключевым методом в данной работе стал метод секвенирования одиночных клеток (scRNA-seq). Как известно, метод секвенирования одиночных клеток произвел революцию в медико-биологических науках, обеспечив исследователей инструментом для анализа отдельных клеток в тканях и выявлении межклеточной генетической и транскриптомной гетерогенности в норме или при развитии заболевания, что и было продемонстрировано в данной работе (Han, Y., Wang, Peng, 2022).
Авторы изучили транскриптомы отдельных клеток островков поджелудочной железы и выявили четыре кластера бета-клеток (рис. 1 а,б,в), каждый из которых имеет свои характерные генетические признаки – «молекулярные подписи». Интерес исследователей привлекла одна из популяций бета-клеток, характеризующаяся высокой экспрессией CD63 (рис.1 д), которая, снижается как у людей с СД 2-го типа, так и в экспериментальной модели у мышей (рис.1г). CD63 — мембранный белок, гликопротеин из семейства тетраспанинов, задействованный во множестве процессов, определяемых его субклеточной локализацией (поздние эндосомы, лизосомы, секреторные везикулы и плазматическая мембрана). Интересно, что другие белки этого семейства, такие как CD9 или CD81, использовались в качестве маркеров для определения популяций бета-клеток в других работах (Salinno, C. et al., 2021; Dorrell, C. et al., 2016).
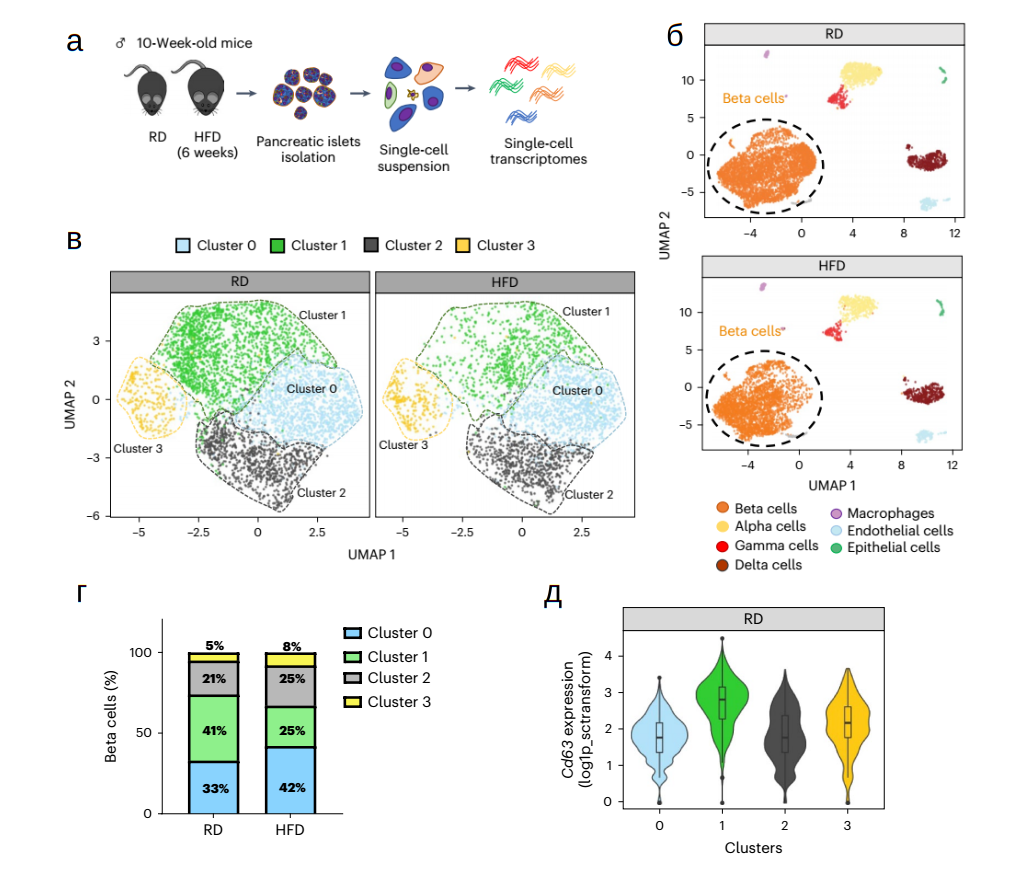
Функционально бета-клетки с высоким уровнем экспрессии CD63 (CD63hi) (рис. 2) характеризуются интенсивным метаболизмом глюкозы и повышенной активностью митохондрий по сравнению с клетками с низким уровнем экспрессии CD63 (CD63lo). Кроме того, CD63hi бета-клетки демонстрируют более высокую гранулярность, меньшее количество незрелых гранул инсулина и усиление способности секретировать инсулин и встречаются во всех отделах поджелудочной железы.
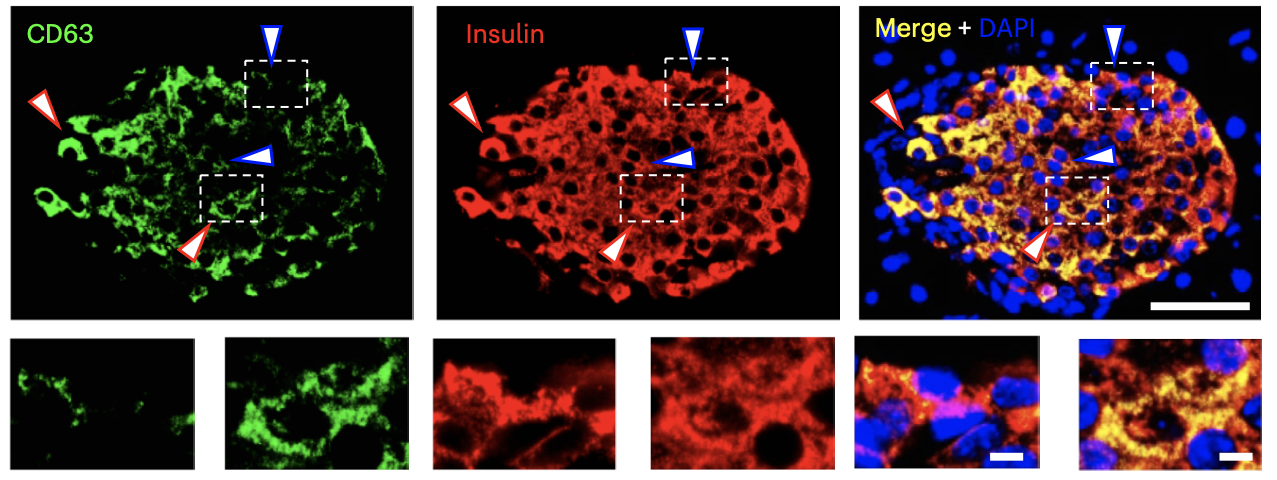
Кроме того, у CD63hi бета-клеток выявлена повышенная глюкозо-стимулированная секреция инсулина (GSIS), большое количество генов, обеспечивающих этот процесс, а также более низкие уровни транскриптов генов, связанных с незрелыми или дисфункциональными бета-клетками. С помощью подходов in silico были выявлены многочисленные транскрипционные факторы, активные в этой группе бета-клеток (рис. 3). Однако, какие именно молекулярные пути способствуют интенсивной секреции инсулина, еще предстоит определить. Также авторы предполагают, что две популяции бета-клеток CD63hi и CD63lo присутствуют в организме для координации оптимального GSIS при низких и высоких концентрациях глюкозы в крови соответственно.
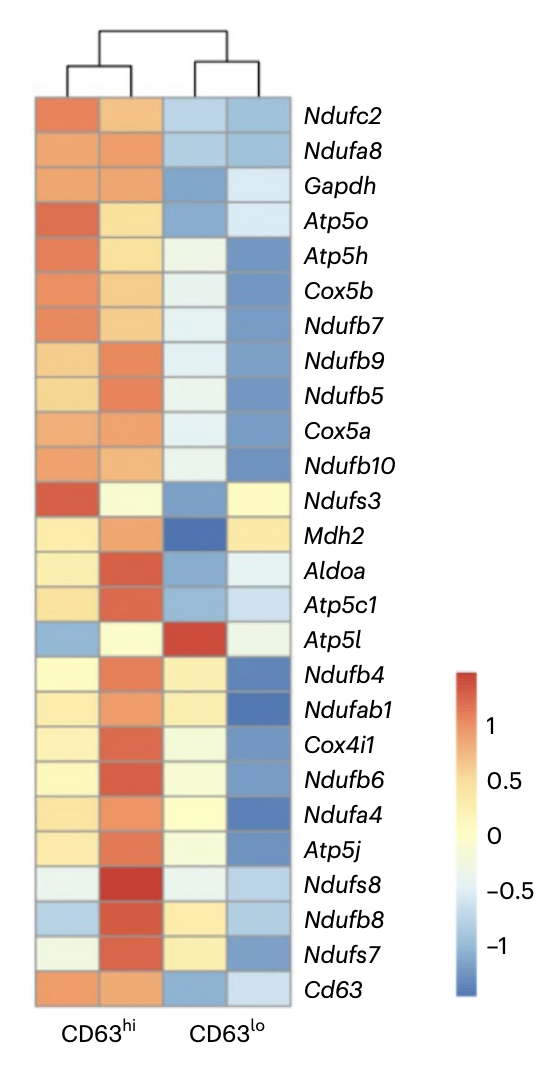
Рис. 3.
Тепловая карта генов гликолиза, цикла трикарбоновых кислот и митохондриальных генов из FAC-сортированных CD63hi и CD63lo популяций бета-клеток, полученных с помощью объемного РНК-секвенирования (N = 2 на группу)
В CD63lo бета-клетках наблюдается более высокая экспрессия рецептора глюкагоноподобного пептида-1 (Glp1R) по сравнению с бета-клетками CD63hi. Глюкагоноподобный пептид 1 (GLP-1) увеличивает секрецию инсулина через плейотропный механизм, включающий увеличение мембранного потенциала митохондрий и производство АТФ, улучшает доступ секретирующих инсулин гранул к плазматической мембране и повышает возбудимость бета-клеток (Doyle, Egan, 2007). Кроме того, GLP-1 повышает чувствительность бета-клеток к глюкозе, обеспечивая деполяризацию мембраны и последующее высвобождение инсулина (Holz, Kuhtreiber, 1993). Чтобы оценить, может ли рецептор GLP-1 играть роль в регуляции секреции инсулина в бета-клетках CD63lo, исследователи провели GSIS-анализ с агонистом GLP1R - Эксендином-4. Эксендин-4 усиливал секрецию инсулина в популяциях бета-клеток CD63hi и CD63lo, что указывает на то, что снижение уровня секреции инсулина, наблюдаемое в бета-клетках CD63lo, может быть скорректировано активацией GLP1R. Эти результаты показывают, что бета-клетки CD63lo являются жизнеспособными и функциональными бета-клетками, способными секретировать инсулин, а активация GLP1R является потенциальным терапевтическим подходом для людей с пониженной частотой бета-клеток CD63hi.
Большой интерес представляет часть эксперимента (рис. 4), в которой исследователи собрали, из реагрегированных на предыдущих этапах популяций CD63hi и CD63lo бета-клеток, сфероиды, иначе называемые псевдоостровками поджелудочной железы (рис. 5). CD63hi псевдоостровки демонстрировали более высокую экспрессию основных генов бета-клеток, таких как Ins2, Pdx1 и Mafa, по сравнению с CD63lo псевдоостровками, в которых наблюдались повышенные уровни экспрессии генов, обнаруженных в дедифференцированных и дисфункциональных бета-клетках. Псевдоостровки двух типов трансплантировали под капсулу почки мышам с диабетом (рис. 4 а). В эксперименте использовались иммунодефицитные мыши NOD/SCID со спонтанным диабетом без ожирения, которым дополнительно однократно вводили стрептозотоцин, токсичный для бета-клеток. У диабетических мышей, которым были пересажены псевдоостровки CD63hi, наблюдалось заметное снижение уровня глюкозы в крови и уменьшение массы тела по сравнению с теми, кто получал псевдоостровки CD63lo (рис. 4 б, в, г).
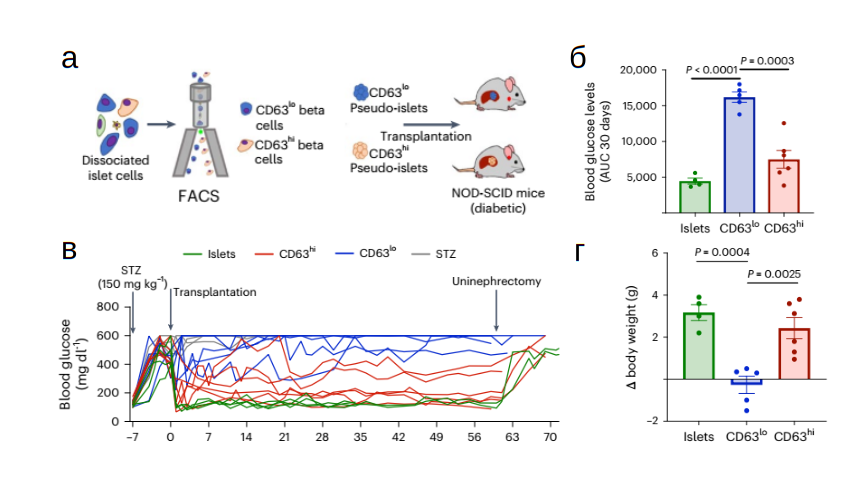
Рис. 4. Трансплантация псевдоостровков CD63hi иCD63lo, а также интактных островков мышам NOD-SCID с индуцированным диабетом. а. Схема эксперимента; б. Уровень глюкозы в крови у мышей через 30 дней после трансплантации; в. Изменения уровень глюкозы в крови у мышей после трансплантации в динамике; г. Изменение массы тела у мышей через 30 дней после трансплантации
Таким образом, CD63 является показательным маркером для выявления бета-клеток с повышенной метаболической активностью и секрецией инсулина, а количество CD63hi бета-клеток может служить полезным показателем для прогнозирования риска развития Т2Д или использоваться для оценки эффективности терапевтических воздействий. Данные, полученные А. Rubio-Navarro и его соавторами, позволяют предположить, что лечение агонистами GLP1R может быть одной из стратегий для усиления секреции инсулина. Кроме того, тот факт, что трансплантация псевдоостровков, состоящих из бета-клеток CD63hi, но не CD63lo, эффективно корректирует гипергликемию у мышей с диабетом, будет полезен для разработки таких подходов к клеточной терапии сахарного диабета, как трансплантация бета-клеток и островков, полученных из стволовых клеток.

- Dorrell C, Schug J, Canaday PS, Russ HA, Tarlow BD, Grompe MT, Horton T, Hebrok M, Streeter PR, Kaestner KH, Grompe M. Human islets contain four distinct subtypes of β cells. Nat Commun. 2016 Jul 11;7:11756. doi: 10.1038/ncomms11756. PMID: 27399229; PMCID: PMC4942571.
- Doyle ME, Egan JM. Mechanisms of action of glucagon-like peptide 1 in the pancreas. Pharmacol Ther. 2007 Mar;113(3):546-93. doi: 10.1016/j.pharmthera.2006.11.007. Epub 2006 Dec 28. PMID: 17306374; PMCID: PMC1934514.
- Holz GG 4th, Kühtreiber WM, Habener JF. Pancreatic beta-cells are rendered glucose-competent by the insulinotropic hormone glucagon-like peptide-1(7-37). Nature. 1993 Jan 28;361(6410):362-5. doi: 10.1038/361362a0. PMID: 8381211; PMCID: PMC2916679.
- Han Y, Wang D, Peng L, Huang T, He X, Wang J, Ou C. Single-cell sequencing: a promising approach for uncovering the mechanisms of tumor metastasis. J Hematol Oncol. 2022 May 12;15(1):59. doi: 10.1186/s13045-022-01280-w. PMID: 35549970; PMCID: PMC9096771.
- Salinno C, Büttner M, Cota P, Tritschler S, Tarquis-Medina M, Bastidas-Ponce A, Scheibner K, Burtscher I, Böttcher A, Theis FJ, Bakhti M, Lickert H. CD81 marks immature and dedifferentiated pancreatic β-cells. Mol Metab. 2021 Jul;49:101188. doi: 10.1016/j.molmet.2021.101188. Epub 2021 Feb 11. PMID: 33582383; PMCID: PMC7932895.
Участвовал в редактировании, обсуждении и предложил статью - Васильев Андрей Валентинович, директор ИБР РАН, чл.-корр. РАН, д.б.н.
Новость подготовили
© Чернышева М.Б. и Ручко Е.С.
29.05.2023