 © Моргун Елена Игоревна,
младший научный сотрудник лаборатории клеточной биологии
© Моргун Елена Игоревна,
младший научный сотрудник лаборатории клеточной биологииРегенерация эпидермиса обеспечивается пролиферацией и дифференциацией резидентных стволовых клеток. В интерфолликулярном эпидермисе взрослых мышей стволовые и прогениторные клетки находятся в базальном слое и поддерживают пул базальных клеток или дифференциацию в супрабазальные слои с последующим формированием рогового слоя (Gonzales and Fuchs, 2017). Полноценное ранозаживление невозможно без реэпителизации, однако, детали этого процесса на данный момент неизвестны. Есть две модели, иллюстрирующие поведение эпидермальных клеток для обеспечения реэпителизации:
1. Базальные клетки мигрируют в раневое ложе и однонаправленно дифференцируются в супрабазальные клетки;
2. Эпидермальные клетки супрабазальных слоёв перемещаются в раневое ложе и формируют базальный слой (Rognoni and Watt, 2018), очевидно, подвергаясь дедифференциации.
Сколько существуют различных транскрипционных состояний для клеток эпидермиса во время повреждения кожи и коррелируют они, или отличаются от своих гомеостатических аналогов, особенно в пределах базального слоя, все ещё предстоит выяснить. В последней работе D. Haensel и коллег были использованы новейшие методы, с помощью которых они искали ответы на эти вопросы.
Для сравнения клеток интактной и поврежденной кожи мышей Haensel и соавторы использовали метод single-cell секвенирования РНК (scRNA-seq), мультиплексной детекции РНК in situ (RNAScope), а также проводили микроскопию с визуализацией времени жизни флуоресценции и анализы псевдовременной траектории и RNA velocity (многомерный вектор, который предсказывает будущее состояние клетки на временной шкале).
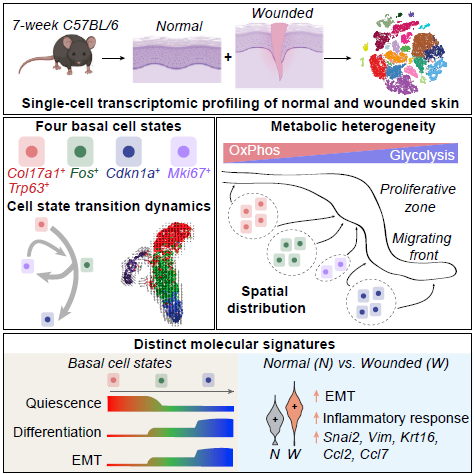
Графический абстракт
Было показано, что при повреждении кожи в эпидермальных клетках базального слоя была повышена экспрессия генов, связанных с воспалением, таких, как Cxcl2, Ccl2, и Ccl7 в то время, как в норме в популяции базальных эпидермальных клеток были обнаружены два подтипа, демонстрирующие низкие и высокие значения экспрессии провоспалительных генов. Кроме того, экспрессия генов, ассоциированных с эпителиально-мезенхимальным переходом, таких, как Snai2 и Vim была повышена в регенерирующем эпидермисе по сравнению с интактной кожей. Таким образом, в норме базальные клетки могут существовать в различных «низко-воспалительных» и «высоко-воспалительных» состояниях, а во время ранозаживления происходит апрегуляция генов, связанных с воспалением и миграцией клеток.
Также Haensel и соавторы продемонстрировали наличие трех различных транскрипционных состояний непролиферирующих базальных клеток в интактной коже:
1. Состояние Col17a1Hi, для которого была характерна экспрессия мастер-генов эпидермальных стволовых клетках Col17a1 стволовых клеток волосяного фолликула в состоянии покоя Trp63.
2. Состояние «раннего ответа», мастер-генами которого являются «ранние» гены, а также гены, ассоциированные с активированными стволовыми клетками волосяного фолликула или гены, связанные с регуляцией пролиферацией – такие, как Fos, Jun и Id1.
3. Состояние «остановки роста», мастер-гены которого связаны с арестом клеточного цикла – такие, как Irf6, Ovol1 и Sfn.
Было показано, что в норме клетки из состояния Col17a1Hi переходят в состояние «раннего ответа», после чего они могут либо пролиферировать, поддерживая свой пул, либо через состояние «остановки роста» переходить в популяцию дифференцированных клеток шиповатого слоя. Таким образом, базальные клетки перед тем, как приступить к дифференцировке в клетки шиповатого слоя проходят три состояния (Col17a1Hi, «раннего ответа» и «остановки роста»), и эта траектория дифференцировки поддерживается за счет активной пролиферации базальных клеток на стыке между состояниями Col17a1Hi и «раннего ответа».
Базальные клетки поврежденной кожи демонстрировали те же три основных состояния, что и клетки интактной кожи. В пролиферативной зоне преобладали состояния Col17a1Hi/«раннего ответа», а состояние «остановки роста» доминировало в миграционном фронте. Также было показано, что значительная доля базальных клеток Col17a1Hi и клеток шиповатого слоя популяции SP1 демонстрировала более быструю динамику по сравнению с нормой, что свидетельствовало об увеличении пластичности клеточного состояния и способности к двунаправленным переходам между базальными и шиповатыми клетками во время ранозаживления.
Кроме того, в этой работе была показана метаболическая неоднородность эпидермальных клеток в норме и при ранозаживлении.
Таким образом, данные Haensel и соавторов свидетельствуют о том, что в норме базальные клетки Col17a1Hi после активации либо начинают пролиферировать в качестве клеток-предшественников, либо останавливают рост и дифференцируются в клетки шиповатого слоя. Хотя эта многоступенчатая траектория дифференцировки от базальных клеток к шиповатым в значительной степени сохраняется при ранозаживлении, ввиду увеличения дифференцировочной пластичности возможны переходы не только клеток базального слоя к шиповатым, но и наоборот.
Исследования влияния воспалительного окружения на дифференцировку эпидермальных клеток, а также на их стволовой статус имеет значительный потенциал для фундаментальной науки и для прикладных исследований в области регенерации ран.
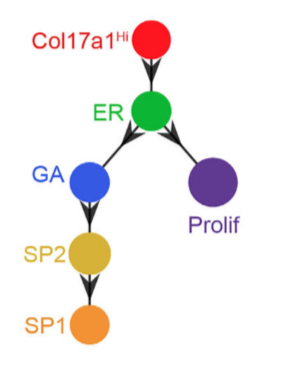
Диаграмма, отражающая траектории дифференцировки эпидермальных клеток, предсказанная с помощью алгоритма scEpath.
Список литературы:
1. Gonzales, K., & Fuchs, E. (2017). Skin and Its Regenerative Powers: An Alliance between Stem Cells and Their Niche. Developmental Cell, 43(4), 387-401. doi: 10.1016/j.devcel.2017.10.001
2. Rognoni, E., & Watt, F. (2018). Skin Cell Heterogeneity in Development, Wound Healing, and Cancer. Trends In Cell Biology, 28(9), 709-722. doi: 10.1016/j.tcb.2018.05.002
Новость подготовила © Моргун Е.И.
28.07.2020