Статья Jing Cao и его соавторов в журнале Cell посвящена получению химерных приматов путём комплементации эмбрионов. Проблема, стоящая перед исследователями, заключается в неспособности донорских эмбриональных стволовых клеток (ЭСК) приматов после введения в состав реципиентной морулы обеспечить развитие химерного эмбриона до стадии бластоцисты, которая пригодна для имплантации. В данной работе учёные пытаются найти способы преодоления этого препятствия на пути к достижению высокой степени химеризма в получаемых организмах.
Известно два состояния плюрипотентности, характерных для эмбриональных стволовых клеток млекопитающих: наивное и праймированное. Эти состояния отличаются эпигенетическим состоянием, профилями экспрессии генов, потенциалом дифференцировки в различные типы клеток и соответствуют разным стадиям развития эмбриона. Наивные ЭСК близки к клеткам внутренней клеточной массы (ВКМ) бластоцисты на преимплантационной стадии. Праймированные ЭСК своими свойствами плюрипотентности походят на клетки эпибласта постимплантационного эмбриона.
Авторы использовали в своем исследовании обезьян циномолгус (Macaca fascicularis). Линии праймированных ЭСК, которые были использованы в ходе исследования, получены из бластоцист на 7 сутки развития. Колонии выделенных ЭСК обладали плоской морфологией, которая аналогична праймированным ЭСК человека. Предыдущие работы показали, что эффективность получения химер приматов низкая, потому что праймированные ЭСК несопоставимы по состоянию плюрипотентности с преимплантационным эмбрионом. В данной работе было предпринято репрограммирование праймированных ЭСК макаки в наивное состояние плюрипотентности, сопоставимое с аналогами клеток в развитии эмбриона. Праймированные ЭСК макаки культивировались в 5 средах для достижения наивного статуса: RSeT, 5iLAF, PXGL, 4CL и LCDM. Исследователи показали, что применение 4CL среды стабилизирует культуру и поддерживает наивное состояние плюрипотентности ЭСК макаки. Полученные колонии наивных ЭСК обладали куполообразной морфологией, которая аналогична наивным ЭСК мышей. В результате исследований было выявлено, что 4CL среда репрограммировала праймированные ЭСК макаки в наивное состояние плюрипотентности, и условия 4CL обеспечивают необходимый баланс между уровнем деметилирования ДНК клеток в сочетании с высокими уровнями экспрессии генов факторов плюрипотентности и стабильностью генома в сравнении с остальными средами для получения наивных ЭСК (Рис. 1).
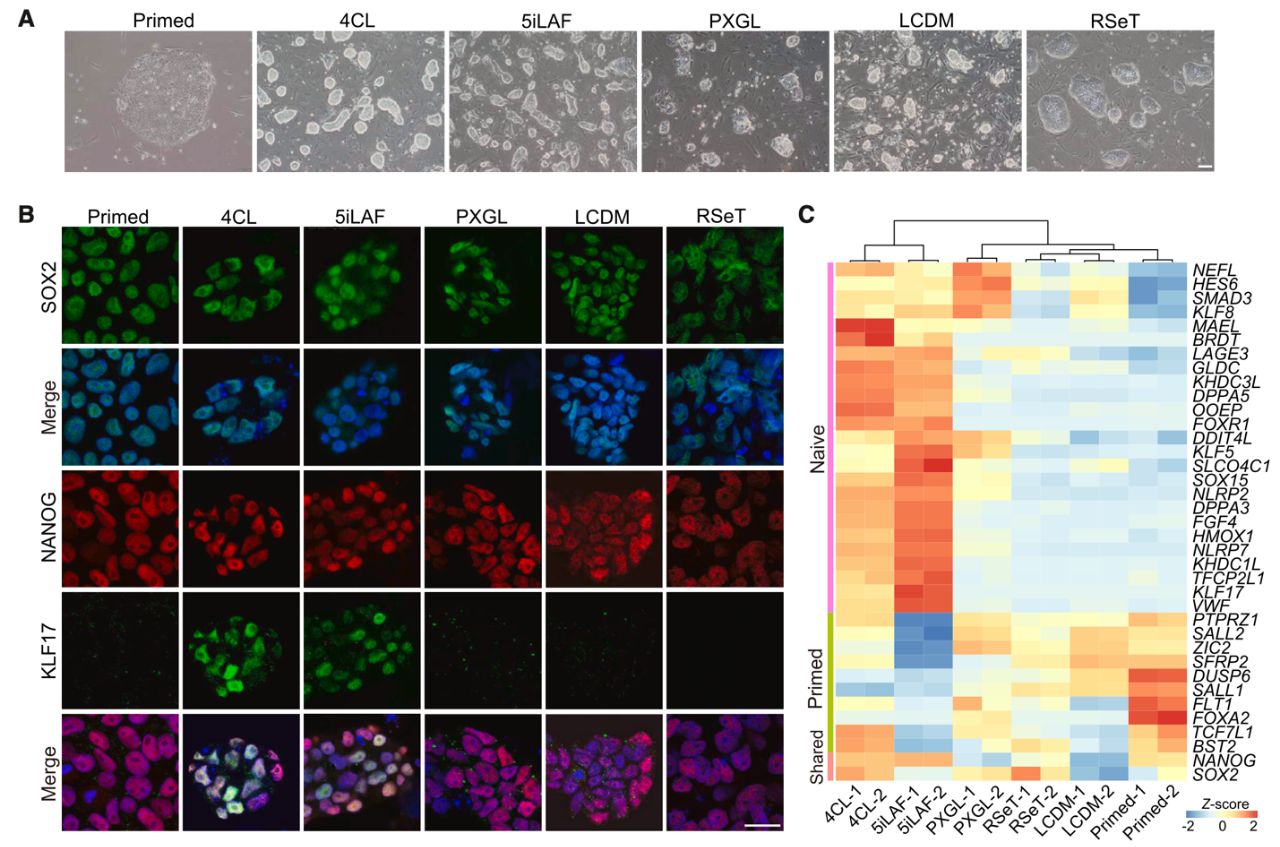
Рис. 1. Характеристика ЭСК макаки, культивированных на разных средах:
(A) Изображения ЭСК макаки, культивированных на испытываемых средах.
Масштабный отрезок 100 мкм.
(B) Иммуноцитохимическое выявление маркеров плюрипотентности:
наивной (KLF17) и общей (SOX2/NANOG) в ЭСК макаки,
культивированных на испытываемых средах. Масштабный отрезок 25
мкм.
(C) Тепловая карта, показывающая экспрессию генов плюрипотентности:
наивной, общей и праймированной в ЭСК макаки, культивированных на
испытываемых средах (n = 2).
В ходе дальнейшего исследования авторы использовали культуры наивных ЭСК, полученных в условиях 4CL. Важно отметить, что наивные ЭСК были получены из линий праймированных ЭСК, меченных с помощью GFP путём лентивирусной трасфекции. Учёные ввели приблизительно по 15 клеток наивных 4CL ЭСК в эмбрионы обезьян на стадии морулы. Для культивирования морул с инъецированными донорскими ЭСК исследователи пробовали использовать различные сочетания среды и времени культивирования: HECM9 – среда для культивирования эмбрионов обезьян – (72 часа), 4CL (72 часа), смесь 1:1 4CL и HECM9 (24 часа) и последующее культивирование в HECM9 (48 часов), смесь 1:1 4CL/HECM9 (72 часа), 2:1 4CL/HECM9 (72 часа). Культивирование морул в среде 4CL препятствует дифференцировке клеток в клетки трофоэктодермы и развитию бластоцисты, но способствует выживанию донорских ЭСК макаки. При культивировании морул в среде HECM9 удаётся получить бластоцисты, так как условия способствуют дифференцировке клеток, однако GFP-положительные клетки не выживают. В результате испытания перечисленных условий только культивирование морул в среде 1:1 4CL/HECM9 в течение 72 часов позволило достичь необходимого баланса между выжившими донорскими наивными ЭСК макаки, которые детектировались с помощью GFP-сигнала, и нормальным развитием бластоцист (Рис. 2).
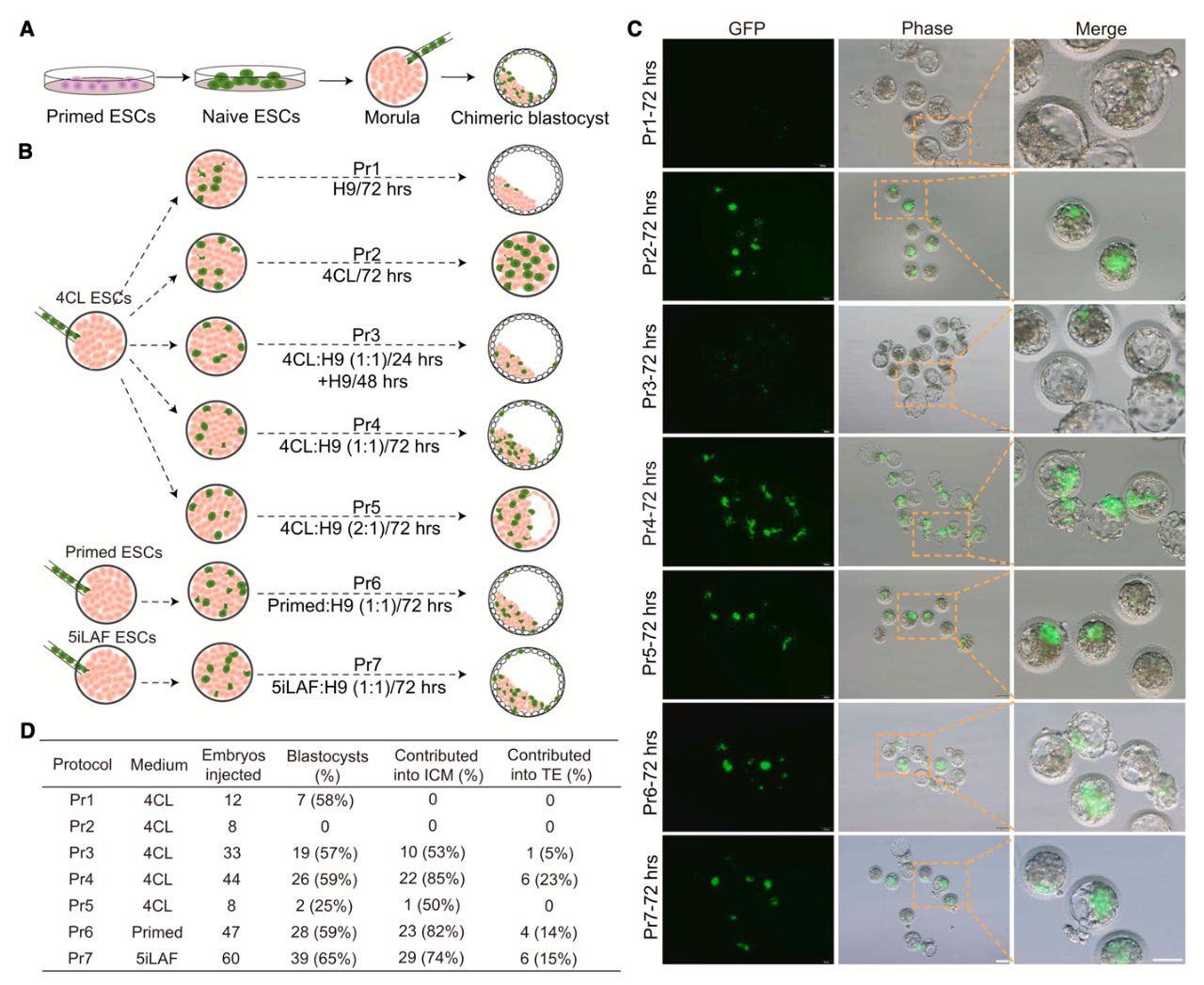
Рис. 2. Характеристика протоколов, использованных для получения химерных
бластоцист с применением культивируемых GFP-меченных ЭСК макаки:
(A) Схема процедуры получения химерной бластоцисты.
(B) Схема введения ЭСК макаки в морулу и дальнейшего культивирования
эмбриона с использованием указанных протоколов.
(С) Изображения, показывающие вклад меченных GFP ЭСК макаки в
реципиентные эмбрионы на стадии бластоцисты. Масштабный отрезок
100 мкм (ИЦХ и фазовый контраст) и 50 мкм (приближение).
(D) Данные по развитию бластоцист и сигналу GFP в эмбрионах в условиях
разных протоколов культивирования.
Исследователи предположили, что разработанный протокол in vitro культивирования эмбрионов макаки до стадии бластоцисты может быть ключевым фактором получения химер с высоким вкладом донорских клеток в реципиентном эмбрионе вне зависимости от состояния плюрипотентности донорских ЭСК. Далее исследователи заменяли 4CL на среды для культивирования праймированных ЭСК и поддержания наивных ЭСК (5iLAF) соответственно с целью оценки вклада донорских GFP- положительных ЭСК в развитие эмбриона. В результате уровень нормально развившихся бластоцист был схожим среди трёх исследованных вариантов эмбрионов макак. Более того, количество GFP-положительных бластоцист существенно не различалось между этими вариантами. Иммуноцитохимический анализ экспрессии OCT4 во всех исследованных модификациях бластоцист позволил выявить 22–48% GFP+/OCT4+ клеток, находящихся в составе ВКМ бластоцисты. Кроме того, 14–23% бластоцист проявляли GFP-сигнал в трофоэктодерме, что свидетельствует о вкладе донорских ЭСК как в зародышевые, так и во внезародышевые клеточные линии.
Для оценки способности полученных бластоцист с тремя вариантами инъецированных ЭСК: наивных (4CL, 5iLAF) и праймированных – к дальнейшему эмбриональному развитию использовали длительное культивирование in vitro. В результате во всех трех вариантах, так же, как и в случае контрольных бластоцист без введённых донорских ЭСК, большинство эмбрионов нормально адгезировали к подложке. У 39–45% исследованных эмбрионов среди всех четырёх групп бластоцист, включая контрольные, сформировался зародышевый диск, что свидетельствует о том, что введение донорских ЭСК не снижает эффективности развития in vitro. Сигнал GFP у эмбрионов с введёнными праймированными ЭСК усиливался медленно и оказался слабее спустя 17 дней после оплодотворения, чем сигнал, полученный в эмбрионах с введёнными ЭСК после культивирования на средах 4CL и 5iLAF, что говорит о более высокой выживаемости последних в составе эмбриона. Подсчёт клеток с флуоресцентным сигналом выявил 44% и 22% GFP+ клеток в эмбрионах с введёнными 4CL и 5iLAF ЭСК соответственно.
Методом секвенирования одиночных клеток химерных эмбрионов с последующим сравнением с имеющими данными по эмбриональному развитию зародышей обезьян циномолгус in vivo и в системах in vitro культивирования были выявлены 6 клеточных типов (клетки эпибласта, первичные половые клетки, клетки гаструлы, клетки висцеральной энтодермы и желточного мешка, клетки внезародышевой мезодермы и клетки трофоэктодермы). Распространение GFP-положительных клеток в этих 6 кластерах в химерных эмбрионах соответствовало таковому in vivo и in vitro развивающихся зародышах обезьян. Согласно результатам, полученным авторами, наивные ЭСК обезьян обладают большей способностью к эмбриональному развитию, чем праймированные ЭСК. Таким образом, состояние плюрипотентности донорских ЭСК является ключевым фактором получения химер макак с высоким вкладом донорских клеток в эмбрион. Авторы получили 206 морул с введёнными 4CL GFP-положительными донорскими наивными ЭСК (от 2 женских и 1 мужской линии). Из полученных морул 91 (44%) развились до стадии бластоцисты. Из них 74 бластоцисты (36% от исходного количества морул) с чётким GFP-сигналом были подсажены 40 суррогатным обезьянам (по 2 зародыша в обезьяну), и только 12 обезьян (30%) забеременели. В результате удалось получить 4 абортированных зародыша и 6 живых потомков (3% от исходных морул). Дальнейшее исследование учёные проводили на мужском абортированном зародыше и живорождённой обезьяне мужского пола. Стоит отметить, что все беременности, полученные в ходе исследования, обладали высоким уровнем выкидышей, даже в случае с контрольными GFP-отрицательными эмбрионами. Вероятно, среда для культивирования зародышей (1:1 4CL/HECM9) оказывает разрушающее воздействие на развивающийся эмбрион, хотя количество полученных бластоцист в этой среде было нормальным. Также возможно, что апоптоз введённых в морулу клеток может оказывать негативное влияние на ход эмбрионального развития. Полученный живой потомок обладал сильным GFP-сигналом по всему телу, включая пальцы, хвост и глаза, что говорит о значительном вкладе донорских клеток в состав химерного организма (Рис. 3). Родившаяся химерная обезьяна обладала значительными физиологическими нарушениями: дыхательная недостаточность и гипотермия, в связи с чем была проведена её эвтаназия для дальнейшего детального исследования.
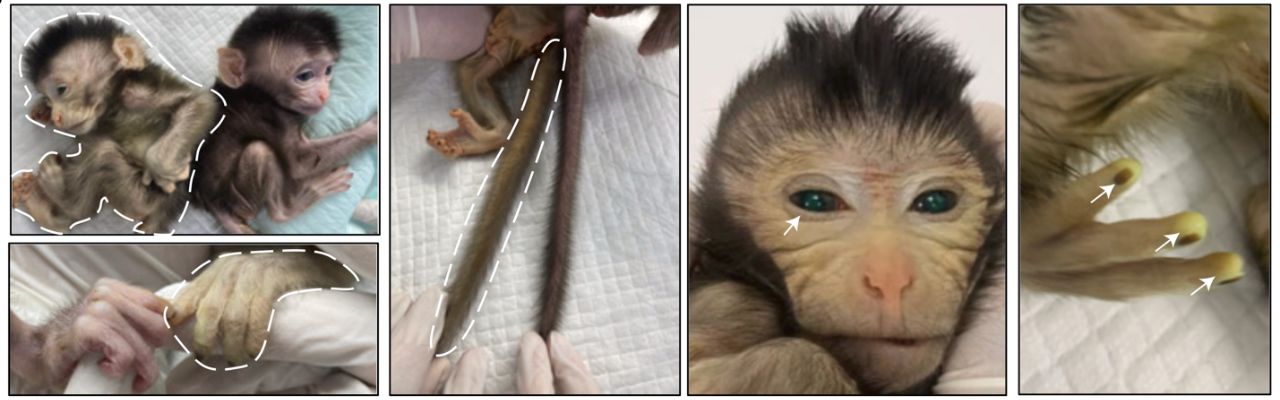
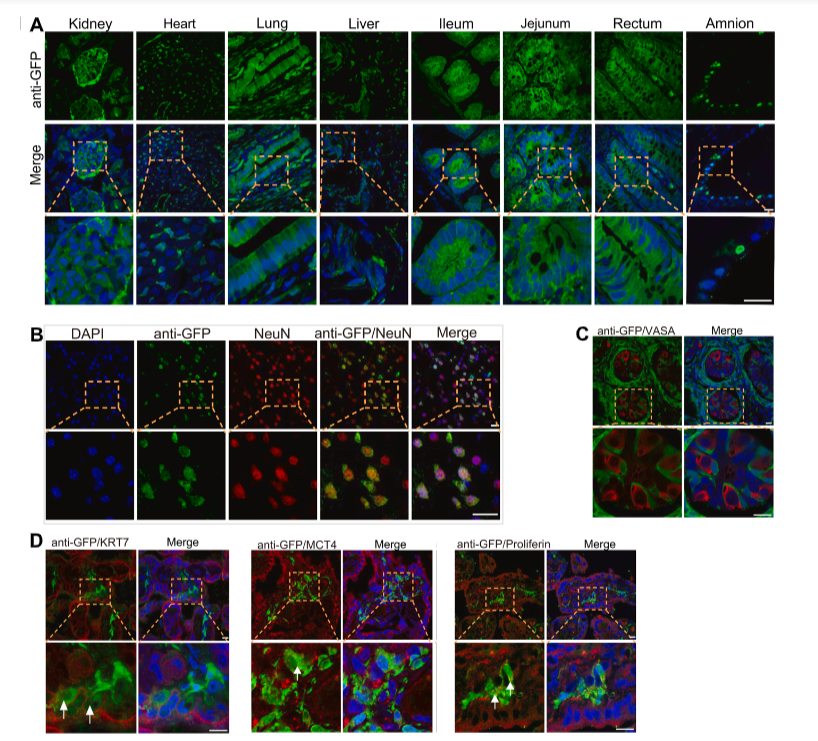
Рис. 3. Изображения, показывающие сигнал GFP в различных частях тела живорожденной химерной макаки в возрасте 3 дней.
Наиболее сильный сигнал GFP был выявлен в мононуклеарных клетках периферической крови и клетках костного мозга живорождённой макаки, в которых доля GFP-положительных клеток составила 88% и 78% соответственно. Кроме того, сигнал GFP был отмечен в 9 других тканях обезьяны (головном мозге, сердце, почках, печени, лёгких, тощей кишке, подвздошной кишке, прямой кишке и амнионе). С целью оценки вклада донорских ЭСК макаки в ткани семенников исследователи провели иммуноцитохимический анализ экспрессии VASA, маркера половых клеток. В результате доля GFP-положительных клеток среди всех клеток семенников и всех VASA-положительных клеток составила 58% и 62% соответственно, что подтверждает in vivo дифференцировку донорских ЭСК макаки в половые клетки. При исследовании вклада донорских ЭСК макаки в состав плаценты иммуноцитохимический анализ экспрессии маркеров клеток плаценты (KRT7, MCT4, PLF) позволила выявить коэкспрессию с GFP в 20% клеток. Таким образом, донорские наивные ЭСК вносили вклад во внезародышевые ткани (Рис. 4).
Рис. 4. Анализ вклада донорских ЭСК в различные ткани живорожденной
химерной макаки:
(A) Изображения, показывающие вклад меченных GFP ЭСК макаки в
исследованные ткани химерной макаки. Иммуноцитохимическое выявление
GFP+ клеток. Масштабный отрезок 25 мкм.
(B) Изображения, показывающие вклад меченных GFP ЭСК в нервную ткань
головного мозга химерной макаки. Иммуноцитохимический анализ экспрессии
NeuN использовался для выявления зрелых нейронов в головном мозге.
Масштабный отрезок 25 мкм.
(С) Изображения, показывающие вклад меченных GFP ЭСК в ткань
семенника химерной макаки. Иммуноцитохимическое выявление
GFP+/VASA+ клеток. Масштабный отрезок 25 мкм.
(D) Изображения, показывающие вклад меченных GFP ЭСК в плаценту
химерной макаки. Иммуноцитохимическое выявление коэкспрессии маркеров
клеток плаценты (KRT7, MCT4, PLF) с GFP. Масштабный отрезок 25 мкм.
Для выяснения причин малой эффективности получения химер макак было проведено исследование уровня метилирования ДНК и целостности генома клеток родившейся макаки. Авторы отвечают, что в костном мозге макаки уровни метилирования ДНК GFP-положительных клеток были выше таковых у GFP-негативных клеток (80% против 72% соответственно). Кариотипирование GFP-положительных клеток макаки выявило немного геномных аномалий в сравнении с GFP-негативными клетками, что свидетельствует о сохранении целостности генома донорских ЭСК в ходе эмбрионального развития. Кроме того, авторы отмечают, что исследованные GFP-положительные клетки макаки (клетки костного мозга и фибробласты из кончика уха) обладают меньшим числом геномных аномалий относительно исходных донорских ЭСК. Этот факт может свидетельствовать о происходящем в эмбрионе процессе селекции наиболее подходящих по своим свойствам для процесса эмбриогенеза донорских ЭСК.
Подводя итоги, авторы работы предлагают продолжить исследование получения химерных обезьян путём комплементации эмбрионов, а также сравнить этот подход с методом агрегации бластомеров, который приводит к более низким уровням потери беременности и получению в основном здоровых животных. Кроме того, не были исследованы механизмы, обеспечивающие выживание донорских ЭСК в реципиентном эмбрионе макаки. Также необходимо масштабное исследование более подходящих сред для культивирования химерных эмбрионов.
На основе анализа эффективности применения генетически модифицированных наивных эмбриональных стволовых клеток для получения химерных эмбрионов можно сделать вывод, что существующие технологии генетических модификаций и культивирования плюрипотентных клеток, а также культивирования морул до стадии бластоцисты все еще не позволяют избежать эпигенетических отклонений и мутаций как во вносимых в состав эмбриона клетках, так и в исходных клетках зародыша. Таким образом, технология требует дальнейшей оптимизации, а комплекс вышеупомянутых процедур можно помимо прочего рассматривать как продвинутый функциональный тест качества получаемых in vitro генетически модифицированных наивных плюрипотентных клеток. Другим интересным вопросом в свете представленной работы является возможность получения по данной технологии химер с использованием наивных индуцированных плюрипотентных стволовых клеток.
Новость подготовили
© В.Е.Дьяконова
© И.А.Чистопольский
27.11.2023