

©Абдыев Вепа Керимбердиевич, научный сотрудник лаборатории клеточной биологии ИБР РАН.
©Дашенкова Наталия Олеговна, кандидат биологических наук, младший научный сотрудник лаборатории проблем регенерации ИБР РАН.
Первичные половые клетки (ППК), или гоноциты, - это уникальный тип клеточных линий, который формируется на ранних стадиях эмбрионального развития и дает начало сперматозоидам и ооцитам. Ученым мало известно о раннем развитии человеческих ППК (чППК) из-за недоступности эмбрионов по этическим соображениям. Однако исследования в этой области могут расширить наши представления о процессах детерминации, дифференцировки зародышевых клеток, а также их генетической и эпигенетической регуляции.
За последнее десятилетие несколько коллективов сумели получить ППК мыши из индуцированных плюрипотентных стволовых клеток (ИПСК). Результатом исследований стали фертильные мышата, полученные из этих ППК (Morohaku et al., 2016; Zhou et al., 2016). Эти же протоколы успешно применили к ИПСК человека и получили чППК in vitro (Sasaki et al., 2015). Однако молекулярный и транскрипционный анализы показали, что механизмы получения чППК, а также действующие молекулы и сигнальные пути, отличаются от эксперимента с мышиными клетками (Irie et al., 2015; Sugawa et al., 2015). Успешное получение чППК in vitro не означает их способность к правильному гаметогенезу, поскольку in vivo это процесс контролируется сложными пространственно-временными процессами. Необходимо разработать комплексную систему, которая поможет эпигенетически репрограмировать и дифференцировать ИПСК человека в гоноциты in vitro.
Важную роль в развитии и дифференцировке стволовых клеток играет ниша. Учитывая это, Yamashiro C со своей командой (Yamashiro et al., 2018) создали модель ксеногенно восстановленных яичников: культивировали in vitro полученные человеческие ППК и соматические клетки яичника мышиного эмбриона. План по замене соматических клеток яичника человека на мышиные не сработал. Соматические клетки яичника мыши не смогли поддержать и обеспечить подходящие условия для мейотического деления человеческих ППК, полученных in vitro. Гаметогенез не наблюдался.
Учитывая исследования последних лет можно сказать, что существует острая необходимость в разработке специфических условий in vitro для воссоздания процесса образования чППК и мейоцитов.
К настоящему моменту нескольким группам исследователей удалось in vitro создать клетки, подобные первичным половым клеткам человека (Irie и др., 2015; Sugawa и др., 2015). Наша лаборатория занималась процессом дифференцировки индуцированных плюрипотентных стволовых клеток человека (чИПСК). Эти клетки были охарактеризованы как праймированные (эпибластные) чПСК. Сформированные из чПСК эмбриоидные тельца подвергались воздействию ативина А, что привело к формированию ранней мезодермы. Чтобы не нарушать трехмерную структуру, эмбриоидные тельца были коммитированы BMP4 к получению клеток, подобных чППК.
Чтобы индуцировать мейотическое деление, мы использовали ретиноевую кислоту (РК) - естественный индуктор мейоза в гонаде. В процессе культивирования эмбриоидные тельца превращались в самоорганизующиеся трехмерные сфероиды, в которых было показано, что в клетках появляется белки VASA (маркера поздних ППК) и белки STRA8 (маркера начала мейоза) (Рис 1), что указывает на созревание чППК под воздействием РК. Несмотря на точечную окраску белка SCP3 - маркера синаптонемного комплекса в гомологичной рекомбинации, - мы не обнаружили ранних синаптонемных комплексов (Рис. 1).
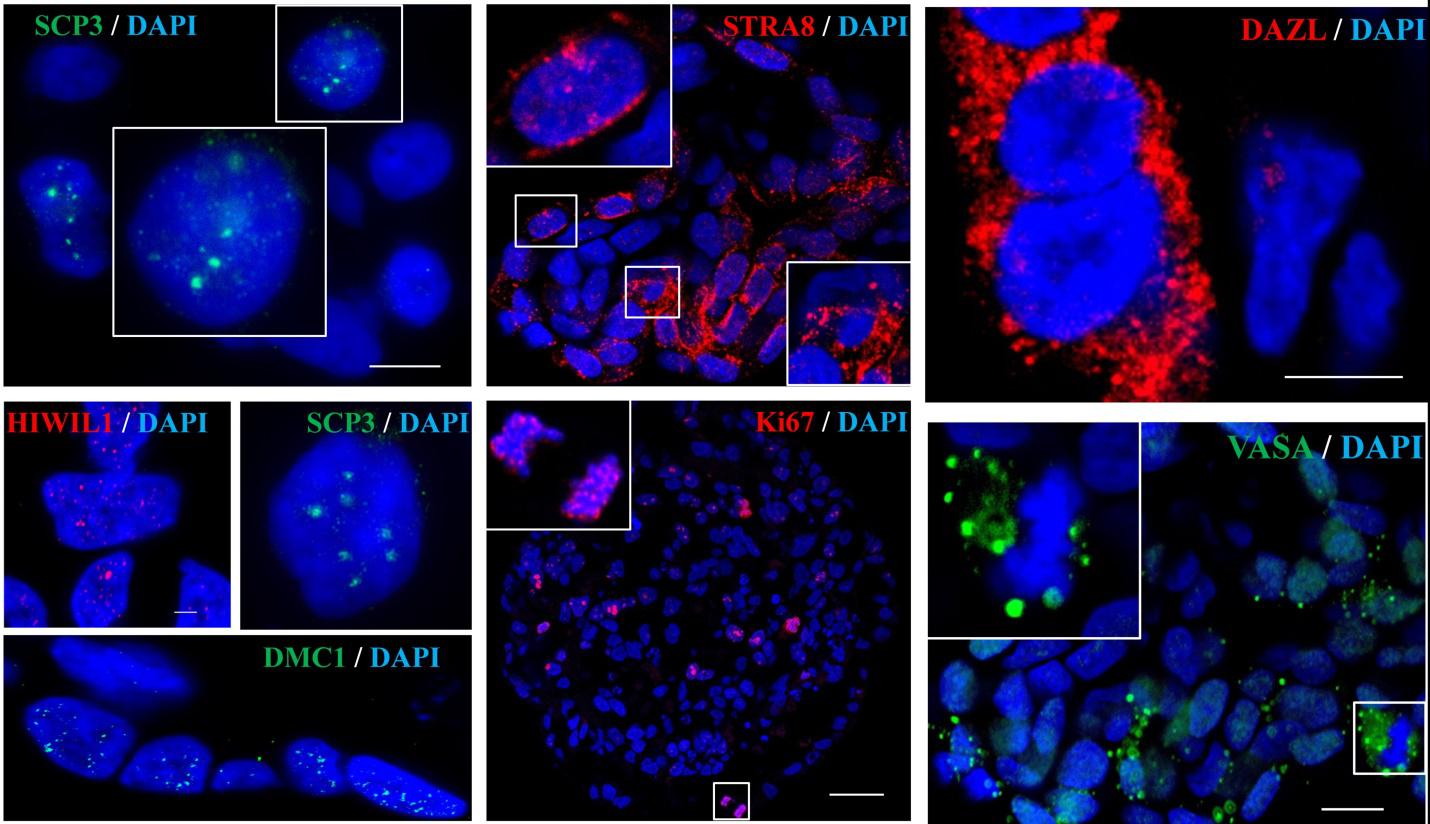 Рисунок 1. Иммунофлуоресцентное окрашивание 20-дневных РК-индуцированных чППК на белки DAZL, VASA, SCP3, STRA8, HIWIL1, DMC1. Полноразмерный сфероид показан на рисунке с Ki67-меченными пролиферирующими клетками. Шкала 10 мкм.
Рисунок 1. Иммунофлуоресцентное окрашивание 20-дневных РК-индуцированных чППК на белки DAZL, VASA, SCP3, STRA8, HIWIL1, DMC1. Полноразмерный сфероид показан на рисунке с Ki67-меченными пролиферирующими клетками. Шкала 10 мкм.
Транскриптомный анализ показал активацию генов RARA/B/G и CYP26B1, связанных с РК, и генов-маркеров мейоза (SCP2/3, REC8, MSX1/2, MAEL, DUSP18). Выявленные гены доказательно вовлечены в формирование яичников и семенников. Кластерный анализ наших данных с данными, представленными в открытом доступе группы ученых под руководством Yamashiro (Yamashiro et al., 2018), показал четко сформированные группы чППК и мейотических клеток.
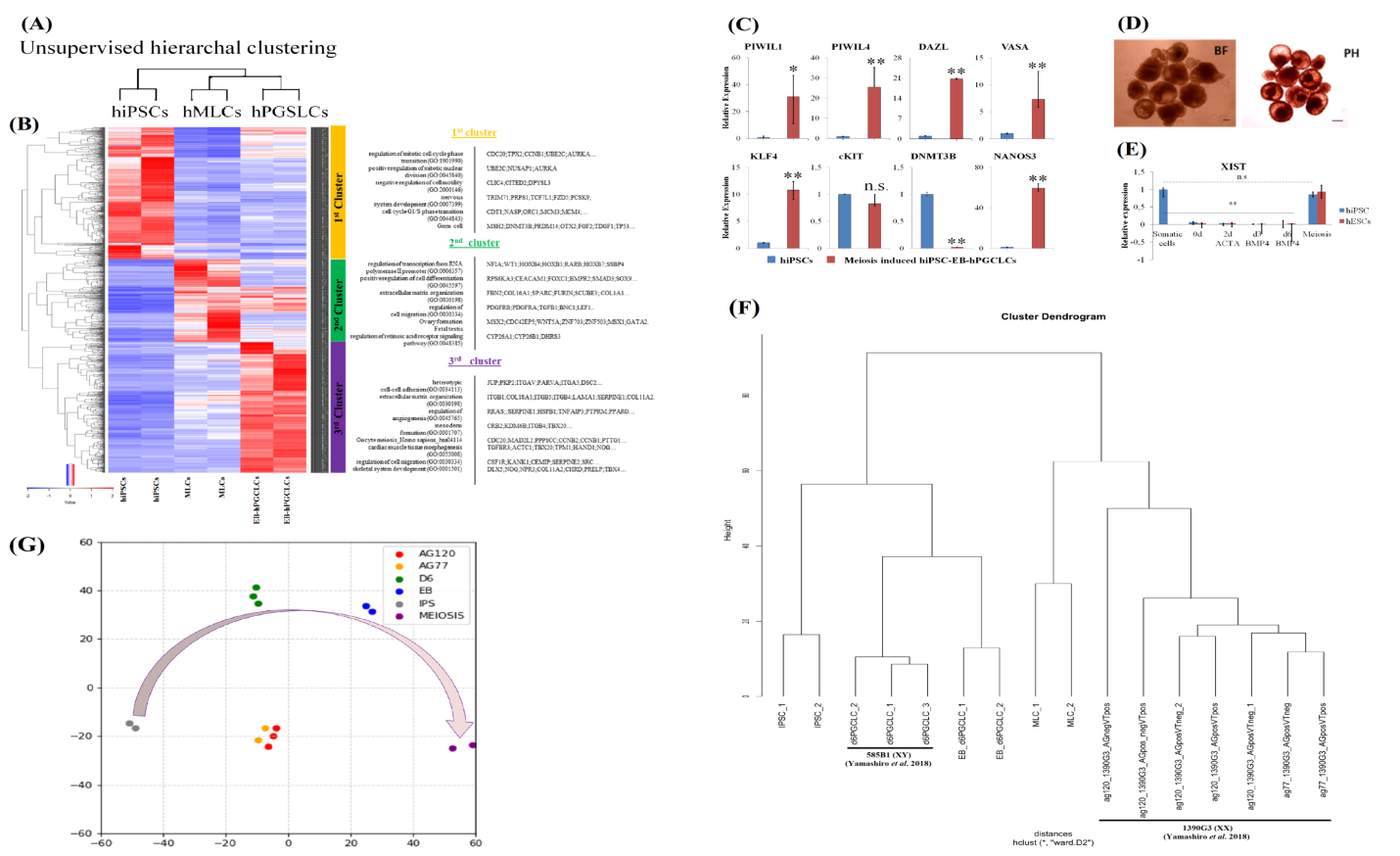 Рисунок 2. Индукция мейоза с помощью РК на клетках чППК, полученных in vitro. (A) Иерархическая кластеризация транскриптомов чИПСК, чППК, мейоцито-подобных клеток (МПК). (В) Тепловая карта чППК и индуцированных РК в течение 20 дней МПК и чИПСК. (C) Профиль экспрессии мРНК чИПСК и индуцированных РК в течение 20 дней чППК. (D) Изображения чППК, индуцированных РК в течение 20 дней. Светлое поле (слева), фазово-контрастное (справа). (E) Динамика экспрессии мРНК гена XIST в течение периода генерации чППК. (F) Иерархическая кластеризация транскриптомов чИПСК, чППК, МПК и клеток Yamashiro et al. d6hPGCLC (чППК), ag77 (МПК) и ag120(МПК), полученных из ксеногенных яичников. (G) Анализ главных компонентов (PCA) транскриптомов чИПСК, чППК, МПК и клеток Yamashiro et al. d6hPGCLC (чППК), ag77 (МПК) и ag120 (МПК), полученных из ксеногенных яичников.
Рисунок 2. Индукция мейоза с помощью РК на клетках чППК, полученных in vitro. (A) Иерархическая кластеризация транскриптомов чИПСК, чППК, мейоцито-подобных клеток (МПК). (В) Тепловая карта чППК и индуцированных РК в течение 20 дней МПК и чИПСК. (C) Профиль экспрессии мРНК чИПСК и индуцированных РК в течение 20 дней чППК. (D) Изображения чППК, индуцированных РК в течение 20 дней. Светлое поле (слева), фазово-контрастное (справа). (E) Динамика экспрессии мРНК гена XIST в течение периода генерации чППК. (F) Иерархическая кластеризация транскриптомов чИПСК, чППК, МПК и клеток Yamashiro et al. d6hPGCLC (чППК), ag77 (МПК) и ag120(МПК), полученных из ксеногенных яичников. (G) Анализ главных компонентов (PCA) транскриптомов чИПСК, чППК, МПК и клеток Yamashiro et al. d6hPGCLC (чППК), ag77 (МПК) и ag120 (МПК), полученных из ксеногенных яичников.
В нашем эксперименте почти 80% полученных клеток, подобных чППК, вступали в мейоз. Однако, данные клетки не могли завершить дифференцировку в трехмерных сфероидах, несмотря на наблюдаемые мейотические маркеры. Эти результаты указывают на невозможность чППК самостоятельно дифференцироваться в прогрессивные мейотические клетки без поддерживающих соматических клеток гонады.
Мы надеемся, что анализ транскриптомных и молекулярных данных послужит поводом для дальнейших исследований в области формирования чППК. Это особенно важно для пациентов с полным отсутствием ооцитов или сперматозоидов (Nelson 2009; Castillo et al. 1947). Разработанная нами модель развития чППК in vitro обеспечивает альтернативное решение для работы с человеческими половыми клетками in vitro, не затрагивая этические аспекты использования эмбрионов человека в научных исследованиях. Принимая во внимание рост проблемы бесплодия среди молодых пар (Mascarenhas et al. 2012), дальнейшие исследования развития чППК могут способствовать разработке новых методов вспомогательных репродуктивных технологий.
Воспроизводимость процесса развития in vitro ранних чППК-подобных клеток позволит изучить основные механизмы детерминации зародышевой судьбы, дифференциации, генетической и эпигенетической регуляции. Это особо важно в регенеративной и трансляционной медицине, а также в фундаментальных исследования о развитии половых клеток человека.
Следующий предполагаемый этап исследований - поиск клеток или альтернативных источников, которые смогут выступать в роли ниши для завершения мейоза чППК-подобных клеток.
Новость подготовили © Абдыев В.К. © Дашенкова Н.О.
27.11.2020