
© Людмила Алексеевна Захарова, Главный научный сотрудник. Доктор биологических наук, профессор.
Область научных интересов: клеточные и молекулярные механизмы нейроэндокринно-иммунных взаимодействий в онтогенезе.
Иммунные реакции, развивающиеся после инсульта, в зависимости от их силы вызывают как повреждение, так и восстановление ткани головного мозга. Эти различные функции отражаются в динамических транскриптомных сигнальных путях клеточных субпопуляций. Принцип разделения функций распространяется на клетки не только врожденного, но и адаптивного иммунитета и определяет их пространственное распределение и функцию во времени.
Внезапное нарушение проходимости (окклюзия) мозгового сосуда приводит к острому ишемическому повреждению тканей головного мозга с последующей немедленной активацией локальной иммунной системы мозга и быстрой мобилизацией клеток системного иммунитета с периферии. Первоначально активированные клетки врожденного иммунитета ограничивают повреждение головного мозга от разрушенных клеток и нейтрализуют нейротоксины. В то же время продукты, выделяемые из сверх активированных клеток иммунной системы, могут привести к увеличению травмы.
Клетки адаптивного иммунитета, в частности, субпопуляции регуляторных лимфоцитов, инфильтрирующих ишемический мозг, Т-клетки CD4CD25 фенотипа (CD4Тreg) и интерлейкин (ИЛ)-10-положительные В-клетки, способствуют восстановлению тканей мозга после инсульта и модулируют эндогенные защитные реакции на травму. Однако CD4Тreg выявляют в мозге после инсульта только на 5-ый день.
Исследователи из Питтсбургского университета (США) обнаружили в крови мышей уникальную субпопуляцию Т-лимфоцитов СD8+CD122+CD49dlo фенотипа, подобную CD4Тreg клеткам (CD8TRL - T regulatory-like cells). Авторы отмечают, что их исследование является первым, демонстрирующим функцию CD8TRL в модели инсульта у мыши. Считается, что у человека те же функции, что и мышиные TRL, выполняют Т-клетки CD8CXCR3(CD183) фенотипа. Уникальность и универсальность CD8TRL заключается в том, что они «служат клеточными часовыми раннего повреждения тканей, а также сторожем защитных реакций». Миграция TRL-клеток в пораженный участок мозга наблюдается уже в первые сутки инсульта и их численность в мозге остается повышенной около 2-х недель. При этом, в периферической крови и селезенке число этих клеток уменьшается в 3-4 раза. Селективное истощение циркулирующих CD8TRL приводит к двукратному увеличению объема ишемического инфаркта и усилению сенсомоторного дефицита в 2-3 раза в мышиной модели инсульта независимо от статуса CD4Трег в ранней фазе травмы. В то же время их постинсультный внутривенный перенос приводит к снижению инфаркта, способствуя долгосрочному неврологическому восстановлению у молодых и старых мышей обоих полов.
Первоначально TRL-клетки были признаны антиген-специфическими Т-клетками памяти. Однако новые данные доказывают, что они выполняют регуляторные функции и отличаются от клеток памяти низкой экспрессией CD49d антигена и высокой экспрессией антигенов запрограммированной клеточной гибели. Их основная функция связана с подавлением пролиферации и провоспалительными эффектами других клеток иммунной системы, особенно эффекторных Т лимфоцитов, а также с поддержанием иммунного гомеостаза. По сравнению с CD4Трег, регуляторные CD8TRL проявляют более сильную иммуносупрессивную активность. Они могут обеспечивать быструю антиген-неспецифическую иммунорегуляцию через прямой межклеточный контакт и/или высвобождая защитные/иммуномодулирующие факторы в тканях мозга, в том числе эпидермальный фактор роста, подобный трансформирующему фактору роста (ETGF), ИЛ-10, а также за счет активации рецептора к лейкемия ингибирующему фактору (ЛИФ). В частности, авторами было показано, что ИЛ-10 и EТGF совместно оказывают нейропротекторное действие, в то время как ИЛ-10 играет важную роль в иммунорегуляции и смягчении постинсультного воспаления, ETGF напрямую защищает ишемизированные нейроны.
Ранняя миграция CD8TRL в мозг осуществляется в результате активации хемокинового рецептора CXCR3 и его лиганда CXCL10 (C-X-C motif chemokine 10, названный также IP-10). Авторы показали, что TRL-клетки экспрессируют более высокий уровень этого рецептора по сравнению с CD4Трег. Его экспрессия на CD8TRL имеет решающее значение для быстрой инфильтрации мозга при инсульте. Нокаут или отсутствие CXCR3/CXCL10 в очагах инсульта нарушает инфильтрацию мозга CD8TRL и препятствует их нейропротекторным свойствам.
Как предполагают авторы, это открытие может стать основой для создания потенциально новой клеточной терапии при инсульте, от которого ежегодно страдают не менее 15 млн человек во всем мире.
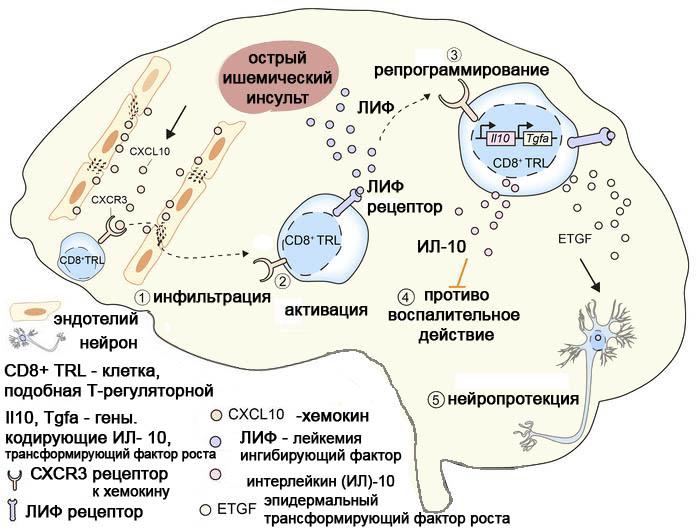
Рис. 1.
Функции и механизмы действия новой CD8TRL (T regulatory-like cells) субпопуляции Т лимфоцитов, подобной регуляторным Т лимфоцитам CD4CD25 фенотипа, на клетки мозга при остром ишемическом инсульте.
Новость представила ©Захарова Л.А.
27.09.2022