Комментарий к статье: Witt, Evan et al. “Transcriptional and mutational signatures of the Drosophila ageing germline.” Nature ecology & evolution vol. 7,3 (2023): 440-449. doi:10.1038/s41559-022-01958-x
Аннотация
Для сперматогенеза показано значительное увеличение мутационной нагрузки с возрастом. Подобное явление сильно влияет на здоровье потомства и течение эволюции, однако его механизм все еще не ясен. В недавней работе авторы предприняли инновационный подход и сосредоточились на изучении динамики мутагенеза в половой линии старых и молодых самцов Drosophila melanogaster. Было установлено, что у молодых самцов наибольшее число мутаций встречается в недифференцированных половых клетках, при этом в ходе дифференцировки число мутаций сокращается. У старых самцов напротив, содержание нуклеотидных замен практически не падает в ходе сперматогенеза, а на некоторых этапах - возрастает, что говорит о нарушении систем репарации ДНК. Интересно, что для старых и молодых половых клеток показаны разные закономерности в нуклеотидных заменах, а доля несинонимичных замен больше у молодых самцов. Подобные результаты позволяют по-новому взглянуть на мутагенез половой линии и углубиться в понимании его механизмов.
Введение
Известно, что у пожилых родителей возрастает вероятность рождения больного потомства. У этого явления несколько причин, однако основной вклад в формирование новых мутаций вносит старение половой системы. С возрастом гонады начинают “пропускать” больше мутировавших гамет, что вносит значительный вклад в развитие болезней человека и одновременно влияет на течение эволюции. Интересно, что у мужчин, особенно пожилых, число мутаций в половых клетках значительно выше, чем у женщин, но причины данного явления остаются неясными (Gao et al., 2016; Gao et al., 2019). Одним из объяснений может служить большее число митотических делений сперматогониальных стволовых клеток в течении жизни мужчины (Crow, 2000) (Рис. 1).
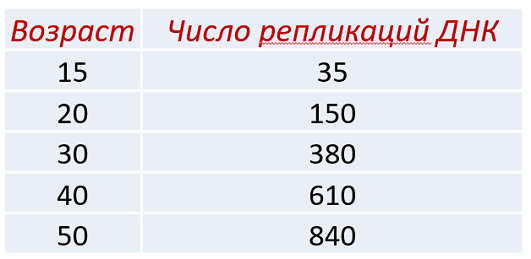
Рис. 1. Число митотических делений мужских гамет в течении жизни (Crow, 2000).
В то время как у мужчин новые сперматозоиды непрерывно формируются за счет работы ниши сперматогониальных стволовых клеток, у женщин основной запас будущих яйцеклеток формируется еще в ходе эмбрионального развития (Рис. 2). Однако подобное объяснение игнорирует сложность биологии гамет, кроме того, в ряде работ отмечается несоответствие между числом делений и числом мутаций в мужских и женских половых клетках (Huttley et al., 2000). Другим объяснением может служить нарушение репарации ДНК, дифференциальное метилирование ДНК или различия в структуре хроматина. Изучение механизмов ускоренного мутагенеза в мужской половой линии стало целью обозреваемой работы “Transcriptional and mutational signatures of the Drosophila ageing germline”.
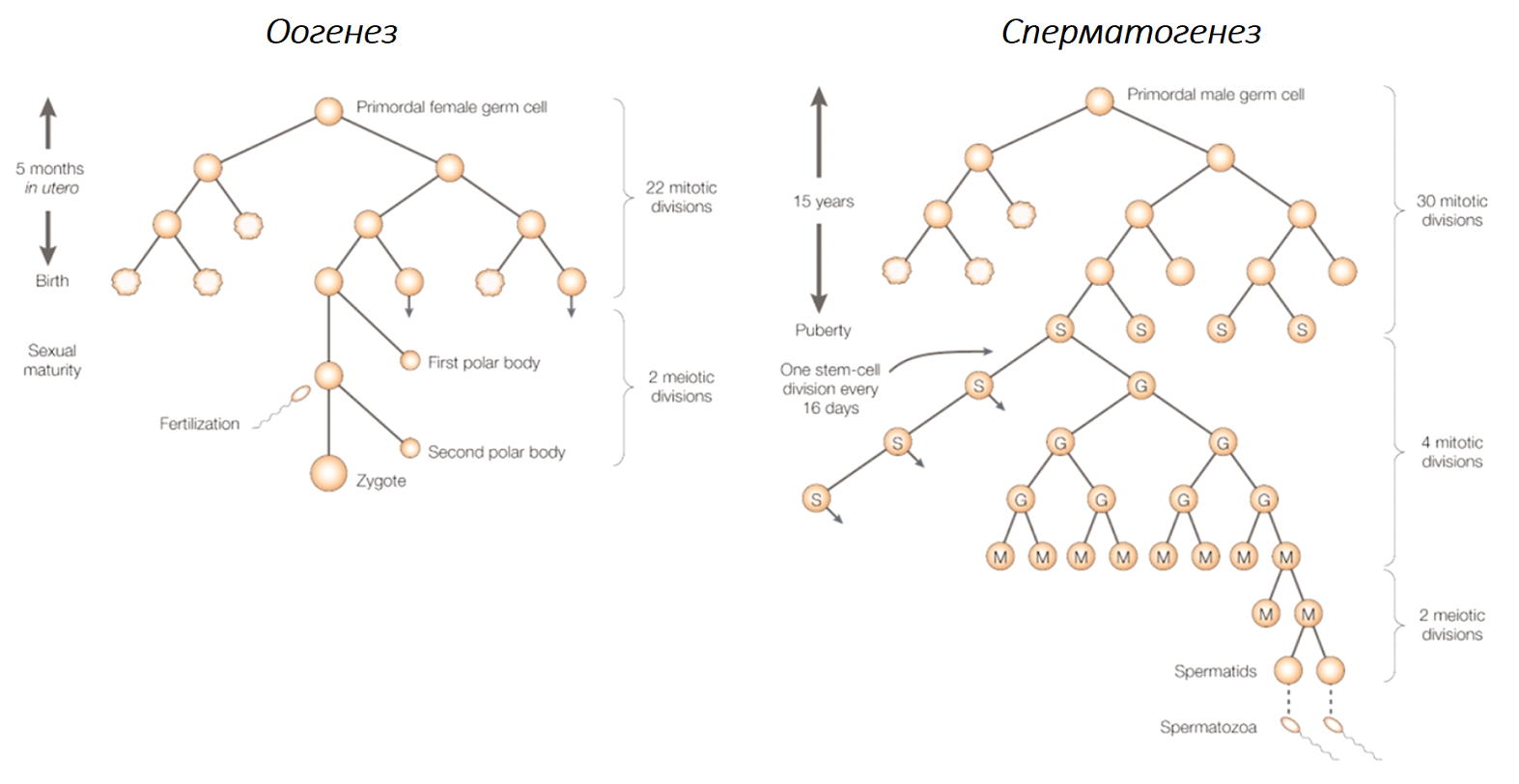
Рис. 2. Особенности гаметогенеза у мужчин и женщин (Crow, 2000)
В предыдущих исследованиях влияние возраста на формирование de novo мутаций, наследуемых по отцовской линии, определяли путем секвенирования ДНК родителей и потомства. Метод оказался крайне эффективным, однако он учитывает только мутации, проявившиеся в потомстве, т. е. прошедшие механизмы репарации и не помешавшие произойти оплодотворению (Witt et al., 2023). Однако, о динамике накопления мутаций и их восстановления в линии половых клеток известно мало, хотя исследования в этой области могли бы пролить свет на механизмы повышенного мутагенеза в мужской половой линии (Witt et al., 2023).
Недавнее исследование, основываясь на методе одноклеточного РНК секвенирования (scRNA seq), позволяет детальнее разобраться непосредственно в динамике мутагенеза мужской половой линии и понять роль старения в данном процессе (Witt et al., 2023). В предыдущей работе авторы методом scRNA секвенирования ткани семенника показали, что наибольшее число мутаций встречается в наименее дифференцированных половых клетках, при этом число мутаций резко сокращается по ходу дифференцировки (Рис. 3). Объяснением может служить активная репарация ДНК при дифференцировке гамет. С этой идеей согласуются и результаты анализа секвенирования, авторы обнаружили, что некоторые гены поддержания генома выше экспрессируются в ранних сперматогониях (Xia et al., 2020). Продолжая данное направление авторы решили детальнее изучить влияние старения на мутационную нагрузку гамет, для чего было произведено сравнение данных scRNA секвенирования гонад молодых и старых самцов.
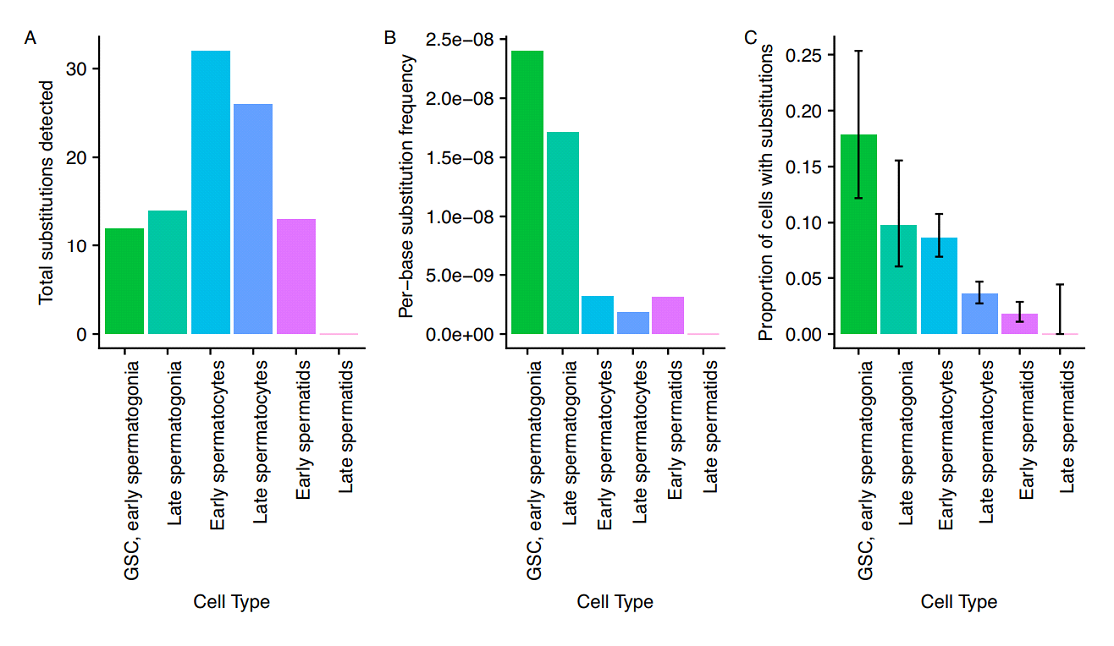
Рис. 3. Число de novo мутаций в разных популяциях половых клеток. A - число замен в каждом типе клеток. B - относительная частота замен для каждого типа клеток, отношение числа полиморфизмов в типе клеток на число клеток этого типа и число оснований. C - доля клеток каждого типа с хотя бы одной выявленной мутацией (Witt et al., 2019).
Роль старения в ускоренном мутагенезе мужской половой линии
Для анализа были отобраны семенники 2-х и 25-ти дневных самцов Drosophila melanogaster и получены данные scRNA секвенирования половых клеток на разных этапах дифференцировки. Для того, чтобы было возможно распознать de novo мутации в гаметах, дополнительно проводили секвенирование геномной ДНК каждого самца и сравнивали с данными scRNA секвенирования каждой половой клетки (Рис. 4).
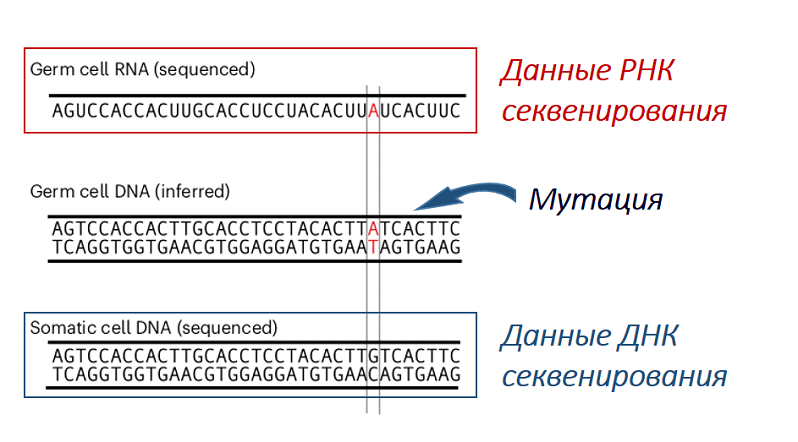
Рис. 4. Обнаружение мутаций в половых клетках
Полученные результаты подтверждают предыдущее наблюдение о том, что число мутаций сокращается с ходом дифференцировки половой линии, однако у старых мух эта тенденция выражена слабее, и число мутаций остается высоким даже на поздних стадиях сперматогенеза. Более того, на протяжении всего сперматогенеза у старых самцов наблюдается увеличенное число мутаций на молекулу РНК в половых клетках по сравнению с молодыми (Рис. 5).
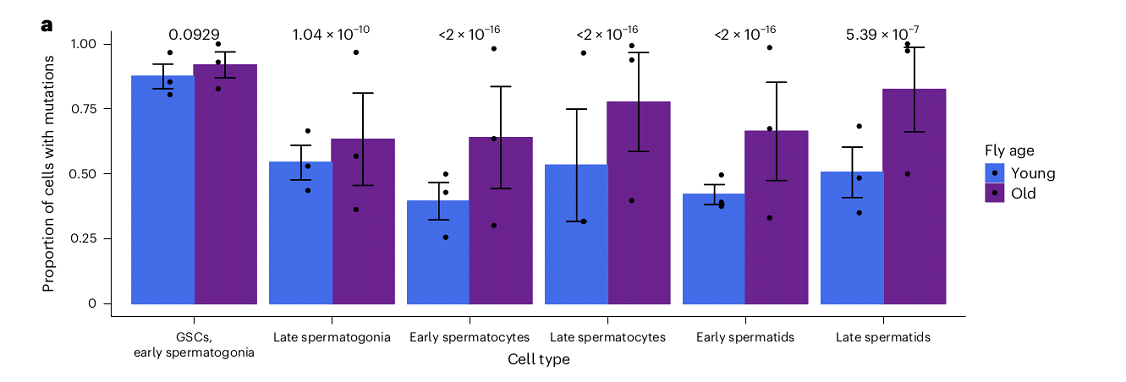
Рис. 5. Динамика числа мутаций в мужской половой линии молодых и старых самцов
Таким образом, половая линия старых мух хуже способна удалять мутации de novo по сравнению с молодыми. Это открытие дает новое понимание все еще спорному механизму увеличения мутационной нагрузки мужской половой линии в зависимости от возраста. Так, отсутствие различий в мутационной нагрузке ранних сперматогоний/ССК подтверждает идею о том, что многие возрастные мутации не связаны с репликативными процессами. При этом у старых мух в дифференцированных гонадах наблюдается даже большее число мутаций, чем в поздних сперматогониях, показывая, что некоторые мутации могут также накапливаться в процессе сперматогенеза. Авторы делают вывод, что это может быть вызвано изменением активности путей репарации ДНК в половой линии старых мух.
Паттерны мутаций половой линии молодых и старых самцов
В дополнение к повышенному уровню мутаций старые мухи проявляют отличные от молодых паттерны нуклеотидных замен. Так гаметы старых мух несут более высокую долю замен C>G, C>A и более низкую - C>T. Эти измененные соотношения SNPs могут быть вызваны дифференциальной активностью путей репарации ДНК в старой половой линии. И хоть исследователи не нашли строгих доказательств глобального снижения активности генов поддержания генома, т. е. генов отвечающих за репарацию ДНК, сенесценцию и апоптоз, у старых мух наблюдается пониженная экспрессия некоторых ключевых генов транскрипции. Возможно, молекулярный механизм, способствующий мутационной предвзятости в половых клетках связан с изменением активности транскрипционно-связанной репарации (Hanawalt, Spivak, 2008). Активная транскрипция в семенниках способствует восстановлению ДНК половой линии и, в конечном счете, модулирует скорость эволюции генов (Рис. 6) (Xia et al., 2020). Данная идея подтверждается тем фактом, что масштабная экспрессия всех генов обычно снижена в ранних сперматогониях, но повышена в поздних сперматидах, что согласуется с динамикой мутационной нагрузки в ходе дифференцировки гамет (Рис. 5). Стоит отметить, что гены с большим количеством обнаруживаемых SNP имеют тенденцию быть низко экспрессированными в разных репликах, что вновь согласуется с вышесказанным предположением. Таким образом, повышенная мутационная нагрузка в половой линии пожилых самцов может быть частично связана с нарушением транскрипционно-связанной репарации (Deger et al., 2019).
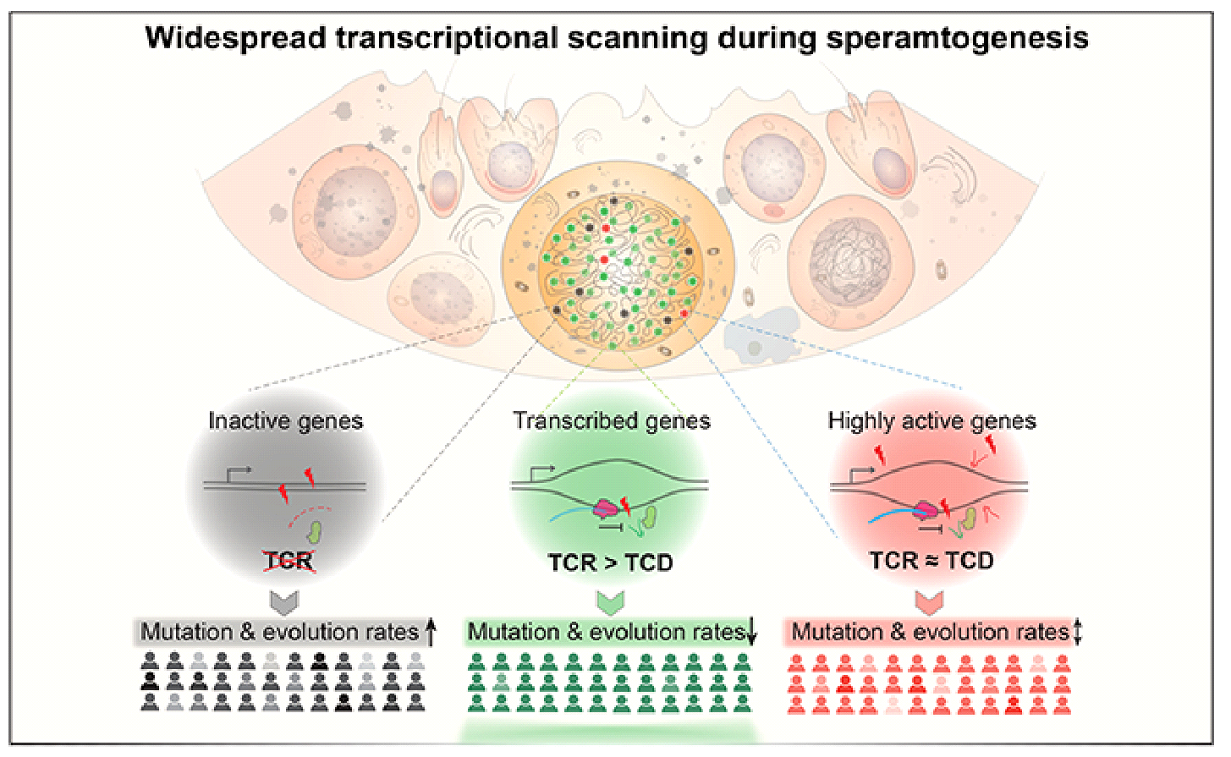
Рис. 6. Принципиальная схема модели транскрипционного сканирования. Модель предполагает, что обширная транскрипция во время сперматогенеза облегчает процесс “сканирования” ДНК, благодаря которому детектируются и восстанавливаются повреждения ДНК при помощи механизмов транскрипционно-связанной репарации (зеленый рисунок). Гены с низкой экспрессией не "выигрывают" от транскрипционного сканирования и быстрее накапливают мутации (серый рисунок), а повреждения, связанные с активной транскрипцией, по-видимому, нивелируют эффект транскрипционного сканирования в небольшом подмножестве высоко экспрессируемых генов (красный рисунок). TCR — транскрипционно-связанная репарация. TCD — повреждения, связанные с транскрипцией (Xia et al., 2020).
Зависимость числа несинонимичных замен в половой линии от возраста
Обнаружено, что гены, выше экспрессирующиеся в дифференцированных половых клетках, имеют больше несинонимичных замен, чем гены, в ранних половых клетках, как у молодых, так и у старых мух (Рис. 7). Этот результат позволяет предположить, что сперматоциты и сперматиды являются источниками быстрой эволюции. Неожиданно, что у молодых мух этот эффект выражен сильнее чем у старых. Важность данных результатов заключается в том, что ранее считалось, что гены, экспрессирующиеся в старости, чаще фиксируют несинонимичные мутации (Cheng, Kirkpatrick, 2021). Однако эти исследования основываются на секвенировании соматических клеток, в то время как в текущей работе упор сделан на половые.
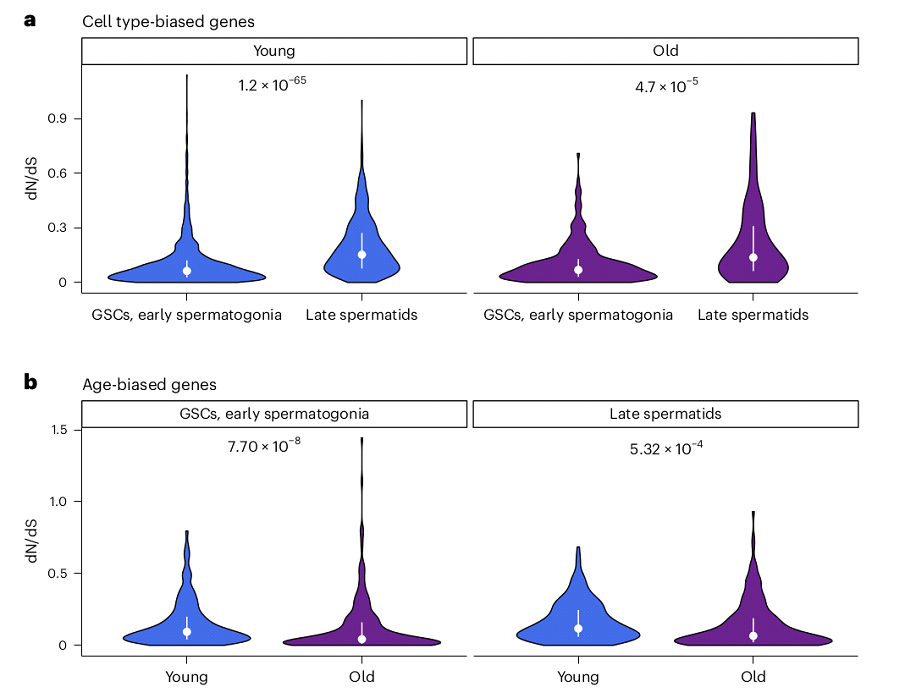
Рис. 7. Отношение числа несинонимичных и синонимичных замен в течении сперматогенеза у молодых и старых самцов.
Заключение
Представленный в данной работе подход к изучению старения мужской половой линии, основанный на современных методах секвенирования, позволил пролить свет на новые механизмы и закономерности данного процесса. Отойдя от изучения данной тематики путем сравнения геномов родителей и потомства, исследователи непосредственно сосредоточились на клетках половой линии молодых и старых самцов. Подобный подход позволил установить динамику мутагенеза гамет в ходе дифференцировки и детектировать основные ее изменения, связанные со старением.
Так авторы обнаружили, что ранние половые клетки старых и молодых мух вступают в сперматогенез с одинаковым мутационным грузом, но старые мухи хуже удаляют мутации во время сперматогенеза. Мутации в половых клетках старых самцов также могут образовываться в процессе сперматогенеза, при этом старые и молодые мухи имеют различные мутационные паттерны. Показана роль поздних стадий сперматогенеза в формировании эволюционных изменений. Удивительно, что гены, в молодых половых клетках, демонстрируют более высокую долю несинонимичных замен, чем гены, в старых половых клетках. Таким образом, полученные результаты дают новое представление о роли зародышевой линии в мутациях de novo.
Список литературы
1. Haldane JB. The rate of spontaneous mutation of a human gene. 1935. J Genet. 2004;83(3):235-244. doi:10.1007/BF02717892
2. Crow JF. The origins, patterns and implications of human spontaneous mutation. Nat Rev Genet. 2000;1(1):40-47. doi:10.1038/35049558
3. Huttley GA, Jakobsen IB, Wilson SR, Easteal S. How important is DNA replication for mutagenesis?. Mol Biol Evol. 2000;17(6):929-937. doi:10.1093/oxfordjournals.molbev.a026373
4. Witt E, Langer CB, Svetec N, Zhao L. Transcriptional and mutational signatures of the Drosophila ageing germline. Nat Ecol Evol. 2023;7(3):440-449. doi:10.1038/s41559-022-01958-x
5. Parisi M, Nuttall R, Edwards P, Minor J, Naiman D, Lü J, Doctolero M, Vainer M, Chan C, Malley J, Eastman S, Oliver B. A survey of ovary-, testis-, and soma-biased gene expression in Drosophila melanogaster adults. Genome Biology. 2004;5:R40. doi: 10.1186/gb-2004-5-6-r40.
6. Witt, E., Benjamin, S., Svetec, N., & Zhao, L. (2019). Testis single-cell RNA-seq reveals the dynamics of de novo gene transcription and germline mutational bias in Drosophila. eLife, 8, e47138. https://doi.org/10.7554/eLife.47138
7. Neme, R., & Tautz, D. (2016). Fast turnover of genome transcription across evolutionary time exposes entire non-coding DNA to de novo gene emergence. eLife, 5, e09977. https://doi.org/10.7554/eLife.09977
8. Cheng C, Kirkpatrick M. Molecular evolution and the decline of purifying selection with age. Nat Commun. 2021;12(1):2657. Published 2021 May 11. doi:10.1038/s41467-021-22981-9
9. Gao Z, Moorjani P, Sasani TA, et al. Overlooked roles of DNA damage and maternal age in generating human germline mutations. Proc Natl Acad Sci U S A. 2019;116(19):9491-9500. doi:10.1073/pnas.1901259116
10. Gao Z, Wyman MJ, Sella G, Przeworski M. Interpreting the Dependence of Mutation Rates on Age and Time. PLoS Biol. 2016;14(1):e1002355. Published 2016 Jan 13. doi:10.1371/journal.pbio.1002355Xia, B. et al. Widespread transcriptional scanning in testes modulates gene evolution rates. Cell 180, 248–262 (2020).
11. Deger N, Yang Y, Lindsey-Boltz LA, Sancar A, Selby CP. Drosophila, which lacks canonical transcription-coupled repair proteins, performs transcription-coupled repair. J Biol Chem. 2019;294(48):18092-18098. doi:10.1074/jbc.AC119.011448
12. Xia B, Yan Y, Baron M, et al. Widespread Transcriptional Scanning in the Testis Modulates Gene Evolution Rates. Cell. 2020;180(2):248-262.e21. doi:10.1016/j.cell.2019.12.015
13. Hanawalt PC, Spivak G. Transcription-coupled DNA repair: two decades of progress and surprises. Nat Rev Mol Cell Biol. 2008;9(12):958-970. doi:10.1038/nrm2549
Новость подготовил
© Мун В.В.
27.06.2023
 ©
©