Liu, X., Tan, J.P., Schröder, J. et al. Modelling human blastocysts by reprogramming fibroblasts into iBlastoids. Nature 591, 627–632 (2021). https://doi.org/10.1038/s41586-021-03372-y
Yu, L., Wei, Y., Duan, J. et al. Blastocyst-like structures generated from human pluripotent stem cells. Nature 591, 620–626 (2021). https://doi.org/10.1038/s41586-021-03356-y
 © Алёшина Нина Максимовна, аспирант ИБР РАН, старший лаборант лаборатории проблем регенерации.
© Алёшина Нина Максимовна, аспирант ИБР РАН, старший лаборант лаборатории проблем регенерации.Область научных интересов: оо- и фолликулогенез, раннее развитие млекопитающих, а также роль трансмиттеров в этих процессах.
До недавнего времени единственной возможностью для изучения процессов раннего развития эмбрионов человека in vitro являлось использование эмбрионов, полученных при экстракорпоральном оплодотворении. Однако, использование человеческих бластоцист вызывает большое количество этических, правовых вопросов, а также эти исследования трудно реализовать технически вследствие малой доступности материала. Изучение гаструляции человека также ограничено «правилом 14 дней» (14-day rule) – запретом на in vitro культивирование эмбрионов дольше этого срока. Появление технологий, благодаря которым становится возможным создание модели человеческой бластоцисты из культуры соматических клеток, открывает для исследователей новые горизонты. И если исследователи уже научились получать аналог бластоцисты мыши, бластоид, в лабораторных условиях, то попытки воссоздать эмбрион человека до недавнего времени оставались безуспешными. В двух публикациях в журнале Nature, в основу которых легла работа команды ученых во главе с Жозе Поло (Университет Монаш, Австралия), описана первая модель бластоцисты человека, названная авторами «iBlastoid», которую удалось создать из клеток кожи взрослого организма.
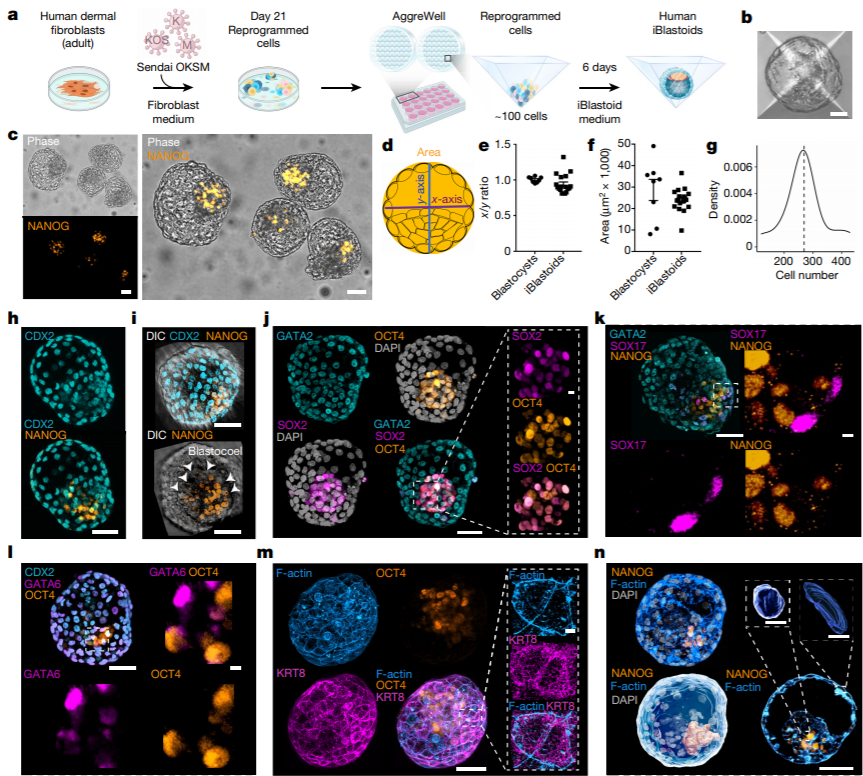
Для создания iBlastoid исследовательская группа использовала метод репрограммирования фибробластов, полученных из кожи человека при помощи факторов «коктейля Яманаки» (OCT4, KLF4, SOX2 и c-MYC). К 21-ому дню культивирования в популяции можно было обнаружить клетки, генетически идентичные клеткам эпибласта, трофэктодермы и гипобласта бластоцисты. Затем клетки перемещали в специальный планшет для 3D-культивирования, AggreWell (Рис. 1), где они формировали трехмерные структуры. К шестому дню культивирования в AggreWell до 18% из этих структур (с этого момента авторы называют их «iBlastoid») образовывали полости, как при процессе кавитации в бластоцисте, и кластер клеток, подобный внутренней клеточной массе (ВКМ). Полученные бластоиды человека имели размер и форму, схожую с реальными бластоцистами на 5-7 день развития, а также имели в составе сходное общее число клеток. При иммуногистохимическом анализе в ВКМ-подобном кластере и клетках, окружающих полость, наблюдалась экспрессия маркеров клеток эпибласта (NANOG, OCT4, SOX2) и трофэктодермы (CDX2, GATA2, GATA3) соответственно. Внутри ВКМ-подобного кластера выделялись клетки, экспрессирующие маркер гипобласта (SOX17).
Схожесть с клетками бластоцисты продемонстрировал также анализ методом транскриптомики одиночных клеток. Форма и количественные пропорции клеток, входящих в состав «эпибласта», «гипобласта» и «трофобласта», составляющих iBlastoid, соответствовало таковому у бластоцисты человека. Клетки, полученные из iBlastoid, также имели способность генерировать различные линии стволовых клеток.
В своем исследовании авторы также решили выяснить, способны ли iBlastoid к имплантации в условиях in vitro? Как и бластоцисты человека, бластоиды при культивировании прикрепляются к адгезивной поверхности чашки и затем распластываются по ней, а около 20-30% из них формирует полость, сходную с проамниотической полостью, образуемой эпибластом бластоцисты после имплантации. В некоторых бластоидах обнаружена дифференцировка клеток «трофэктодермы» в клетки, которые морфологически напоминали подобные в цито- и синцитиотрофобласте, а также демонстрировали экспрессию характерных маркеров (ITGA1, ITGA5 и FN1 для цитотрофобласта, и CSH1, SDC1 и HSD3B1 для синцитиотрофобласта). Уровень концентрации гормона ХГЧ в культуральной среде по мере культивирования также увеличился в десять раз.
Так как бластоиды, описанные в данном исследовании, получены целиком из репрограмированных соматических клеток, эта модель может получить широкое распространение в различных типах исследований, как это ранее было с индуцированными плюрипотентными клетками. Несмотря на то, что такие бластоиды обладают всеми основными признаками, характерными для бластоцист человека, авторы подчеркивают, что между ними нельзя ставить знак равенства. Так, важными отличиями бластоидов от реальных бластоцист является отсутствие оболочки яйцеклетки zona pellucida, сопровождающей эмбрион до имплантации в стенку матки, а также недостаточно четко сформированный «гипобласт». Для бластоидов мыши также известно, что при переносе в утробу суррогатной матери они имплантируются и образуют некоторые внезародышевые ткани, однако отстают в развитии в сравнении с реальными эмбрионами и впоследствии погибают.
На данный момент неизвестно, могут ли iBlastoid формировать первичную полоску и проходить процесс гаструляции, так как на эту модель пока что распространяется международный запрет на долгосрочное культивирование также, как и в случае реальных эмбрионов человека. Быть может, это ненадолго: авторы намерены предложить пересмотреть этические и правовые нормы для практики использования бластоидов iBlastoid.
Таким образом, iBlastoid является перспективной моделью для изучения преимплатационных и ранних постиплантационных эмбрионов человека в in vitro условиях. Она может помочь в исследованиях по отслеживанию клеточных судеб при формировании ранних эмбрионов человека, при изучении взаимодействий клеток эпибласта, гипобласта и трофобласта друг с другом, а также дать возможность ученым понять природу аномалий раннего развития, бесплодия и самопроизвольных абортов.
Новость подготовила © Алёшина Н.М.
27.04.2021