Kulkarni, A., Chandrasekar, V., Natarajan, S.K. et al. A designer self-assembled supramolecule amplifies macrophage immune responses against aggressive cancer. Nat Biomed Eng 2, 589–599 (2018). https://doi.org/10.1038/s41551-018-0254-6
Rodell, C.B., Arlauckas, S.P., Cuccarese, M.F. et al. TLR7/8-agonist-loaded nanoparticles promote the polarization of tumour-associated macrophages to enhance cancer immunotherapy. Nat Biomed Eng 2, 578–588 (2018). https://doi.org/10.1038/s41551-018-0236-8
Zhang, F., Parayath, N.N., Ene, C.I. et al. Genetic programming of macrophages to perform anti-tumor functions using targeted mRNA nanocarriers. Nat Commun 10, 3974 (2019). https://doi.org/10.1038/s41467-019-11911-5
 © Герасимова Татьяна Павловна, научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза ИБР им. Н.К. Кольцова РАН, кандидат медицинских наук.
© Герасимова Татьяна Павловна, научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза ИБР им. Н.К. Кольцова РАН, кандидат медицинских наук.Макрофагам, присутствующим как в здоровой ткани, так и в структуре опухоли, свойственна высокая пластичность. В ответ на факторы окружающей среды они изменяют свои свойства в широком диапазоне клеточных фенотипов, который можно представить в виде континуума c крайними точками, обозначенными как М1 и М2. Согласно литературным данным, классический М1-фенотип макрофаги приобретают в присутствии бактериального LPS и IFN-gamma. Таким клеткам свойственна повышенная продукция провоспалительных цитокинов (IL-6, IL-12, IL-23, TNF-α), активных форм кислорода, а также высокая антиген-презентирующая способность за счет экспрессии MHC-молекул. Сдвиг в сторону М1 характерен для заболеваний воспалительной природы. М2-статус макрофагов индуцируется интерлейкином-4. Преобладание этой субпопуляции макрофагов наблюдается при онкологических заболеваниях. Опухолевые клетки создают особое микроокружение, которое поддерживает М2-поляризацию опухоль-ассоциированных макрофагов (TAMs). Считается, что TAMs принадлежит ключевая роль в прогрессировании опухолевого процесса, развитии метастазов, а также снижении эффективности иммунотерапии. В связи с этим, в настоящее время активно ведется поиск возможностей репрограммирования TAMs в сторону М1. Одной из активно разрабатываемых стратегий стало использование наночастиц (НЧ) на основе модифицированных декстранов, сополимеров, липосом, в которые включают действующие вещества, способные вызвать реполяризацию макрофагов. Эффективное поглощение наночастиц обеспечивается высокой фагоцитарной активностью клеток. В комментарии рассматриваются три статьи американских авторов, которые использовали НЧ с различными «наполнителями» с целью увеличения противоопухолевой активности макрофагов.
Опухолевые клетки активно секретируют M-CSF, «поляризующий» макрофаги в сторону М2. Кроме того, они экспрессируют поверхностный маркер СD47, так называемый «eat me not»-сигнал, который, связываясь с SIRP-α на поверхности макрофагов, ингибирует фагоцитарную активность TAMs в отношении опухолевых клеток. A. Kulkarni и соавт. разработали наночастицы липидной природы anti-SIRP-α-AK750, включающие ингибиторы макрофагальных рецепторов к M-CSF и CD47 (рис.1а).
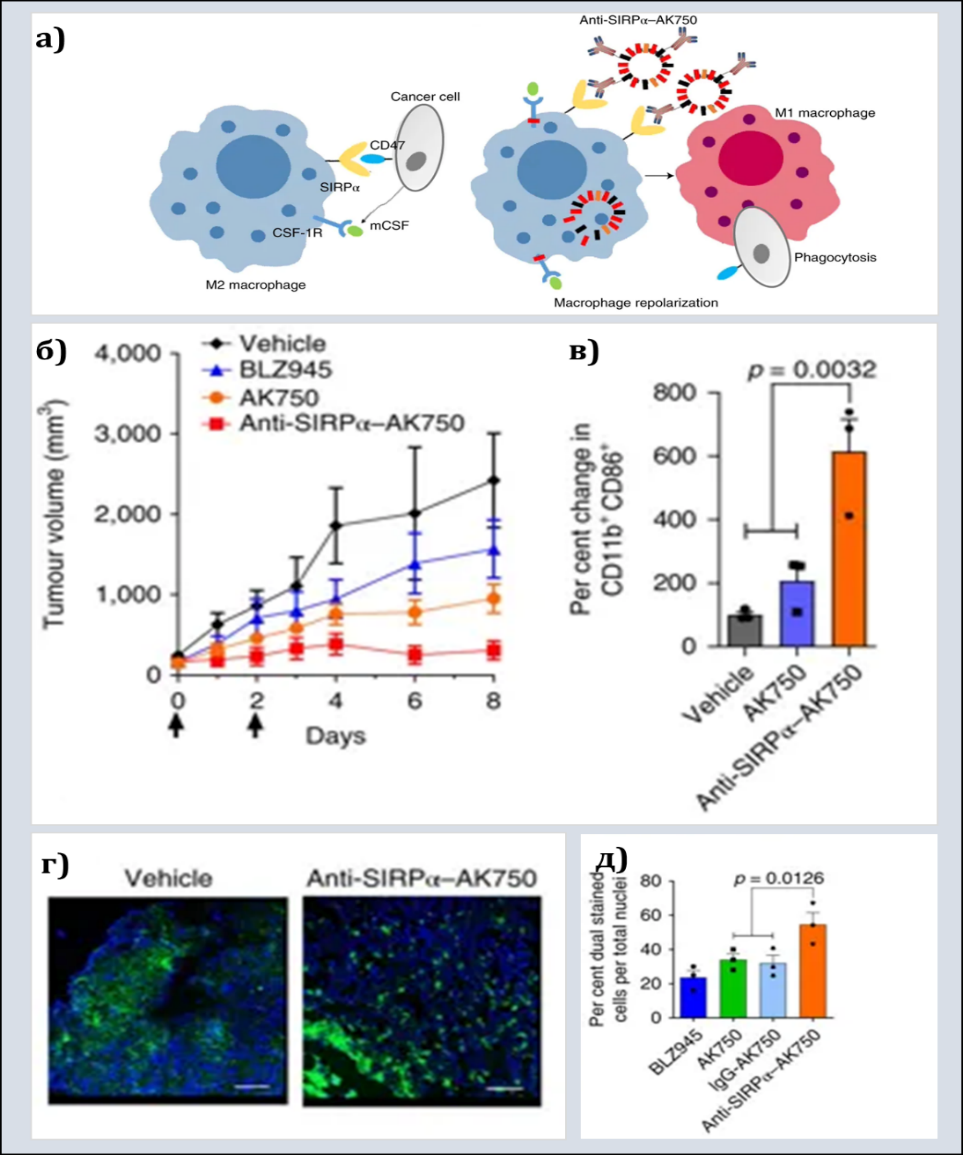
Рис. 1. Kulkarni A. et al., 2018
а) Механизмы, используемые опухолевыми клетками для поддержания М2-поляризации TAMs и угнетения их фагоцитарной активности; пути репрограммирования макрофагов, используемые в работе.
б) Уменьшение объема опухоли у экспериментальных животных при однократном в/в введении НЧ anti-SIRP-α-AK750 (мышиная модель меланомы B16/F10).
в) Изменение экспрессии М1-ассоциированных маркеров CD11b и СD86 в клеточной суспензии опухолевой ткани после введения наночастиц anti-SIRP-α-AK750.
г) F4/80+ макрофаги на срезах опухолей животных контрольной и тестовой группы.
д) Повышение интенсивности фагоцитоза опухолевых клеток макрофагами при введении anti-SIRP-α-AK750.
TAMs, обработанные такими наночастицами in vitro, начинали экспрессировать на высоком уровне поверхностные маркеры, свойственные М1-макрофагам (CD86, CD80, MHC-II) и iNOS, тогда как уровень экспрессии CD206 (маркер макрофагов типа М2) снижался. in vivo на моделях меланомы B16/F10 у мышей линии C57BL/6 и рака груди 4T1 у мышей Balb/c внутривенное введение НЧ увеличивало число макрофагов М1 внутри опухоли, а также процент фагоцитоза ими опухолевых клеток (рис. 1д). Кроме того, усиливалась пролиферация внутри опухоли Т-лимфоцитов CD8+, проявляющих цитотоксическую активность. Даже однократное введение НЧ приводило к значимой регрессии опухолей у тестовых животных в сравнении с группой контроля (рис. 1б).
В независимом исследовании C.B. Rodell и соавт. протестировали панель из 38 лекарственных средств, используемых при лечении онкологических больных, определив наиболее мощно воздействующий на поляризацию макрофагов (резиквимод). В клинике этот препарат используется как адъювант при вакцинации, а также для местного лечения рака кожи и демонстрирует ограниченную эффективность, что связано с его низкой биодоступностью. В качестве системы доставки авторами были использованы наночастицы на основе циклодекстринов, связывающихся с маннозными рецепторами на поверхности макрофагов. Уровень внутриклеточной аккумуляции НЧ коррелировал с ростом секреции IL-12, что свидетельствовало об успешном репрограммировании макрофагов в сторону М1 и активации иммунного ответа Th1 (рис.2 б,в). in vivo на модели рака прямой кишки MC38 у мышей C57BL/6 в тестовой группе наблюдали меньший размер опухоли и значимо более высокую выживаемость по сравнению с контролем (рис.2 г,д). Интересно, что у 2 из 7 экспериментальных животных тестовой группы произошла полная регрессия опухоли, и к повторной индукции опухолевого процесса эти мыши оказались резистентны, что указывает на формирование противоопухолевой памяти.
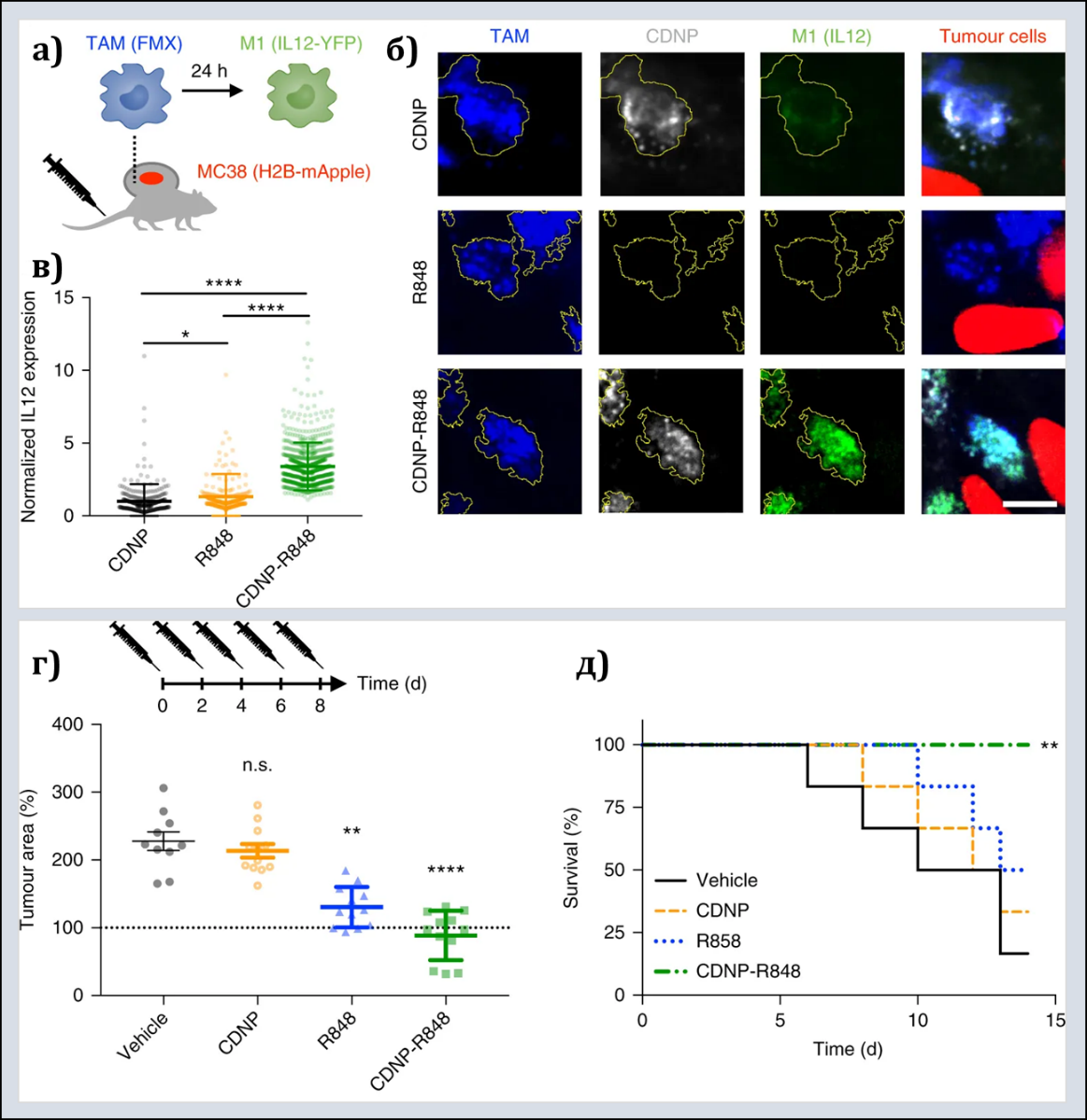
Рис. 2. Rodell, C.B., 2018
а) Схема эксперимента.
б) Прижизненная микроскопия TAMs в опухолевой ткани мышей с раком прямой кишки MC38 через 24 часа после введения «пустых» наночастиц (CDNP), раствора резиквимода (R848) и тестируемых наночастиц (CDNP-R848). TAMs (синий), наночастицы (белый), опухолевые клетки (красный), экспрессия IL12 М1-макрофагами (зеленый). Микроскопия выполнена в p40-IRES-eYFP IL12 мышах-репортерах.
в) Экспрессия IL-12 (М1-ассоциированный цитокин).
г) Изменение размера опухоли в тестовой группе в сравнении с контрольными на 8-й день лечения.
д) Повышение выживаемости экспериментальных животных в тестовой группе.
F. Zhang и соавт. изучили возможность генетического репрограммирования TAMs. В наночастицы полимерной природы поместили транскрибированные in vitro мРНК, кодирующие IRF5 и IKKβ (рис. 3б). Таргетные диманнозные лиганды обеспечивали сродство к рецептору CD206 (маннозный рецептор) на поверхности TAMs (рис. 3а).
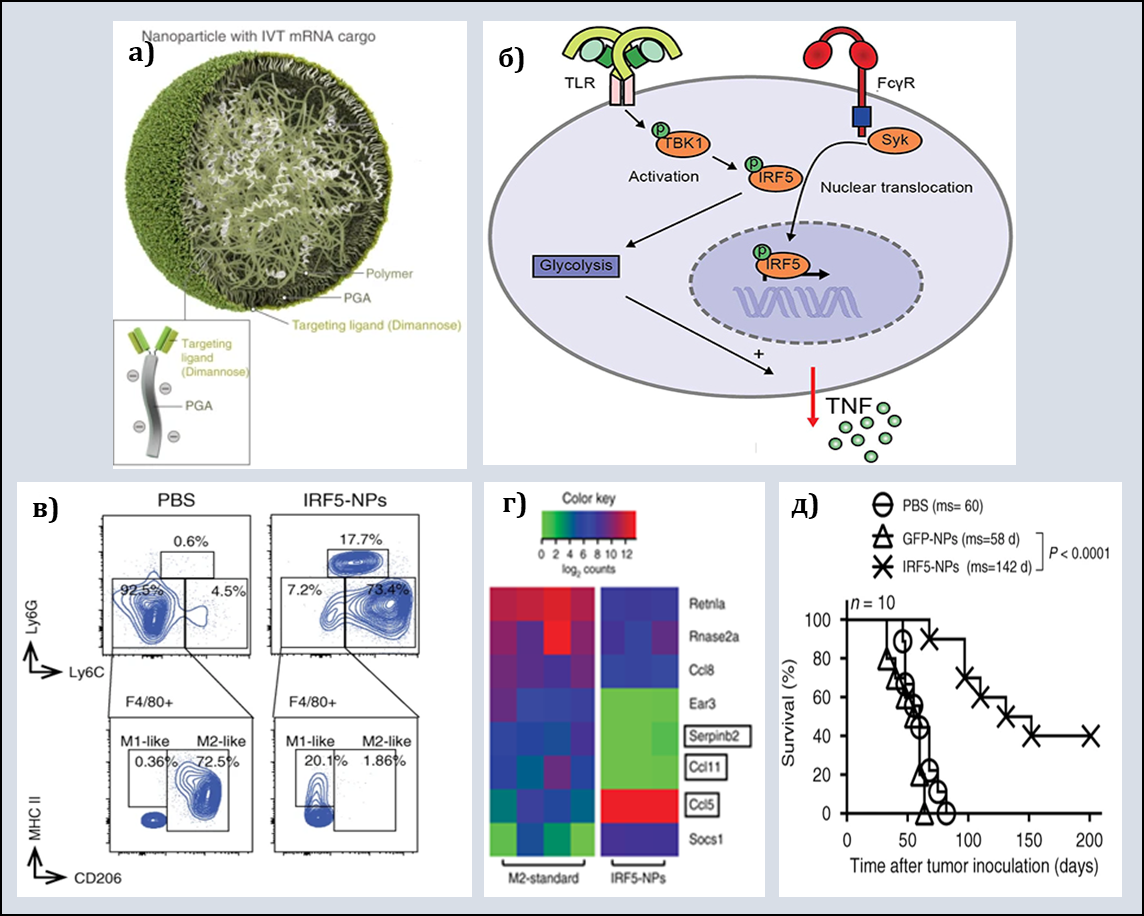
Рис. 3. Zhang, F., 2019
а) Структура полимерных наночастиц.
б) мРНК в составе НЧ кодируют ключевые сигнальные молекулы: IRF5 – регуляторный фактор интерферона, способствующий поляризации макрофагов в направлении фенотипа M1; IKKβ – киназа, фосфорилирующая и активирующая IRF5.
в) Изменение фенотипа М2-макрофагов брюшины мышей с диссеминированным раком яичников ID8 после введения НЧ.
г) Активация в трансфицированных макрофагах экспрессии генов, связанных с M1 (Ccl5), подавление активности M2 генов (Serpinb2, Ccl11).
д) Внутривенное введение наночастиц c мРНК IRF5/IKKβ удваивает выживаемость экспериментальных животных с раком яичников по сравнению с контролем.
В исследованиях in vitro М2-макрофаги, трансфицированные РНК IRF5/IKKβ, изменяли экспрессию генов и поверхностных маркеров в сторону М1 (рис.3 в,г). Эксперименты in vivo на модели рака яичника ID8 у мышей линии C57BL/6 (НЧ вводили интраперитонеально для непосредственного контакта с очагами опухолевого роста) продемонстрировали регрессию заболевания в тестовой группе: медиана выживаемости составила 142 дня против 60 дней в контроле. Мышам с меланомой B16F10 с множественными метастазами в легких препарат вводили внутривенно с целью системного репрограммирования макрофагов и оценки эффективности контроля над диссеминированными онкологическими заболеваниями. Число метастазов уменьшилось по сравнению с контролем в 8.7 раза. Применимость разработанного подхода к клинической практике была подтверждена серией экспериментов in vitro на клеточной линии THP-1 с использованием наночастиц, включающих человеческие транскрипционные факторы IRF5 and IKKβ.
Таким образом, модуляция фенотипа и функции TAMs – перспективное направление в контроле над опухолевым ростом. Идет поиск активных агентов для реполяризации опухолевых макрофагов, cоздаются модификации наночастиц, обеспечивающие адресность доставки действующего вещества к таргетным клеткам. Это позволит снизить терапевтическую дозу препарата, влияние на другие клетки организма и, тем самым, уменьшить вероятность проявления побочных эффектов.
Перепрограммирование опухолевых макрофагов не приводит к непосредственной гибели раковых клеток и полной регрессии опухоли. Однако, такая стратегия может повысить эффективность терапии пациентов с онкологическими заболеваниями, особенно в случаях рефрактерности к традиционным методам лечения, а также на поздних стадиях заболевания, когда клиническим стандартом служат только паллиативные меры. Возможность в/в введения НЧ позволяет воздействовать на метастазы, а также на очаги опухолевого роста в недоступных для хирургии и инъекций локализациях. На настоящий момент данный подход не используется в практике клиницистов-онкологов. Однако, есть информация о начале I фазы клинических испытаний поляризующего макрофаги препарата на основе НЧ (huIRF5/IKKβ NPs) при лечении женщин с раком яичников (Fred Hutchinson Cancer Research Center, Seattle, USA, 2019).
Репрограммирование макрофагов в противоположном направлении (от М1 к М2-фенотипу) может быть эффективно при лечении воспалительных и аутоиммунных заболеваний.
Новость подготовила © Герасимова Т.П.
27.04.2020