DOI: https://doi.org/10.7554/eLife.77239
 © Алёшина Нина Максимовна, сотрудник лаборатории проблем регенерации ИБР РАН.
© Алёшина Нина Максимовна, сотрудник лаборатории проблем регенерации ИБР РАН.Область научных интересов: оо- и фолликулогенез, раннее развитие млекопитающих, а также роль трансмиттеров в этих процессах.
Секвенирование РНК единичных клеток (single-cell RNA sequencing, scRNAseq) – современный метод молекулярной биологии, получивший большую популярность в последние годы. Он находит применение во многих областях биологии и биомедицины, и, безусловно, является крайне актуальным в биологии развития. В колонке «Новости биологии развития» регулярно появляются сообщения о применении «single-cell» секвенирования для решения задач в сфере эмбриологии: начиная от расшифровки РНК клеток зародышей различных животных и заканчивая выявлением эволюционных закономерностей происхождения целых систем органов. Исследование органов репродуктивной системы методом «scRNAseq» также находится «на переднем крае науки». В частности, представляет огромный интерес применение этого метода в изучении яичника, так как клеточный состав в нем непостоянен: клетки пролиферируют и дифференцируются в процессе фолликулогенеза, овуляции, и образования и дегенерации желтых тел. За последние годы с помощью «scRNAseq» были исследованы процессы фолликулогенеза и старения яичника млекопитающих, однако до сих пор не было достаточно данных по динамическим изменениям клеточного состава в процессе овариального цикла. Группа американских ученых проанализировала транскриптом более 34000 клеток яичника половозрелой мыши, чтобы изучить динамику изменения состояния и дифференцировки клеток, и понять, как происходит регуляция эструса у мыши.
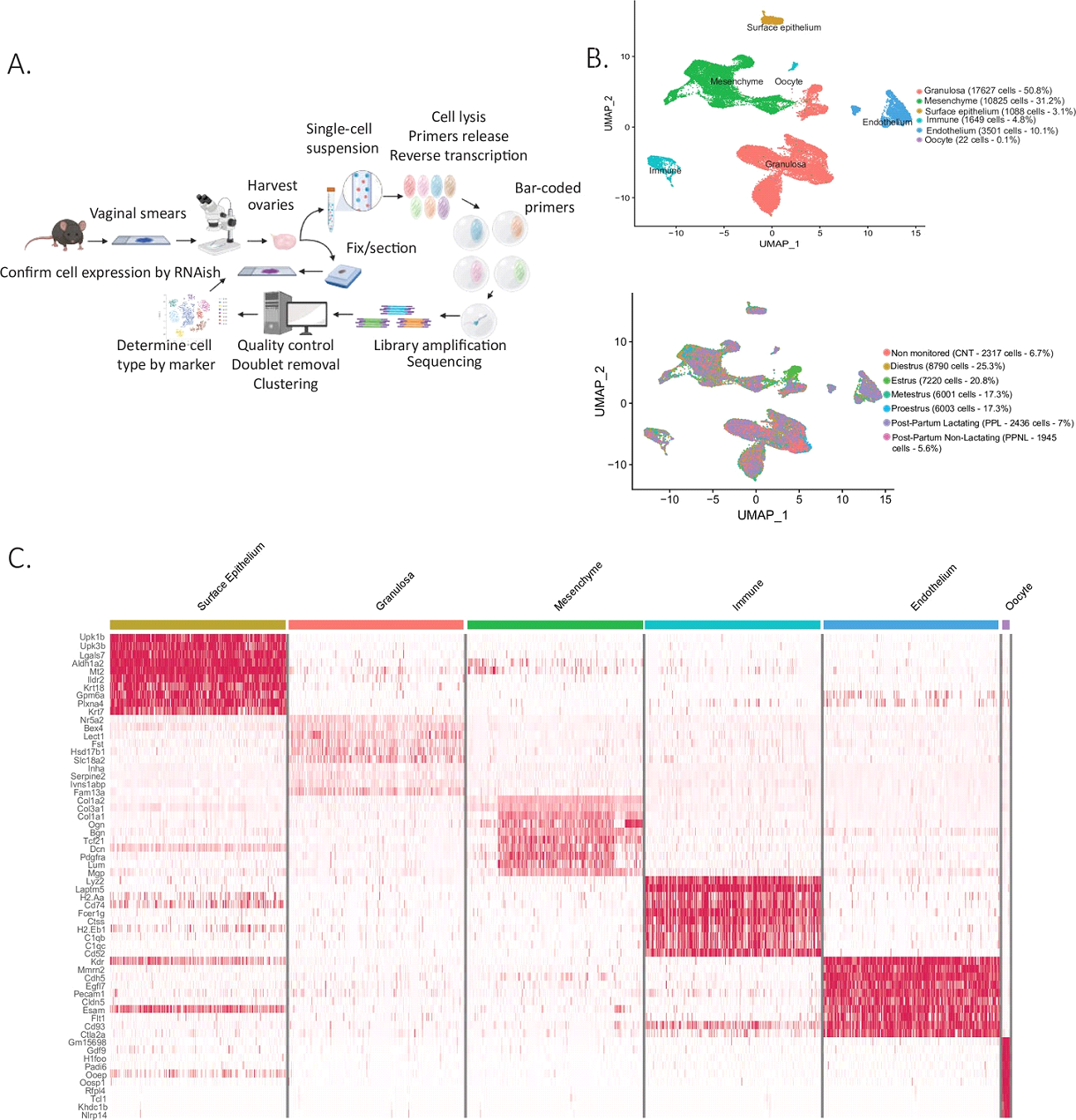
В работе изучались яичники мышей на четырех стадиях эстрального цикла: проэструс (возникновение преовуляторных фолликулов), эструс (овуляция), метэструс (формирование желтых тел), диэструс (покой), а также яичники мышей через 10 дней после родов: в процессе лактации и кормления, и тех, у которых мышат забирали сразу после рождения (лактация отсутствовала) (Рис.1, А). Анализируемые клетки разбивали на кластеры с помощью алгоритма Seurat. Самыми многочисленными в яичнике оказались клетки гранулезы и мезенхима стромы, и в гораздо меньшем количестве были представлены клетки эндотелия сосудов, поверхностного эпителия яичника, иммунные клетки и ооциты (Рис.1, B, C). Полученные кластеры затем анализировали и группировали клетки в подкластеры. Экспрессию генов, наиболее отличавшихся при анализе конкретного клеточного типа, подтверждали методом гибридизации in situ.
Самый большой по величине кластер образовали клетки гранулезы. Исследователи выделили в нем 8 основных подкластеров: клетки гранулезы преантрального фолликула/кумулюсные клетки (27,3% от общего количества клеток в кластере), муральные клетки гранулезы (стероидогенные клетки стенки фолликула, 21,8%), лютеинизирующиеся муральные клетки гранулезы (4,8%), клетки атретических фолликулов (22,6%), активно пролиферирующие (14,4%), функциональные (5,4%) и регрессирующие (3,7%) клетки желтого тела. Известно, что в процессе фолликулогенеза клетки гранулезы способны дифференцироваться и при появлении антральной полости возникают две субпопуляции: пристеночные муральные клетки гранулезы и сопровождающие яйцеклетку клетки кумулюса. Интересным наблюдением исследователей является то, что клетки гранулезы преантральных фолликулов, еще не подверженные дифференцировке, и «зрелые» клетки кумулюса имеют похожие паттерны экспрессии генов, из-за чего на картах сходства клеток они располагаются в одной области. Для обеих клеточных групп характерна экспрессия гена Kctd14 (potassium channel tetramerization domain), которая не наблюдается в муральных клетках гранулезы. Схожесть этих клеток, по всей видимости, объясняется тесным контактом с ооцитом.
Для каждого большого клеточного кластера авторы предложили целый набор маркерных генов. Однако, подробно в главах результатов и обсуждении рассматривались только самые показательные (чаще всего совпадающие с литературными данными). В случае кластера клеток гранулезы одним из генов-маркеров оказался везикулярный транспортер моноаминов, Slc18a2 (известен также как Vmat2). Этот переносчик участвует в трансмиттерном сигналинге биогенных аминов, он способен переносить дофамин, норадреналин и серотонин из цитоплазмы клетки в везикулы. Исследователи обнаружили Vmat2 в подкластере клеток гранулезы преантральных фолликулов/клеток кумулюса. Этот результат является крайне интересным в контексте исследования ненервной роли трансмиттеров, активно изучаемой в ИБР РАН. В частности, экспрессия Vmat2 выявлена в клетках гранулезы мыши на достаточно высоком уровне, причем показано снижение уровня экспрессии этого гена в ходе фолликулогенеза от преантральных к преовуляторным фолликулам (Никишин и др., 2017). То, что в обозреваемом исследовании экспрессия Vmat2 находится на уровне, позволяющем выдвинуть этот ген в качестве одного из маркеров клеток гранулезы, подтверждает предположение о том, что трансмиттерный сигналинг играет важную роль в регуляции фолликулогенеза.
Именно в случае клеток гранулезы наблюдалась наиболее выраженная динамика изменения экспрессии на разных стадиях эстрального цикла. Наиболее стабильным и слабо изменяющимся оказался кластер клеток гранулезы преантральных фолликулов, так именно на этой стадии фолликулы проводят достаточно долгое время, оставаясь нечувствительными к сигналам гонадотропных гормонов (такая чувствительность появляется только у фолликулов после образования антральной полости). Во время эструса в яичнике резко увеличивалось количество клеток гранулезы, претерпевающих лютеинизацию, так как эта стадия сопровождается овуляцией и образованием желтых тел на месте прорывающихся фолликулов. Клетки желтого тела разделились на субпопуляции активных (стероидогенных) и деградирующих лютеоцитов. В первых была обнаружена экспрессия маркеров пролиферации (Top2a) и ферментов биосинтеза стероидных гормонов, а для второго кластера была характерна экспрессия ингибиторов клеточного цикла (Cdkn1a) и маркеров лизиса желтого тела.
Клетки, которые относились к мезенхиме стромы, представляли второй по величине кластер после гранулезы. В него вошли клетки теки преантральных фолликулов (16,8% от общего количества клеток в кластере), стероидогенные клетки теки (theca interna, 13,2%) и гладкомышечные клетки (theca externa, 10,2%) антральных и преовуляторных фолликулов, перициты, окружающие сосуды (6,2%). Два крупных подкластера образовали клетки, формирующие строму вне фолликулов: стероидогенные клетки стромы (28,7%) и фибробластоподобные клетки (24,9%). Интересно, что клетки теки преантральных фолликулов и стероидогенные клетки теки отличались по экспрессируемым маркерам. Для клеток теки преантральных фолликулов основным геном-маркером оказался белок, взаимодействующий с Хэджхог (hedgehog-interacting protein, Hhip). Этот результат подтверждает известный факт о том, что в рекрутинге клеток теки из стромы играют роль белки-участники сигнального каскада Хэджхог, экспрессируемые клетками гранулезы ранних растущих фолликулов. Эти клетки представляют собой незрелую форму клеток теки. После формирования полости они дифференцируются в клетки theca interna. В стероидогенных клетках теки экспрессия фермента, необходимого для биосинтеза андрогенов (cytochrome P450 family 17 subfamily A member 1, Cyp17a1). Помимо стероидогенных клеток теки в интерстиции были обнаружены клетки, способные синтезировать андрогены. Основным маркером этих клеток стал еще один ген из сигнального каскада Хэджхог – Patch1 (Ptch1), являющийся важным регулятором овариального стероидогенеза и также характерный для клеток теки преантральных фолликулов. Анализ локализации выявил экспрессию этого гена в небольших скоплениях клеток в строме и вокруг фолликулов. Выдвигается предположение, что эти клетки также могут являться предшественниками клеток theca interna.
В кластере клеток поверхностного эпителия были обнаружены два подкластера: неделящиеся клетки эпителия (96%) и митотически делящиеся (4%). Интересным наблюдением стало то, что пролиферирующие клетки поверхностного эпителия обнаруживались только на стадии эструса, так как именно они участвуют в заживлении яичника на месте прорвавшегося фолликула после овуляции. Помимо характерной для этих клеток экспрессии кератина, исследователи также обнаружили, что во время эструса клетки поверхностного эпителия экспрессируют гены, отвечающие за заживление, такие как галектин 1 (galectin 1, Lgals1).
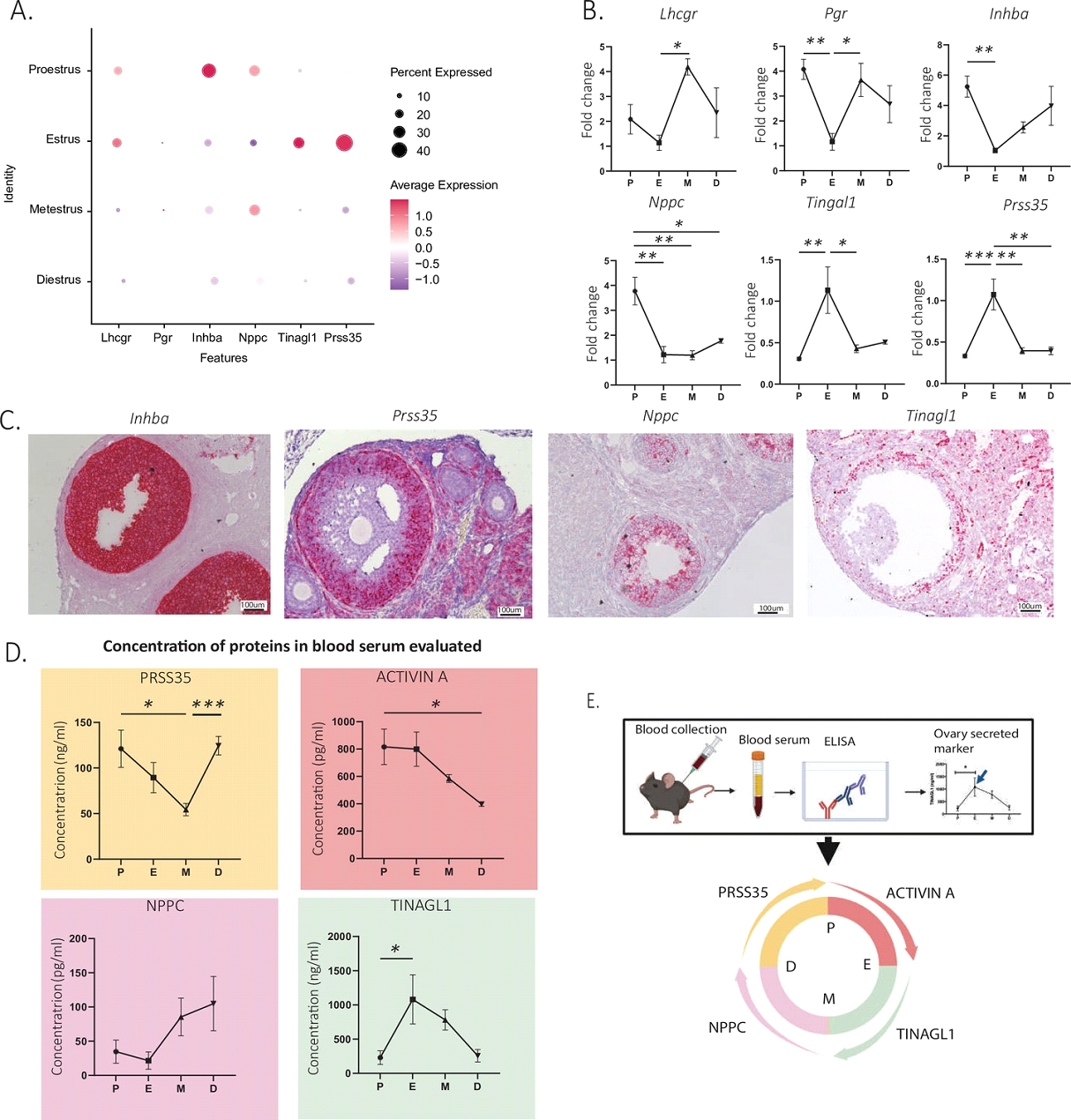
Многие гены-маркеры, описанные в исследовании уже давно известны, и используются при анализе тех или иных типов клеток яичника. Особенностью этой работы стало выявление секретируемых в кровь биомаркеров, коррелирующих с конкретной стадией эстрального цикла. Авторы начали с анализа методом ПЦР в реальном времени целого яичника мышей на разных стадиях, чтобы увидеть, экспрессия каких генов меняется сильнее всего. Такими генами оказались рецептор к лютеинизирующему гормону / хорионическому гонадотропину (luteinizing hormone/choriogonadotropin receptor, Lhcgr), экспрессия которого наиболее выражена при переходе от стадии эструса к метэструсу и рецептор к прогестерону (progesterone receptor, Pgr) при переходе от проэструса к эструсу. Затем исследователи использовали эти данные, чтобы выявить динамику экспрессии генов в клетках гранулезы, так как именно этот кластер демонстрировал наиболее значительные изменения в ходе эстрального цикла. В работе использовались методы измерения уровня экспрессии мРНК с помощью количественной ПЦР (ПЦР в реальном времени) и количества соответствующего белкового продукта в крови при помощи ИФА (Рис. 2, A-D).
В результате было предложено 4 биомаркера, отражающих переходы между различными стадиями эстрального цикла: Inhba, Nppc, Prss35, Tinagl1. Экспрессия первых двух генов, активина А (inhibin subunit beta-A, Inhba) и натриуретического пептида C (natriuretic peptide C, Nppc) оказалась наиболее выражена в муральных клетках гранулезы на стадии проэструса и резко снижалась в эструсе. Концентрация белка активина А, являющегося одним из важнейших регуляторов работы яичника, в том числе и ответа на сигналы гонадотропных гормонов, в крови была наиболее высокой на стадиях проэструса и эструса. В то же время, Nppc, необходимый для сохранения блока мейоза в ооцитах, в крови выявлялся наиболее выраженно в метэструсе и диэструсе. Такая задержка пика в случае концентрации белка может быть обусловлена тем, что на стадии проэструса и эструса этот белок связывается локально в ткани и не попадает в кровь.
Обратную динамику имела экспрессия генов серин протеазы 35 (Prss35) и Tinagl1 (tubulointerstitial nephritis antigen like 1) – пик наблюдался на стадии эструса и снижался к метэструсу. Белок Prss35 экспрессируется в клетках теки преантральных фолликулов и в клетках гранулезы преовуляторных фолликулов в начале лютеинизации, что говорит о том, что он может быть необходим для ремоделинга ткани в процессе овуляции и при образовании желтого тела. В крови его уровень наиболее высок на стадии диэструса и проэструса. Другой маркер, фактор внеклеточного матрикса, Tinagl1, может быть необходим для нормальной овуляции, однако его роль в яичнике остается слабо изученной. Концентрация белка Tinagl1 в крови имеет пик на стадии эструса. Эти интересные наблюдения могут привлечь внимание ученых к изучению функции этого фактора в яичнике, в процессе овуляции и при циклических изменениях в эструсе.
Стандартным и общепринятым способом определения стадии эстрального цикла у мышей является микроскопическое исследование клеточного состава вагинального смыва или мазка. Полученные в исследовании данные позволили разработать протокол с использованием метода ИФА и выявлением уровня экспрессии биомаркеров в крови (активин А при переходе от проэструса к эструсу, Tinagl1 – от эструса к метэструсу, Nppc – от метэструса к диэструсу, Prss35 – от диэструса к проэструсу) (Рис.2, E). Этот протокол может стать удобной альтернативой стандартному микроскопическому исследованию в случае сбора информации в экспериментах с большим количеством животных. Исследователи также выдвигают предположение, что эти биомаркеры можно будет использовать для определения стадий цикла у других млекопитающих, однако это еще предстоит выяснить.
Таким образом, данная статья американских авторов не только является подробным атласом клеточного состава яичника, но и предлагает удобные инструменты для будущих исследователей, в частности, группы маркеров для каждого клеточного типа и протокол определения стадии эстрального цикла по образцам крови. Яичник действительно представляет собой сложный объект для анализа методом «scRNAseq», именно поэтому каждое новое исследование, проведенное с помощью этого анализа, позволяет углубить понимание механизмов регуляции его работы.
Никишин Д.А., Алешина Н.М., Семенова М.Л., Шмуклер Ю.Б. Динамика экспрессии компонентов серотонинергической системы в клетках гранулезы развивающегося овариального фолликула и при лютеинизации // Гены и клетки. 2017. том 12. № 4. с. 37-42.
Новость подготовила
© Алешина Н.М.
27.03.2023