Метод получения идентичных организмов путем переноса ядра соматической клетки в энуклеированный ооцит известен уже давно. Наиболее известным результатом такой операции является знаменитая овечка Долли. Генетически идентичные организмы являются идеальным модельным объектом. На данный момент известны 23 вида успешно клонированных видов млекопитающих, таких как, мышь, свинья, кошка, крыса, собака и др. В качестве донора генетического материала используются всевозможные типы клеток – индуцированные плюрипотентные, эмбриональные стволовые, клетки кумулюса, постнатальные клетки (фибробласты, кератиноциты и др.). В ходе индивидуального развития процесс дифференцировки клеток сопровождается изменением экспрессии генов, а также эпигенетическими изменениями (уровнем метилирования генома, модификацией гистонов). При переносе ядра соматической клетки с разной степенью эффективности происходит восстановление потенциала дифференцировки соматической клетки, в результате чего происходит развитие эмбриона.
В рассматриваемой работе, опубликованной в журнале «Cell» в феврале 2018, было использовано несколько новых методик, позволивших стимулировать репрограммирование соматического ядра, в результате чего авторами впервые было получено два здоровых клона макаки. Работа проводилась в лабораториях института нейронаук Шанхая, Китай (Institute of Neuroscience, CAS Center for Excellence in Brain Science and Intelligence Technology, State Key Laboratory of Neuroscience, CAS Key Laboratory of Primate Neurobiology, Chinese Academy of Sciences, Shanghai, China).
В данной работе были использованы два типа донорских клеток, полученных от макак этого вида – эмбриональные фибробласты и клетки кумулюса.
В первую очередь авторы оптимизировали методику пересадки ядра соматической клетки в энуклеированный ооцит, используя работы других исследователей. Клетки донора ядерной ДНК инкубировались с гликопротеинами оболочки вируса Hemagglutinating virus of Japan (HVJ), что позволило перенести генетический материал, путем слияния цитоплазм ооцита и соматической клетки. Кроме того, авторы использовали лазер для создания отверстия в zona pellucida, для уменьшения травматичности инъекции донорской клетки в перивителлиновое пространство. Таким образом, соматическая клетка была инъецированна под zona pellucida, произошло слияние клетки с цитопластом, в результате чего, хромосомный комплекс донора был перемещен в ооцит.
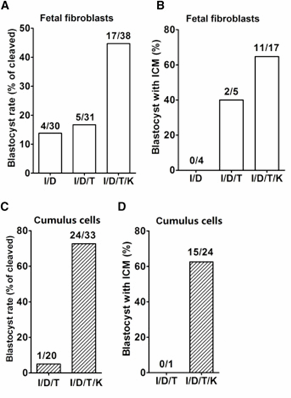
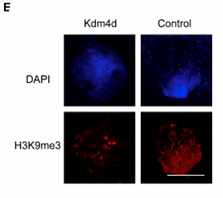
Рисунок 1. (A-D) Сравнительный анализ эффективности воздействия ингибитора гистондеацетилаз трихостатин А (группа I/D/Т) и мРНК Kdm4d/4a деметилазы (группа I/D/T/K) на эпигенетическую регуляцию генетического материала эмбриональных фибробластов (А,В) и клеток кумулюса (С,D). Группа I/D – интактный контроль. (А,С) – доля ооцитов, развившихся до бластоцист. (В,D) – доля бастоцист, содержащих нормальную внутриклеточную массу.
Е – иммуногистохимическое окрашивание одноклеточных эмбрионов антителами anti-H3K9me3 и DAPI. 5 часов после инъекции мРНК Kdm4d. Масштабный отрезок = 30 μm.
Дальнейшей задачей авторов являлось преодоление эпигенетического барьера и увеличение числа и качества бластоцист, полученных из реконструированных ооцитов in vitro. После обычной активации ооцитов иономицином и 6-диметиламинопурином (контрольная группа I/D) до стадии бластоцисты развивалось 14% эмбрионов, для которых было характерно практически полное отсутствие внутриклеточной массы (ВКМ). На первом этапе авторы использовали ингибитор гистондеацетилаз трихостатин А (TSA) (группа I/D/Т), для которого было показано увеличение эффективности эмбрионального развития in vitro соматических клонов млекопитающих (мыши, свиньи, обезьяны и человека). После инкубации с 10 nM TSA в течение 10 часов до стадии бластоцисты развилось только 17% эмбрионов, однако из них 40% обладало нормальной ВКМ (Рис. 1А).
На следующем этапе в эмбрионы I/D/Т была инъецирована мРНК Kdm4d/4a деметилазы (группа I/D/T/K) для модификации участков, богатых гистоновыми белками в триметилированной форме (H3K9me3). Другими исследователями ранее было показано, что деметилаза Kdm4d активизирует репрограммирование ядер соматических клонов, удаляя H3K9me3. В результате эксперимента доля бластоцист составила 45%, из которых 65% обладали нормальной ВКМ - для эмбриональных фибробластов (Рис. 1 A,В), и 73% (63% ВКМ соответственно) - для клеток кумулюса (Рис. 1 С,D).
В результате всех манипуляций авторы получили 109 бластоцист из ядер эмбриональных фибробластов и 192 – от клеток кумулюса. В итоге от обоих источников родилось по 2 клона (Табл. 1). Однако клоны, развившиеся из ядер клеток кумулюса, прожили около суток и умерли от легочной недостаточности. Выжившие клоны были полностью здоровы, нормально развивались в течение 40 и 50 дней на момент выхода статьи. В обоих случаях, анализ подтвердил, что ядерная ДНК соответствует донорской, а митохондриальная – донору ооцита.
Таблица 1. Статистика развития эмбрионовпосле пересадки ядер соматических клеток
| Донор | ооциты | Бласто- цисты | Подса- женные эмбри- оны | Сурро- гаты | Бе- ремен- ности | Роды | Жизне- спо- собные эмбрио- наль- ные фибро- бласты |
| Эмбриональ- ные фибро- бласты | 127 | 109 | 79 | 21 | 6 | 2 | 2 |
| Клетки кумулюса | 290 | 192 | 181 | 42 | 22 | 2 | 0 |
Дополнительно авторы исследовали механизм воздействия мРНК Kdm4d/4a с помощью секвенирования РНК (РНК-сек). Анализ данных по образцам клеток кумулюса, 4- и 8-клеточных эмбрионов (после интрацитоплазматической инъекции – ИКСИ) и 8-ми клеточных клонированных эмбрионов (донорские клетки – кумулюс) до и после инъекции мРНК Kdm4d подтвердил, что инъекция мРНК Kdm4d активирует экспрессию множества генов, «выключенных» в соматических ядрах. Помимо этого, авторы подтвердили иммуногистохимически, что уровень H3K9me3 выше в контрольных эмбрионах, по сравнению с инъецированными мРНК Kdm4d (Рис. 1Е). Кроме того, по результатам анализа данных РНК-сек, авторами был подобран вероятный набор генов, метилирование которых, приводит к низкой эффективности клонирования обезьян.
Таким образом, авторами был разработан рабочий протокол клонирования млекопитающих с использованием механизмов эпигенетического регулирования. Несомненно, необходимы дальнейшие работы по усовершенствованию протокола для увеличения его эффективности, а также исследования постнатальных клеток-доноров. Однако, получение генетически идентичных животных, физиологически сходных с человеком, потенциально является хорошей моделью изучения заболеваний и тестирования лекарств.
Новость подготовила © 27.02.2018 Анастасия Косых
 ©
©