 © Кулибин Андрей Юрьевич, старший научный сотрудник лаборатории эволюционной биологии развития, кандидат биологических наук
© Кулибин Андрей Юрьевич, старший научный сотрудник лаборатории эволюционной биологии развития, кандидат биологических наук
Метод трансплантации стволовых клеток сперматогенной системы в семенники с нарушенным сперматогенезом рассматривается как перспективный терапевтический подход для лечения определенных форм мужской стерильности. Недавнее исследование Накамуры и соавторов (Nakamura et al., 2021) позволило обойти некоторые важные ограничения существующей методики трансплантации, которые исключали ее практическое применение.
Стволовые клетки сперматогенной системы являются частью пула наименее дифференцированных половых клеток – сперматогониев (СГ), поэтому их называют сперматогониальными стволовыми клетками (ССК). У млекопитающих ССК располагаются на базальной мембране извитых семенных канальцев (структурной единице семенника, см. рис. 1), в сперматогенном эпителии, где соседствуют с другими типами половых клеток, а также с соматическими клетками Сертоли (рис. 1). Клетки Сертоли играют роль клеток «поддержки» для развивающихся половых клеток и являются основой ниши для стволовых клеток. Долгое время идентификация ССК в семенниках млекопитающих была затруднена из-за отсутствия маркеров их популяции. Поиску таких маркеров во многом способствовал разработанный в 1994 году Бринстером и соавторами (Brinster, Avarbock, 1994; Brinster, Zimmermann, 1994) метод трансплантации ССК в семенники, лишенные собственных половых клеток. По методике Бринстера (см. обзор Brinster, 2002), суспензию клеток, содержащую ССК, вводят непосредственно в просвет извитых семенных канальцев, где они прикрепляются к цитоплазматическим отросткам клеток Сертоли и, цепляясь за них, перемещаются в ниши, расположенные на базальной мембране. Интересно, что такое же перемещение из просвета канальца на базальную мембрану претерпевают предшественники ССК в процессе развития половой системы. На базальной мембране ССК начинают активно пролиферировать и вступают в дифференцировку, образуя колонии развивающихся половых клеток донора. Бринстер полагал, что заселять семенные канальцы реципиента и образовывать там новые колонии способны лишь ССК и, что, подсчитывая количество таких колоний, можно оценить их долю в трансплантируемой суспензии клеток. Как выяснилось позже, это не совсем так, и часть коммитированных на дифференцировку СГ при трансплантации снова становятся стволовыми клетками и образуют колонии. Таким образом, строго говоря, этот метод позволяет определить не число ССК, а концентрацию колониеобразующих СГ клеток в трансплантируемой суспензии.
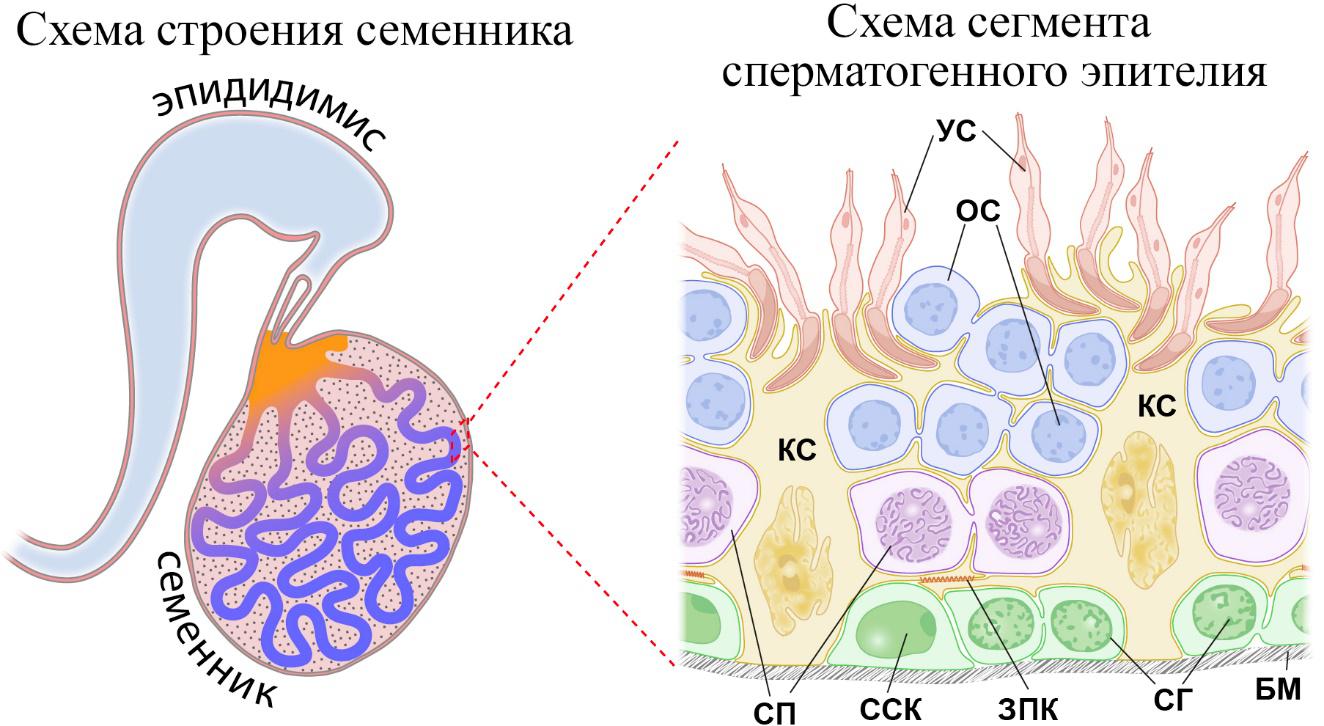
Рис. 1. Схема строения семенника и сегмента сперматогенного эпителия извитого семенного канальца. Обозначения: БМ – базальная мембрана, ЗПК – зона плотных контактов между соседними клетками Сертоли, КС – клетка Сертоли, ОС – округлые сперматиды, СГ – дифференцирующиеся сперматогонии, СП – сперматоциты, ССК – сперматогониальные стволовые клетки, УС – удлиняющиеся сперматиды.
Метод трансплантации широко используется не только для поиска маркеров ССК, но и для совершенствования условий их культивирования, изучения структуры стволового компартмента и устройства ниши. Однако, хотя существующая процедура пересадки ССК подходит для экспериментальных исследований, ее эффективность низка, что часто не позволяет достичь восстановления фертильности после трансплантации. Одной из причин этого является крайне низкая концентрация колониеобразующих клеток в суспензии, полученной из семенников взрослых животных. Долю этих клеток в суспензии можно увеличить разными способами, например, использовать в качестве доноров новорожденных мышат, у которых отсутствуют дифференцированные половые клетки, или трансгенных животных, экспрессирующих ген флуоресцентного белка под промотором гена-маркера ССК; наконец, можно использовать клеточный сортинг суспензии семенника, окрашенной на поверхностные маркеры ССК. Временное подавление выработки половых гормонов ФСГ, ЛГ и тестостерона введением антагониста гонадотропин-рилизинг гормона (GnRH-ant) также в ряде случаев способствует увеличению эффективности трансплантации (для справки см. Shetty et al., 2018). Все эти методы по разным причинам не подходят для последующего клинического использования. В описываемой работе (Nakamura et al., 2021) представлен другой подход для увеличения эффективности трансплантации ССК у мышей, позволяющий восстановить фертильность, используя в качестве доноров взрослых животных и цельную суспензию семенника без применения клеточного сортинга. Оказалось, что для этого необходимо временно заблокировать в семенниках реципиента вступление трансплантированных ССК в дифференцировку, что приводит к увеличению их концентрации и формированию большего числа колоний. После снятия запрета на дифференцировку в таких семенниках образуется достаточное для восстановления фертильности количество зрелых гамет.
Предложенный исследователями метод достаточно прост. Почему же он не был предложен раньше? Причина в отсутствии достаточного количества сведений о ранних этапах развития донорских половых клеток в семенниках реципиента. Так, в большинстве исследований результаты трансплантации ССК анализируют на достаточно поздние сроки после операции – 2–3 месяца, когда дифференцировка донорских половых клеток уже достигает терминальных стадий сперматогенеза. Делают это с целью получения крупных колоний, которые легче идентифицировать и посчитать, кроме этого, сразу можно оценить и регенеративный потенциал трансплантированных клеток по длине колоний и наличию зрелых половых клеток. Работы, где изучали ранние этапы регенеративного процесса, также проводились, но акцент в них был сосредоточен на количественной оценке динамики пула ССК в канальцах реципиента. В одной из таких работ (Nagano, 2003) было, в частности, показано, что пул ССК после трансплантации в первые дни резко падает, а затем не претерпевает значительных изменений до 14 дня, когда число ССК начинает увеличиваться.
Исходя из этих данных и ряда других работ, начальные этапы восстановления сперматогенеза после трансплантации ССК представлялись следующим образом: трансплантированные ССК вначале перемещаются в нишу, при этом достигают ее только клетки с наибольшим регенеративным потенциалом, а остальные погибают. После этого примерно до 10 дня пул ССК остается неизменным, а затем начинает увеличиваться, и лишь когда количество ССК в канальцах достигает определенного уровня, они вступают в дифференцировку. Исследование Накамуры и соавторов опровергло эти представления и представило новые данные о том, что часть трансплантированных ССК почти сразу начинает вступать в дифференцировку, в результате чего их пул истощается и не достигает необходимого для восстановления фертильности размера, что и является причиной низкой эффективности метода.
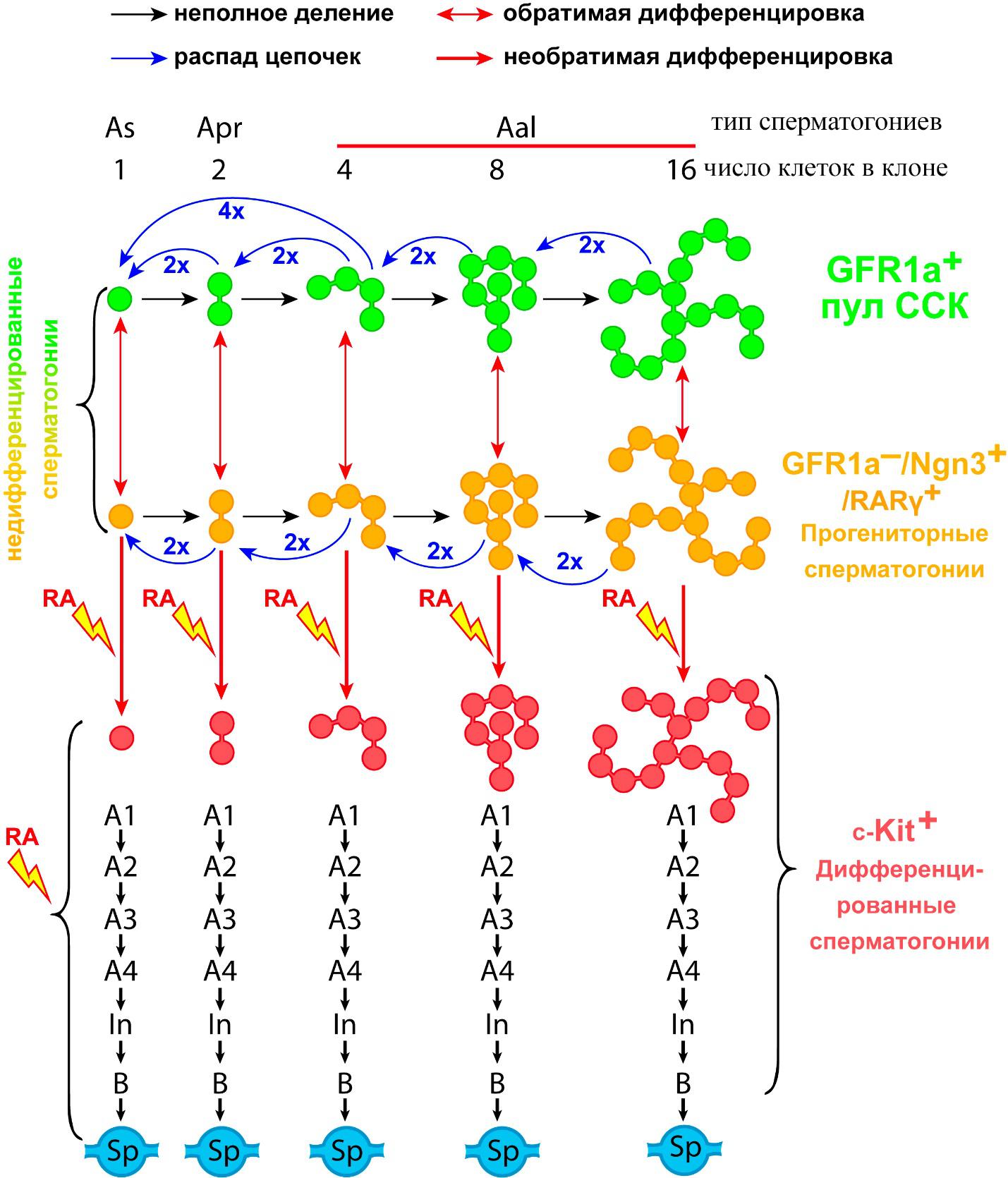
Рис. 2. Клональная иерархическая структура сперматогониального компартмента (пояснения в тексте). Обозначения: As, Apr, Aal – недифференцированные СГ, A1-4, In, B – дифференцированные СГ, Sp – сперматоцит первого порядка на стадии прелептотены, RA – ретиноевая кислота.
Прежде чем перейти к описанию результатов работы необходимо рассмотреть структуру сперматогониального компартмента у мышей (рис. 2). Согласно современным представлениям (Carrieri et al., 2017; Hara et al., 2014; Ikami et al., 2015) пул ССК включает в себя отдельно лежащие СГ клетки (As), спаренные СГ (Apr) и цепочки СГ из 4, 8 и 16 клеток (Aal), экспрессирующие маркер GFRa1 (рецептор глиального нейротрофического фактора). СГ Apr и Aal возникают из As в результате последовательных делений с неполным цитокинезом. Образующиеся цепочки нестабильны и часто распадаются в плоть до отдельных клеток, которые снова могут делиться, образуя новые цепочки. Считается, что все GFRa1+ СГ обладают высоким регенеративным потенциалом при трансплантации. Дифференцируясь, GFRa1+ СГ As, Apr и Aal прекращают экспрессию GFRa1 и начинают экспрессировать маркер прогениторных СГ ген Ngn3 (нейрогенин 3). Ngn3+ клетки, также как и ССК, могут делиться с образованием цепочек большей длинны или распадаться на отдельные клетки или фрагменты.
Как уже было сказано выше, прогениторные СГ в интактном семеннике и при трансплантации могут возвращаться в стволовое GFRa1+/Ngn3- состояние, но потенциал к формированию колоний у них ниже, чем у ССК. Вместе GFRa1+ и Ngn3+ СГ составляют пул недифференцированных СГ.
Следующий этап дифференцировки – превращение Ngn3+ СГ в дифференцированные СГ A1, экспрессирующие маркер c-Kit (тирозин киназный рецептор к фактору стволовых клеток SCF). СГ A1 уже не могут вернуться в стволовое состояние и дифференцируются дальше, делятся митозом еще 6 раз, а затем вступают в прелептотену первого деления мейоза. Переход от недифференцированных СГ к дифференцированным, их последующие деления и вступление в мейоз запускаются ретиноевой кислотой через рецептор RARγ, экспрессия которого появляется у Ngn3+ клеток. В интактном семеннике процессы пролиферации и распада клонов ССК и прогениторных клеток, а также переходы между двумя этими состояниями находятся в равновесии с оттоком клеток в дифференцировку, обеспечивая непрерывность сперматогенного процесса.
В своей работе Накамура и соавторы проанализировали на клональном уровне судьбу GFRa1+ клеток (ССК) и Ngn3+ СГ (прогениторные клетки) по отдельности. Для этого они использовали для трансплантаций две линии трансгенных мышей-доноров, одна из которых несла ген GFP под промотором гена GFRa1, другая Ngn3. Экспрессию трансгена в GFRa1+ и Ngn3+ клетках активировали введением тамоксифена за два дня до выделения клеток в суспензию. В качестве реципиентов были использованы половозрелые самцы дикого типа, собственные половые клетки которых были убиты введением бусульфана за 5 нед. до трансплантации (рис. 3А). В каждый семенник инъецировали по 1×106 клеток не фракционированной суспензии клеток семенника, содержащей 1000 меченных клеток от GFRa1-индуцированных мышей или 2000 клеток от Ngn3-индуцированных мышей. Используемые авторами трансгенные линии мышей обеспечивали экспрессию GFP во всех потомках трансплантированных GFra1+ и Ngn3+ клеток, позволяя следить за их судьбой.
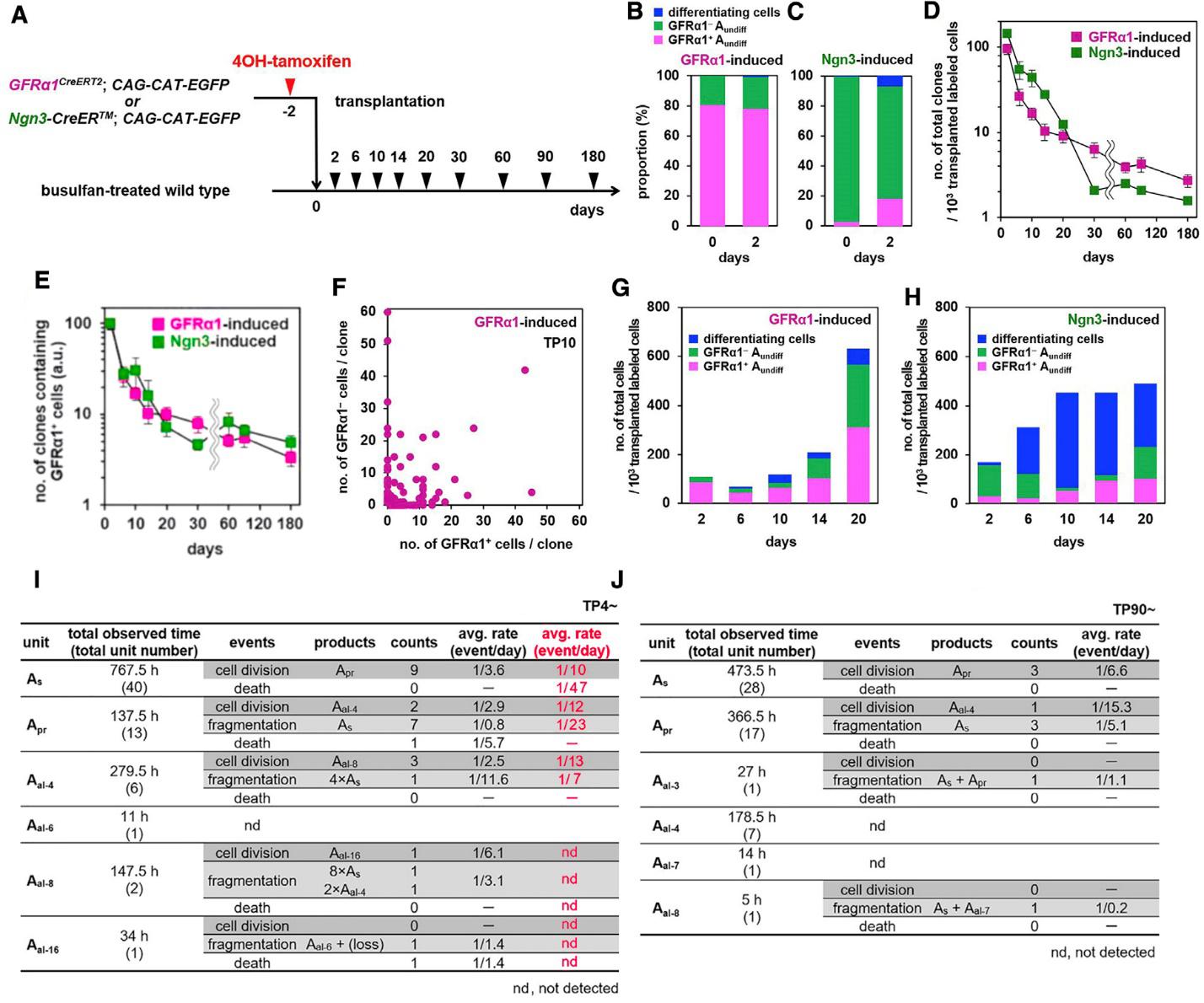
Рис. 3. Результаты трансплантации популяций GFRa1+ и Ngn3+ клеток в семенники мышей, обработанных бусульфаном. А – схема эксперимента и трансгенные линии мышей-доноров клеток. B, C – клеточный состав трансплантируемых GFRa1+ (B) и Ngn3+ (С) суспензий клеток (день 0), а также колоний донорских клеток на 2 день фиксации. D – динамика числа клонов трансплантированных клеток на различные сроки после трансплантации. E – динамика числа клонов, содержащих хотя бы одну ССК в своем составе. F – доля GFRa1+/- клеток в клонах, полученных на 10 день после трансплантации суспензии GFRa1+ клеток. G, H – суммарный клеточный состав клонов на различные сроки после трансплантации GFRa1+ (G) и Ngn3+ (H) клеток. I , J – результаты количественного анализа пролиферативной активности трансплантированных клеток, фрагментации цепочек СГ и клеточной гибели на 4-6 день (I) и 90-92 день (J) после трансплантации, по данным цейтраферной съемки канальцев в культуре (на рис. I красным цветом для сравнения приведены данные, полученные на интактных взрослых мышах (Hara et al., 2014)).
Как видно из рис. 3B и C, на момент трансплантации (день 0) в суспензии от GFRa1-индуцированных мышей примерно 80% клеток экспрессировали GFRa1, то есть были ССК, а в суспензии от Ngn3-индуцированных мышей почти все клетки были GFRa1-- прогениторными СГ. На 2 день после трансплантации в случае GFRa1-мышей ситуация не менялась – 80% GFP+ клеток были ССК (рис. 3B). В случае Ngn3-мышей ~20% GFP+ клеток были GFRa1+ (рис. 3C). Эти 20% клеток возникали из Ngn3+ прогениторных СГ, вернувшихся к стволовому состоянию, и именно эти клетки в дальнейшем давали начало всем половым клеткам донора в этом варианте трансплантации. Согласно подсчетам, на этот срок примерно 10% трансплантированных клеток, как GFRa1+, так и Ngn3+, приживались и формировали клоны в семенниках реципиента (рис. 3D). Но их число сильно снижалось в течении первой недели после трансплантации (высокая гибель трансплантированных клеток), так что на поздние сроки в семенниках оставались лишь единичные крупные колонии, содержащие все типы дифференцирующихся половых клеток. Массовая гибель большинства клонов вскоре после трансплантации связана с тем, что только в немногих из них сохраняется достаточное для поддержки дифференцировки количество GFRa1+ ССК (рис. 3E). Эти данные хорошо согласуются с результатами предыдущих исследований.
Важным отличием было то, что с самых ранних сроков фиксации в колониях вместе с отдельными клетками присутствовали цепочки СГ GFRa1+ различной длины. Так как при выделении клеток в суспензию все цепочки разваливаются на отдельные клетки, обнаруженные СГ Apr и Aal могут возникать только в результате деления СГ As, что противоречит старым представлениям об их делении только с полным цитокинезом на ранние сроки после трансплантации. Далее, как видно из рис. 3F, уже на 10 день фиксации в большинстве колоний, полученных после трансплантации клеток от GFRa1-индуцированных мышей, присутствовали как GFP+/GFRa1+ ССК, так и GFP+/GFRa- прогениторные СГ. Так как каждая такая колония возникала из одной, трансплантированной GFP+ клетки, а на 2 день, как было сказано выше, 80% из них были GFRa1+, то это говорит о том, что по крайней мере часть GFP+ прогениторных СГ возникала в результате дифференцировки трансплантированных ССК. Вместе эти данные указывают на то, что трансплантированные ССК не только активно пролиферируют в семенниках реципиента, но и дифференцируются, начиная с самых ранних сроков после трансплантации, что контрастирует с результатами работы Нагано (Nagano, 2003) упомянутыми ранее.
Интересно, что динамика изменения количества GFRa1+ ССК, показанная Накамурой и соавторами при обоих вариантах трансплантации, была схожа с данными, полученными Нагано: число ССК до 10 дней значительно не изменялось и начинало расти к 14 дню после трансплантации (рис. 3G, H). Но такое поведение ССК объясняется не отсутствием пролиферации, как полагал Нагано, а следствием уравновешивающих друг друга процессов пролиферации ССК с одной стороны и их дифференцировки и гибели с другой.
Для подтверждения полученных данных авторы проследили за судьбой отдельных клонов клеток в реальном времени с помощью цейтраферной съемки канальцев с трансплантированными половыми клетками в культуре. Подобные эксперименты ранее были проделаны Хара с соавторами (Hara et al., 2014) на интактных половозрелых мышах, экспрессирующих GFP под промотором гена GFRa1. Эти авторы впервые показали сложную динамику пролиферации, распада и перемещения цепочек ССК в семенниках взрослых мышей. Хара и соавторы также посчитали с какой вероятностью совершаются эти процессы при нормальном течении сперматогенного процесса. Как видно из представленных Накамурой и соавторами видео (Видео 1 - миграция GFRa1+ СГ; Видео 2 - последовательные деления с неполным цитокинезом GFRa1+ клеток; Видео 3 - фрагментация цепочек GFRa1+ СГ), ССК сразу после трансплантации (4-6 день) ведут себя как клетки в интактном семеннике и постоянно переходят от одиночных клеток к синцитиальному состоянию и обратно, но делают это с большей скоростью, демонстрируя при этом частую гибель клеток (рис. 3I), не характерную для интактного семенника. Анализ колоний на позднем сроке фиксации (90 дней), напротив, показал, что параметры пролиферации, фрагментации и гибели уже соответствовали таковым в интактном семеннике (рис. 3J). То есть наступил баланс между процессами самообновления и дифференцировки ССК, характерный для сперматогенеза в интактном семеннике.
В своей работе Хара и соавторы сделали предположение, что сложная динамика клонов ССК может быть смоделирована как стохастический процесс (подробно см. Hara et al., 2014; Klein et al., 2010). При этом достаточно учитывать только данные о скорости пролиферации ССК, фрагментации цепочек, вероятности вступления в дифференцировку, гибели и миграции в соседнюю область, а взаимодействие ССК и их микроокружения анализировать не нужно. Созданная модель показала высокую сходимость с экспериментальными наблюдениями, подтверждая сделанное предположение.
Накамура и соавторы решили проверить, будут ли результаты моделирования регенеративного процесса также соответствовать экспериментальным данным. В качестве начального состояния системы были взяты концентрации GFRa1+/- клеток на 2 день после трансплантации, а в качестве начальных вероятностных коэффициентов перечисленных выше процессов – результаты, полученные при цейтраферной съемке. Как видно из рис. 4A, B, модель не только хорошо описывает динамику изменения суммарного размера клонов (A), но и изменение их клеточного состава (B) с течением времени после трансплантации GFRa1-индуцированных клеток. Полученные результаты показывают, что регенеративный процесс в семенниках после трансплантации ССК, равно как и поведение ССК в интактном семеннике, определяются простым выбором судьбы эквипотентных ССК без учета влияния на них окружения. Из этого также следует, что увеличить концентрацию ССК в семеннике и добиться формирования большего числа колоний можно подавив процесс дифференцировки ССК на раннем сроке после трансплантации.
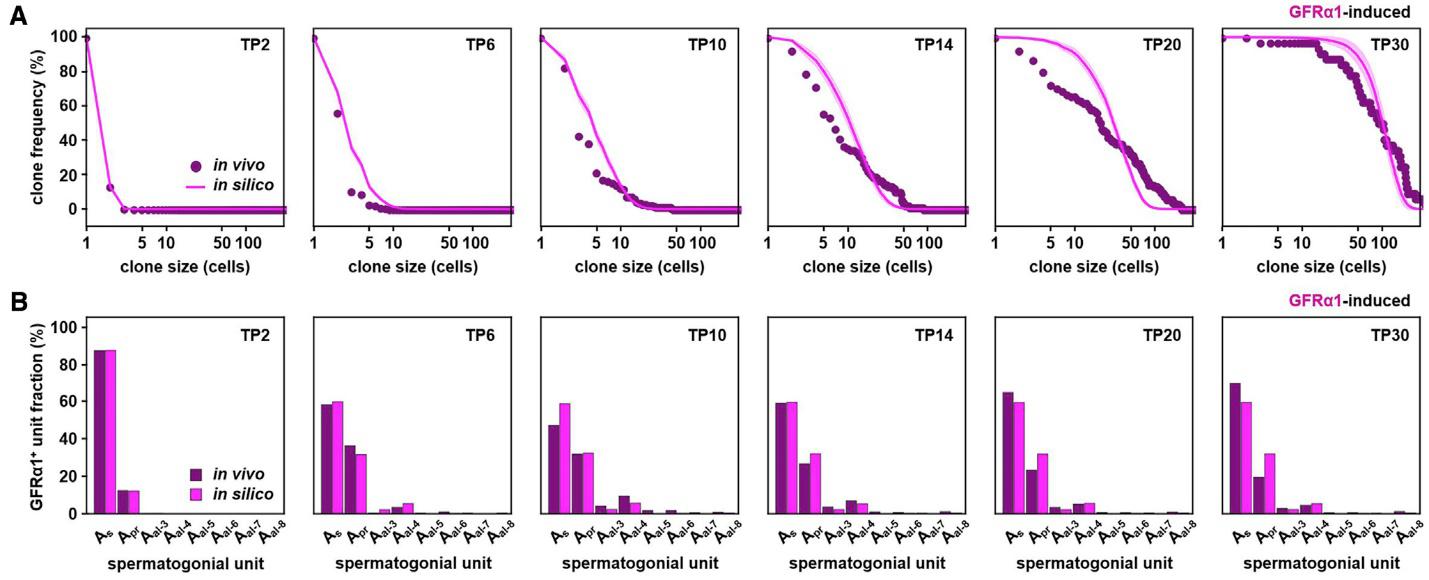
Рис. 4. Результаты моделирования регенеративного процесса после трансплантации GFRa1+ суспензии клеток. A – динамика изменения суммарного размера клонов на различные сроки после трансплантации, B – динамика изменения суммарного клеточного состава клонов.
Добиться этого можно вводя реципиентам WIN18,446 – химический ингибитор синтеза ретиноевой кислоты, которая, как указано выше, приводит к необратимой дифференцировке прогениторных СГ. Согласно представлениям о существовании баланса между процессами самообновления пула ССК и оттоком клеток в дифференцировку, блокирование последнего процесса должно увеличить пул недифференцированных клеток. На рис. 5A представлена схема этого эксперимента, для эффективного подавления выработки ретиноевой кислоты мышам-реципиентам за два дня до трансплантации клеток начинали вводить WIN и продолжали еще 10 дней. Контрольной группе реципиентов вводили растворитель (DMCO). Оказалось, что доля GFRa1+ ССК в колониях (рис. 5B, C), а также доля колоний, содержащих стволовые клетки (рис. 5D, E), значительно увеличивались на 20 день после трансплантации, по сравнению с контролем, как в случае введения клеток от GFRa1-, так и от Ngn3-индуцированных мышей. Это приводило к увеличению общего числа выживающих клонов по сравнению с контролем (рис. 5F), но число GFRa1+ клеток на один клон, а также длина колоний оставались неизменными (рис. 5G, H). Таким образом, подавление вступления ССК в дифференцировку в первые 10 дней после трансплантации приводит к увеличению количества колоний в семенниках реципиентов на поздние сроки фиксации.
В еще одном эксперименте Накамура и соавторы проверили, будет ли введение WIN приводить к восстановлению фертильности при трансплантации. В качестве доноров в этот раз они использовали мышей, экспрессирующих GFP во всех клетках организма. Было поставлено 3 независимых эксперимента, в каждом из которых клетки вводили 4 самцам,
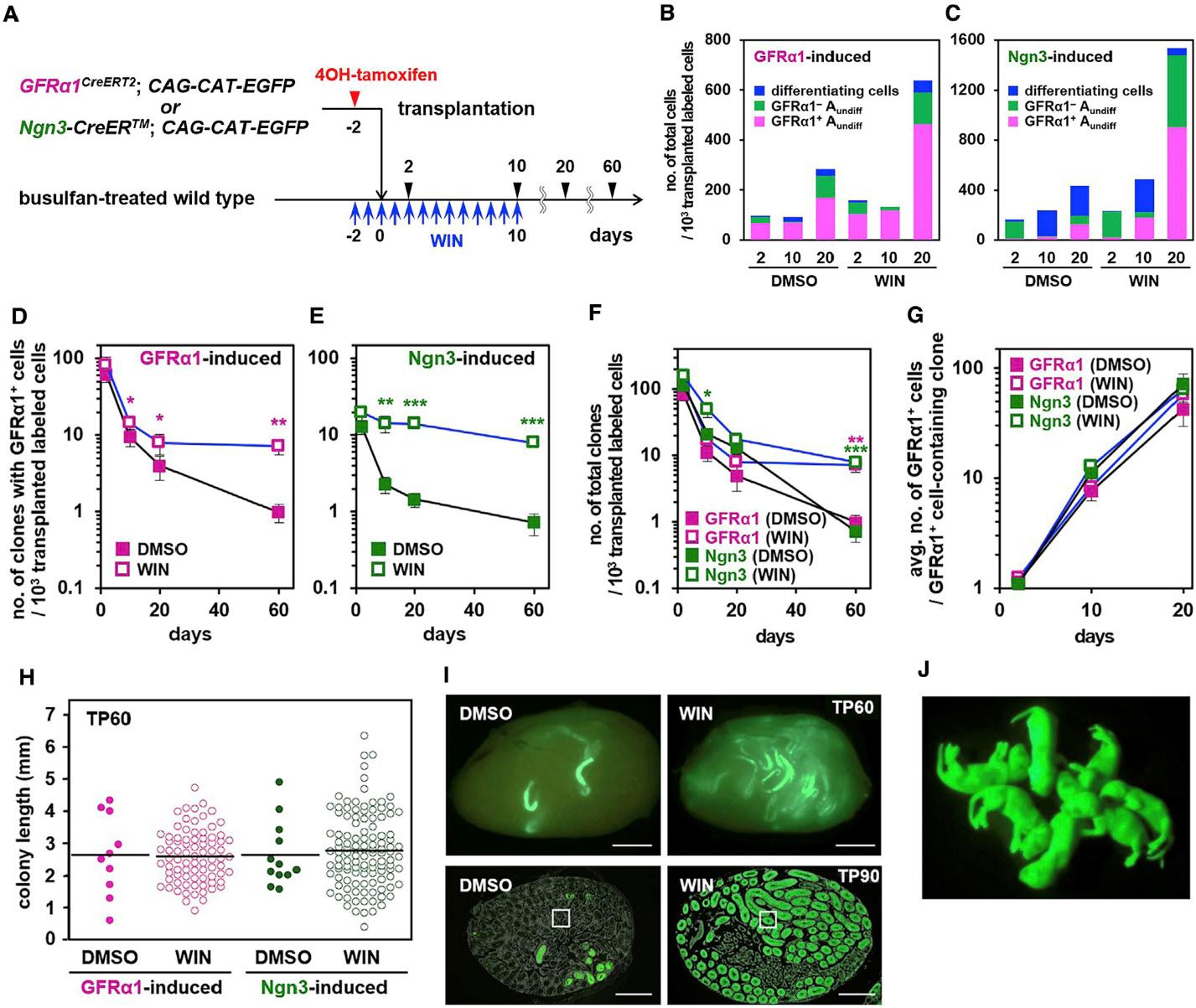
Рис. 5. Результаты трансплантации популяций GFRa1+ и Ngn3+ клеток в семенники мышей, обработанных бусульфаном, на фоне введения антагониста синтеза ретиноевой кислоты. Обозначения: DMCO – контрольная группа животных, которым вводили растворитель, WIN – опытная группа, которой вводили антагонист WIN. A – схема эксперимента и трансгенные линии мышей-доноров, B, C – суммарный клеточный состав клонов на различные сроки после трансплантации GFRa1+ (G) и Ngn3+ (H) клеток. D, E – динамика изменения числа клонов, содержащих хотя бы одну ССК в своем составе, после трансплантации GFRa1+ (D) и Ngn3+ (E) клеток. F – динамика общего числа клонов после трансплантации GFRa1+ и Ngn3+ клеток. G – динамика числа GFRa1+ клеток в расчете на клон после трансплантации GFRa1+ и Ngn3+ клеток. H – длина колоний в мм на 60 день после трансплантации GFRa1+ и Ngn3+ клеток, I – вверху репрезентативные фотографии целых семенников контрольной и опытной группы животных на 60 день после трансплантации, внизу срезы семенников на 90 день фиксации (зеленым цветом показаны трансплантированные клетки). J – GFP+ трансгенное потомство, полученное от самцов опытной группы.
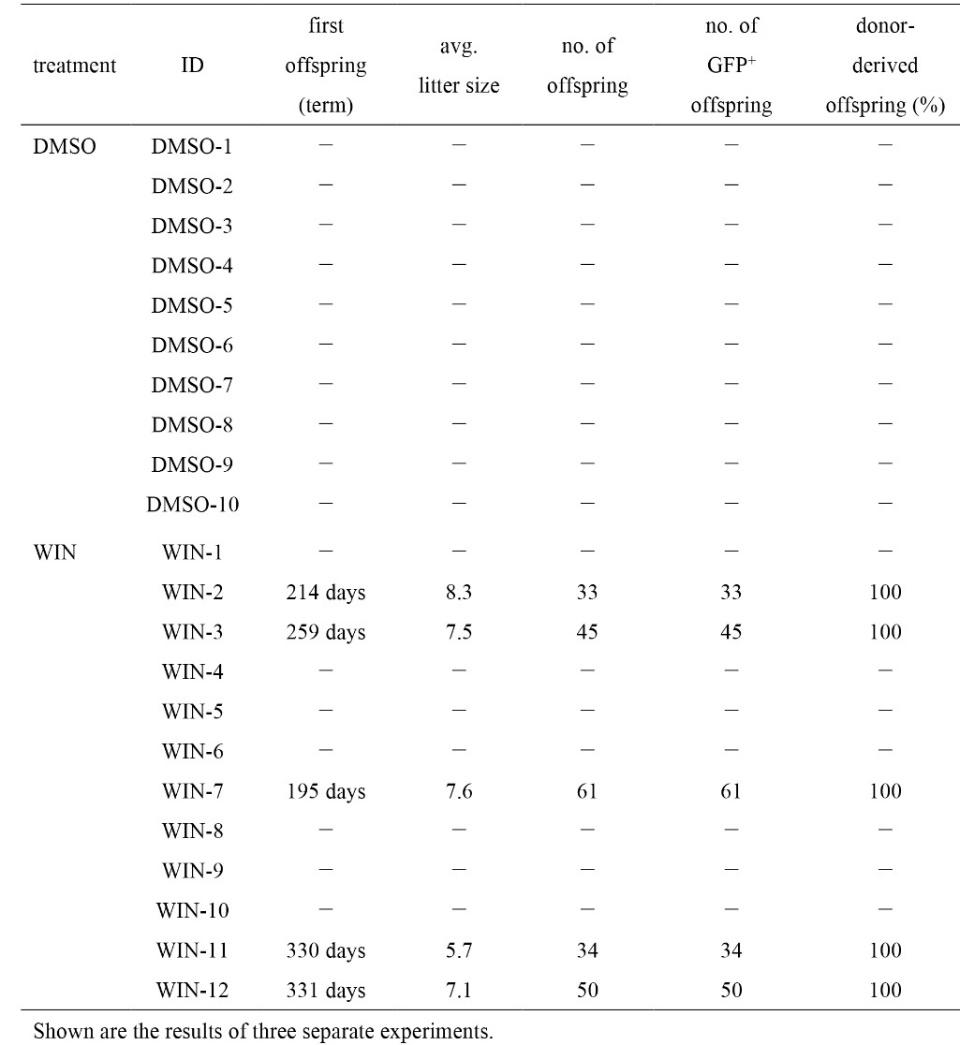
обработанным бусульфаном, которым за два дня до трансплантации начинали вводить WIN. Введение антагониста продолжали до 10 дня после трансплантации клеток. Как видно из рис. 5I, на 60 и 90 дни фиксации количество окрашенных на GFP колоний в опытных семенниках гораздо больше, чем в контрольных. Из 10 прооперированных животных в контрольной группе в течение всего времени наблюдения ни один самец не дал потомства, в опытной группе потомков удалось получить от 7 из 12 животных (Рис. 5J). При этом наступление фертильности в лучшем из экспериментов наблюдалось на сроке в 6,5 мес после трансплантации клеток (таблица). Авторы отмечают, что трансгенные потомки были не только жизнеспособны, но и фертильны, показывая, что развитие половых клеток после трансплантации идет без нарушений.
Таблица. Статистика получения трансгенных потомков от контрольной и опытной групп мышей после трансплантации суспензии половых клеток.
Наконец, как отмечают авторы в конце статьи, представленную ими методику можно еще улучшить в дальнейших экспериментах, если не только подавлять вступление ССК в дифференцировку, но и стимулировать их пролиферацию, трансформацию прогениторных клеток в ССК и подавлять клеточную гибель.
Список литературы
Brinster R.L., Avarbock M.R. Germline transmission of donor haplotype following spermatogonial transplantation.//Proc. Natl. Acad. Sci. USA. 1994; V.91: P.11303-11307. doi: 10.1073/pnas.91.24.11303.
Brinster R.L., Zimmermann J.W. Spermatogenesis following male germ-cell transplantation. // Proc. Natl. Acad. Sci. USA. 1994; V.91: P.11298-11302. doi: 10.1073/pnas.91.24.11298.
Brinster R.L. Germline stem cell transplantation and transgenesis.// Science. 2002; V.296: P.2174-2176. doi: 10.1126/science.1071607.
Shetty G., Wu Z., Lam T.N.A, Phan T.T., Orwig K.E., Meistrich M.L. Effect of hormone modulations on donor-derived spermatogenesis or colonization after syngeneic and xenotransplantation in mice.// Andrology. 2019 V.7(2): P.257-265. doi: 10.1111/andr.12571.
Nagano M.C. Homing efficiency and proliferation kinetics of male germ line stem cells following transplantation in mice.// Biol. Reprod. 2003; V.69: P.701-707. doi: 10.1095/biolreprod.103.016352.
Carrieri C., Comazzetto S., Grover A., Morgan M., Buness A., Nerlov C., O’Carroll D. A transit-amplifying population underpins the efficient regenerative capacity of the testis.// J. Exp. Med. 2017; V.214: P.1631-1641. doi: 10.1084/jem.20161371.
Hara K., Nakagawa T., Enomoto H., Suzuki M., Yamamoto M., Simons B.D., Yoshida S. Mouse spermatogenic stem cells continually interconvert between equipotent singly isolated and syncytial states.// Cell Stem Cell. 2014; V.14: P.658-672. doi: 10.1016/j.stem.2014.01.019.
Ikami K., Tokue M., Sugimoto R., Noda C., Kobayashi S., Hara K., Yoshida S. Hierarchical differentiation competence in response to retinoic acid ensures stem cell maintenance during mouse spermatogenesis. //Development. 2015; V.142: P.1582-1592. doi: 10.1242/dev.118695.
Klein A.M., Nakagawa T., Ichikawa R., Yoshida S., Simons B.D. Mouse germ line stem cells undergo rapid and stochastic turnover.// Cell Stem Cell. 2010; V.7: P.214-224. doi: 10.1016/j.stem.2010.05.017.
Новость подготовил © 27.01.2022 Кулибин А.Ю.