 © Никишин Денис Александрович
научный сотрудник лаборатории проблем регенерации (группа эмбриофизиологии), кандидат биологических наук.
© Никишин Денис Александрович
научный сотрудник лаборатории проблем регенерации (группа эмбриофизиологии), кандидат биологических наук.
В апреле 2016 года в Мексике родился ребенок от трех родителей. Мать ребенка является носительницей тяжелого наследственного заболевания, связанного с мутацией в митохондриальной ДНК (мтДНК) и поэтому неизбежно передающегося по материнской линии, от матери к ребенку. Родители прибегли к помощи так называемых трёхродительских вспомогательных репродуктивных технологий с использованием донорской яйцеклетки с нормальными митохондриями. Степень тяжести митохондриального заболевания зависит от уровня гетероплазмии – генетической разнородности популяции митохондрий в организме или конкретной ткани. Как показали генетические анализы, у мальчика остался 1% материнских мутантных митохондрий. Важно понять, какие последствия может нести эта остаточная популяция материнских мутантных митохондрий в перспективе.
Технология митохондриального замещения (mitochondrial replacement therapy, MRT) отработана на макаках, для которых получены здоровое потомство, и на человеческих донорских ооцитах, которые в случае оплодотворения развиваются до стадии бластоцисты. В обоих исследованиях, выполненных под руководством доктора Орегонского университета Шукрата Металипова, применялась методика переноса мейотического веретена из ооцитов женщин, несущих мутации в мтДНК, в энуклеированные здоровые донорские яйцеклетки с последующей процедурой оплодотворения in vitro. Другая методика, разработанная британским коллективом, предполагает оплодотворение ооцита, несущего мутантную мтДНК, за которым следует перенос пронуклеусов в энуклеированную донорскую зиготу, содержащую здоровые митохондрии. Британский метод имеет несколько более высокие показатели выживаемости зигот, однако американский подход оказался более приемлимым с религиозной точки зрения, так как не предполагает использование эмбрионов.
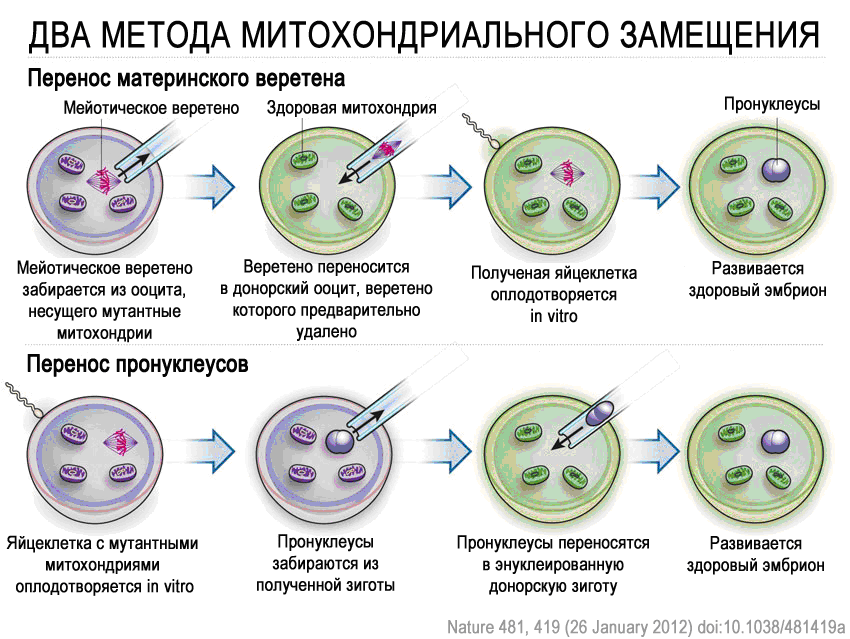 |
В статье, опубликованной в журнале Nature, американские ученые и их коллеги продемонстрировали, что ядерная ДНК из человеческих ооцитов женщин-носительниц наследственных митохондриальных заболеваний (синдром Лея и синдром MELAS), для которых было подтверждено материнское наследование и установлены соответствующие мутации в мтДНК, может быть перенесена в здоровую энуклеированную яйцеклетку и затем успешно оплодотворена методом ИКСИ. Из восьми нормально оплодотворенных ооцитов шесть успешно развились до стадии бластоцисты, что сравнимо с контрольными экспериментами. В данной работе представленность мутантной мтДНК в ооцитах женщин-носительниц митохондриальных заболеваний варьировала в очень широких пределах от 0,6 до 96%. Авторы подчеркивают важность подтверждения митохондриального наследования заболевания генотипированием, причем, учитывая, что уровень гетероплазмии может сильно различаться в разных тканях, авторы отмечают важность проведения генетического анализа нескольких типов клеток как донора, так и реципиента.
В связи с тем, что часть материнских мутантных митохондрий может попасть в донорский энуклеированный ооцит (цитопласт) вместе с мейотическим веретеном (кариопластом) матери, Миталипов с коллегами проверил отношение донорской мтДНК к материнской в трехродительских эмбрионах, которое оказалось более 99% во всех случаях. Сходный результат наблюдался и в 13 из 15 линий эмбриональных стволовых клеток (ЭСК), полученных из экспериментальных бластоцист. Однако, в двух линиях ЭСК, процент материнской мутантной мтДНК был очень высок (81-94%) и увеличивался в ходе культивирования, что в конце концов привело к полному вытеснению донорской мтДНК. Команда показала, что такой возврат к материнскому митохондриальному гаплотипу не является уникальным свойством ЭСК, а также происходит и в дифференцированных клетках, поэтому может иметь место и в клетках детей, полученных с использованием MRT. Стоит отметить, что в некоторых случаях происходит, наоборот, полная элиминация материнской мутантной мтДНК.
Исследуя пути, которыми клетки со смешанным гаплотипом могут со временем приобретать гомогенный, авторы заметили, что возврат к материнскому состоянию связан с полиморфизмом в некодирующей области мтДНК (CSBII), которая влияет на репликацию. Выяснилось, что отдельные варианты последовательностей этой области мтДНК наделяют митохондрии репликативными преимуществами по сравнению с другими. Более того, клоны ЭСК, несущие эти варианты, обладают более высокими показателями пролиферативной активности. В смешанной клеточной популяции с разным уровнем гетероплазмии клетки, несущие этот вариант в большем числе копий, будут постепенно обгонять соседей в темпах роста, а это значит, что в подобном случае материнская мтДНК может со временем вытеснить донорскую. Очевидно, что единственным способом избежать опасности возврата к материнскому мутантному гаплотипу после процедуры MRT является тщательный подбор совместимого донора, митохондрии которого обладают репликативными преимуществами по сравнению с материнскими.
Однако механизмы описанного вытеснения полностью не ясны, в частности неизвестно, какие еще полиморфные варианты участков мтДНК могут повлиять на конкурентную эффективность ее репликации. При этом авторы сами отмечают основной недостаток своей работы – крайне маленькая (4 женщины) и очень разнородная выборка, что впрочем является обычной проблемой медицинских исслелований редких заболеваний. Поэтому, прежде чем технология MRT придет в репродуктивную медицину, явление требует дальнейшего масштабного исследования.
Новость подготовил © 2016 Никишин Денис Александрович.
25.12.2016