- Environmental stresses induce transgenerationally inheritable survival advantages via germline-to-soma communication in Caenorhabditis elegans. Kishimoto S, Uno M, Okabe E, Nono M, Nishida E. Nat Commun. 2017 Jan 9;8:14031. doi: 10.1038/ncomms14031. PMID:28067237
- Caenorhabditis elegans sperm carry a histone-based epigenetic memory of both spermatogenesis and oogenesis.
Tabuchi TM, Rechtsteiner A, Jeffers TE, Egelhofer TA, Murphy
CT, Strome S. Nat Commun. 2018 Oct 17;9(1):4310. doi: 10.1038/s41467-018-06236-8. PMID: 30333496 - Epigenetic Transgenerational Inheritance of Altered Sperm Histone Retention Sites. Ben Maamar M, Sadler-Riggleman I, Beck D, Skinner MK. Sci Rep. 2018 Mar 28;8(1):5308. doi: 10.1038/s41598-018-23612-y. PMID: 29593303
 © Михайлов Виктор Сергеевич, доктор биологических наук, профессор. Главный научный сотрудник ИБР РАН. Область научных интересов: биология развития, физико-химическая биология.
© Михайлов Виктор Сергеевич, доктор биологических наук, профессор. Главный научный сотрудник ИБР РАН. Область научных интересов: биология развития, физико-химическая биология.
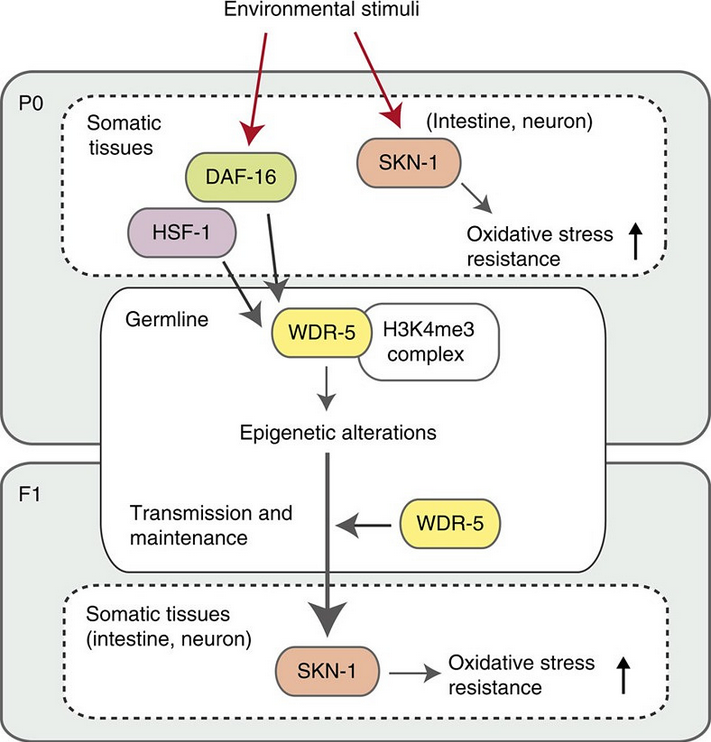
Итак, благоприобретенные признаки наследуются. Однако далеко не все, и, возможно, на протяжении всего нескольких генераций. Очевидно, что такое наследование связано с эпигенетикой, но конкретные механизмы оставались до недавнего времени неизвестными. Значительный прогресс в понимании эпигенетических механизмов достигнут в последние годы усилиями нескольких исследовательских групп (refs. 1-3). Давно было описано явление индуцированной толерантности, когда умеренное тепловое воздействие на организм животного, будь то примитивный червь, муха или млекопитающее, вызывает его повышенную устойчивость к последующему летальному воздействию температуры. На самом деле, после однократного воздействия у животных развивается неспецифическая толерантность к разного рода стрессам, вызванным температурой, гипоксией или токсическими веществами. Это явление называется в англоязычной литературе как «hormesis». В недавней работе на C. elegans (ref. 1) показано, что повышенная устойчивость к солям мышьяка, осмотическому стрессу и голоду сохраняется не только у самих подвергнутых стрессу особей (P0) в течение их жизни, но у F1 и F2 потомков. Для развития толерантности требуется активность в соматических клетках транскрипционного фактора SKN-1 (гомолог NRF2), участвующего в ответе на оксидативный стресс, а передача приобретенного признака потомкам зависит от активности двух других транскрипционных факторов, HSF1 (регулятор белков теплового шока) и DAF16 (регулятор инсулинового ростового фактора IGF). Активация этих факторов в соматических клетках программирует в хроматине спермиев и ооцитов метилирование гистонов комплексом H3K4me3, что обеспечивает повышенный уровень экспрессии этих факторов в клетках эмбриона и последующее репрограммирование генома в половых клетках потомка. При этом передача признака толерантности происходит как по материнской, так и по отцовской линии. Рисунок иллюстрирует предложенную авторами модель трансгенерационной передачи приобретенного признака (WDR-5 – субъединица комплекса H3K4me3).
Эпигенетическим кодом для модификации гистонов в половых клетках нематоды служит комбинации активирующих сигналов H3K4me3 и H3K36me3 и репрессирующего сигнала H3K27me3 (ref. 2). В ооцитах и спермиях нематоды, помимо генов специфичных для гаметогенеза, экспрессируется набор генов с одинаковой эпигенетической маркировкой гистонов. Именно гены с модифицированными гистонами могут участвовать в репрограммировании хроматина в половых клетках потомков. Правильная эпигенетическая маркировка хроматина в спермиях обеспечивает фертильность потомков. Удаление («стирание») кода метилирования в хроматине спермиев приводит к рождению стерильных особей. Так происходит передача приобретенных признаков по отцовской линии у нематоды и рыб (zebra fish), у которых хроматин в спермиях имеет обычную нуклеосомную структуру. Но в спермиях млекопитающих гистоны на 90-99% замещаются протамином. Функционирует ли в спермиях млекопитающих эпигенетический гистоновый код? По всей видимости, да. Отдельные домены хроматина в спермиях млекопитающих сохраняют нуклеосомы с метилированными H3K4 и H3K27. Показано, что крысы тоже передают потомкам индуцированную толерантность к стрессам путем изменения «гистонового кода» в спермиях (ref. 3). Дополнительно млекопитающие приобрели в эволюции энзиматическую систему метилирования цитозина в ДНК, что позволяет им более тонко регулировать передачу эпигенетической информации.
Какие выводы? Наверное, действительно стоит делать зарядку и заниматься закаливанием. И лучше начать до рождения детей.
Новость подготовил © Михайлов В.С.
26.11.2018