Lorna A. Farrelly, Robert E. Thompson, Shuai Zhao, Ashley E. Lepack, Yang Lyu, Natarajan V. Bhanu, Baichao Zhang, Yong-Hwee E. Loh , Aarthi Ramakrishnan, Krishna C. Vadodaria, Kelly J. Heard, Galina Erikson, Tomoyoshi Nakadai, Ryan M. Bastle, Bradley J. Lukasak, Henry Zebroski III, Natalia Alenina , Michael Bader, Olivier Berton, Robert G. Roeder, Henrik Molina, Fred H. Gage, Li Shen, Benjamin A. Garcia, Haitao Li , Tom W. Muir & Ian Maze. “Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3.” Nature 2019
https://doi.org/10.1038/s41586-019-1024-7
Evgeny Ivashkin, Victoria Melnikova, Anastasia Kurtova, Nadja R. Brun, Alexandra Obukhova, Marina Yu. Khabarova, Alexander Yakusheff, Igor Adameyko, Kristin E. Gribble, and Elena E. Voronezhskaya. “Transglutaminase activity determines nuclear localization of serotonin immunoreactivity in the early embryos of invertebrates and vertebrates.” ACS Chemical Neuroscience, 2019
DOI: 10.1021/acschemneuro.9b00346



|
|
© Воронежская Елена Евгеньевна, доктор биологических наук, главный научный сотрудник, заведующий лабораторией сравнительной физиологии развития ИБР РАН.
© Ивашкин Евгений Геннадьевич, кандидат биологических наук, Postdoctoral Scientist, Marine Biological Laboratory, USA. © Якушев Александр Сергеевич, выпускник кафедры зоологии беспозвоночных МГУ, выполнял дипломную работу в ИБР РАН. |
С момента открытия серотонина в конце 40-х – начале 50-х годов прошлого века, ученые нашли огромное количество физиологических функций, в которых он так или иначе задействован. У человека это такие жизненно важные процессы, как регуляция сна и бодрствования, агрессия и тревожность, пищеварение, воспаление и многое другое. Исследованию механизмов действия серотонина уделялось значительное внимание. На сегодня изучены на молекулярном уровне процессы синтеза и деградации серотонина, его транспорта в клетку, упаковка и выброс из везикул, особенности работы множества рецепторов к серотонину и их ответ на связывание с лигандом. Казалось бы, серотонинергическая система, отвечающая за реализацию определенных серотонин-опосредованных процессов, изучена доскональным образом. Неужели можно добавить что-то новое к огромному пласту знаний, собранных за почти 100 лет исследований, про это замечательное вещество? Оказалось, что можно.
Эта история началась с открытия в 2003 г серотонилирования – процесса ковалентного присоединения серотонина к остаткам глутаминов в белках в результате реакции трансамидирования (Walther et al., Cell, 2003). Эта реакция происходит с помощью давно известного другими своими важными функциями фермента – трансглутаминазы. Начиная с этого момента были получены данные о роли серотонилирования (а как выяснилось позже, и моноаминилирования, так как не только серотонин, но и другие первичные биогенные моноамины, такие как гистамин или катехоламины, могут выступать субстратом для трансглутаминазы) в самых разных физиологических процессах, от свертываемости крови до выброса инсулина из островков Лангерганса (обзор Muma and Mi, ACS Chem Neurosci, 2015). Сотрудники Института биологии развития РАН тоже внесли свою лепту, показав функциональную роль серотонилирования в регуляции процессов развития. Оказалось, что серотонилирование белков на очень ранних, донервных стадиях развития, может управлять темпами роста зародыша, а также реализацией поведенческих программ у ювенильных особей пресноводных моллюсков (Ivashkin et al., Cell Reports, 2015). Однако, что это за белки, и каким образом сигнал от стадии дробления сохраняется и передается дифференцирующимся нейронам нервной системы, формирующим нервные сети, которые в свою очередь обеспечивают реализацию найденных эффектов, оставалось непонятным.
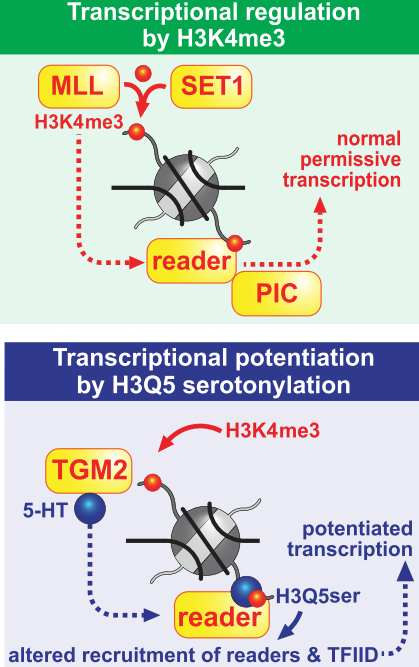
В 2019 г группа Ина Мейза (Farrelli et. al, Nature, 2019) обнаружила, что в серотонинергических нейронах серотонин связывается с гистоном 3 (H3). Серотонилирование пятого остатка глутамина регулирует способность Н3 связываться с важным транскрипционным фактором TFIID, что в свою очередь определяет уровень активации нейрональных генов (Рис. 1). Клетки с мутацией в H3, в результате которой белок не может присоединять серотонин, снижают способность к дифференцировке в зрелые серотонинергические нейроны. Эта работа впервые доказала, что серотонин может напрямую действовать на ядерные белки в клетках. А происходит ли нечто подобное в эмбриональном развитии?
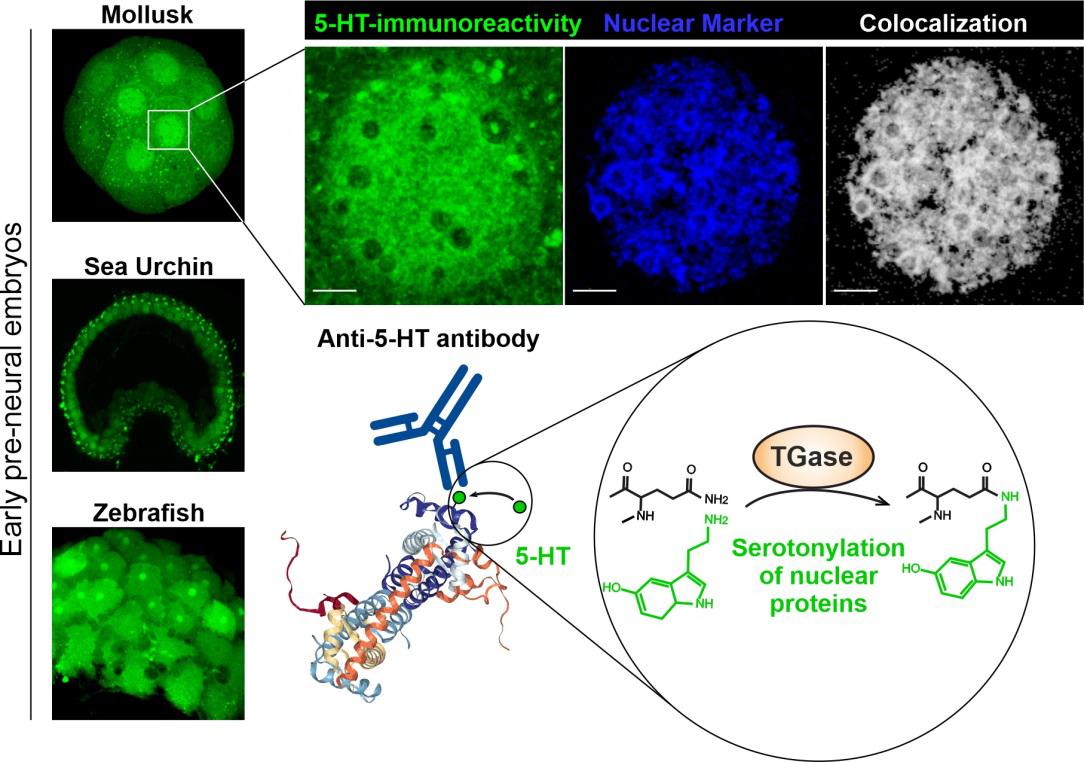
В то время, когда статья про серотонилирование ядерных белков в нейронах появилась в печати, в журнале ACS Chemical Neuroscience завершалась рецензия работы, выполненной на дробящихся бластомерах морского ежа, моллюска большого прудовика и костистой рыбы данио сотрудниками лаборатории сравнительной физиологии развития ИБР РАН, совместно с коллегами из США и Швеции. Они показали, что серотонилированные белки обнаруживаются в ядрах дробящихся бластомеров у всех исследованных животных (Рис. 2). Причем паттерн распределения таких белков в ядрах клеток динамически меняется в зависимости от того, какой уровень серотонина попадает в развивающийся зародыш (Ivashkin et al., ACS Chemical Neuroscience, 2019). То есть, серотонилирование ядерных белков происходит не только в специфических нейронах, но и в плюрипотентных клетках эмбриона, каждая из которых даёт начало огромному набору тканей организма в будущем. Таким образом, уже на самых ранних этапах развития этот механизм может регулировать уровень экспрессии конкретных генов, специфически меняя темпы дифференцировки самых разных клеток. Вполне вероятно, что это и приводит в результате к изменениям в структуре нервных сетей, вызывая, таким образом, сдвиги в поведении.
Можно считать, что две перечисленные работы открывают новую страницу в исследовании обнаруженного неканонического пути действия серотонина через серотонилирование ядерных белков. Становится понятным, в каком месте искать механизм, лежащий в основе отставленных долговременных эффектов серотонина, которые невозможно было объяснить, основываясь только на его рецепторных функциях. Возможно, что именно этот механизм является причиной ряда распространённых врождённых заболеваний, а дальнейшие исследования помогут предложить новые направления в стратегиях их лечения и профилактики, начиная с самых ранних дней жизни.
|
| Рис 1. Модель влияния серотонилирования глутамина 5 (Q5ser) в гистоне 3 на K4me3-опосредованную экспрессию генов. Наличие серотонилированного H3K4me3Q5ser изменяет его взаимодействие с определёнными белками, такими, как комплекс транскрипционного фактора TFIID. Это приводит к усилению или стабилизации TFIID-опосредованной экспрессии генов в нейронах млекопитающих.
(Из статьи Farrelly et al., Nature 2019 https://doi.org/10.1038/s41586-019-1024-7) |
|
| Рис. 2. Антитела к серотонину выявляют специфические белки в ядрах дробящихся клеток зародышей моллюска, морского ежа и данио. Уровень иммунореактивности зависит как от концентрации серотонина, так и от активности трансглутаминазы в клетках.
(Из статьи Ivashkin et al., 2019 DOI: 10.1021/acschemneuro.9b00346) |
Новость подготовили:
© 26.09.2019 Воронежская Е.Е., Ивашкин Е.Г., Якушев А.С.