Комментарий к статье: Antonio E Paniagua, Alicia Segurado, Jorge F Dolón, Julián Esteve-Rudd, Almudena Velasco, David S Williams, Concepción Lillo (2021). Key role for CRB2 in the maintenance of apicobasal polarity in retinal pigment epithelial cells. Front. Cell Dev. Biol. 9:701853. doi: 10.3389/fcell.2021.701853
 © Кузнецова Алла Викторовна, старший научный сотрудник лаборатории проблем регенерации, канд. мед. наук.
© Кузнецова Алла Викторовна, старший научный сотрудник лаборатории проблем регенерации, канд. мед. наук.Область научных интересов: межклеточные и клеточно-матриксные взаимодействия, дедифференцировка, эпителиально-мезенхимальный переход.
Полярность клеток является ключевой характеристикой многих типов клеток, которая заключается в асимметричном распределении органелл, молекул и белков, входящих в состав различных структур, внутри клетки. Эпителиальные клетки обладают особой категорией полярности, называемой апико-базальной полярностью, которая необходима для барьерной функции эпителия. Апико-базальная полярность устанавливается во время процесса дифференцировки за счет активности трех различных белковых комплексов: комплекса Par, комплекса Crumbs (Crb) и комплекса Scribble (Scrib) (рис. 1). Белковые комплексы апикальной полярности, Par и Crb, интегрируются в межклеточные соединения, образованные плотными и адгезионными контактами, которые влияют на адгезию соседних клеток и барьерную функцию эпителия. Комплекс Par первым устанавливается на плазматической мембране и запускает процесс поляризации, определяя апикальный домен клетки. За этим событием следует спецификация базолатеральной поверхности комплексом Scrib. Наконец, комплекс Crb рекрутируется более апикально, чем комплекс Par, и противодействует функции Scrib, чтобы установить апико-базальную полярность.
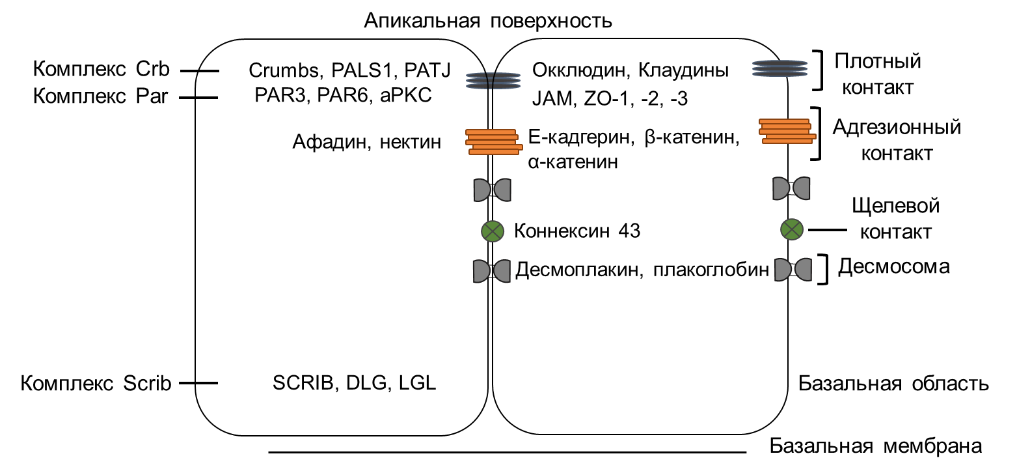
Ретинальный пигментный эпителий (РПЭ), локализуясь между хориокапиллярами сосудистого слоя и фоторецепторами, выполняет множество важных функций в сетчатке, фундаментальным для которых является апико-базальная полярность клеток. Однако, несмотря на значительную роль, которую полярность играет в РПЭ, очень мало известно о том, как эти белковые комплексы полярности функционируют в этом типе клеток. Хотя известна роль мутаций генов CRB1 и CRB2 в этиологии развития пигментного ретинита, наиболее распространенной формы наследственных дистрофий сетчатки у человека.
Paniagua и соавторы изучили временную последовательность экспрессии и локализации белков полярности и межклеточных соединений в клетках РПЭ плода человека во время поляризации in vitro и в зрелых клетках РПЭ мышей in vivo.
Сначала авторы изучили процесс дифференцировки клеток РПЭ плода человека in vitro (рис. 2), выбрав для анализа две основные особенности дифференцированных эпителиальных клеток: покой клеток и установление межклеточных соединений. Авторы показали, что к 21 дню культивирования (д.к.) на мембранных вставках трансвелл клетки РПЭ плода человека становятся хорошо дифференцированными: большинство клеток перестают пролиферировать, формируются межклеточные соединения и уменьшается параклеточный поток ионов. Тот факт, что трансэпителиальное электрическое сопротивление (TER) продолжал расти минимум еще 6 недель после 21 д.к., указывает на то, что клетки становятся поляризованными и находятся в состоянии покоя перед полной дифференцировкой.
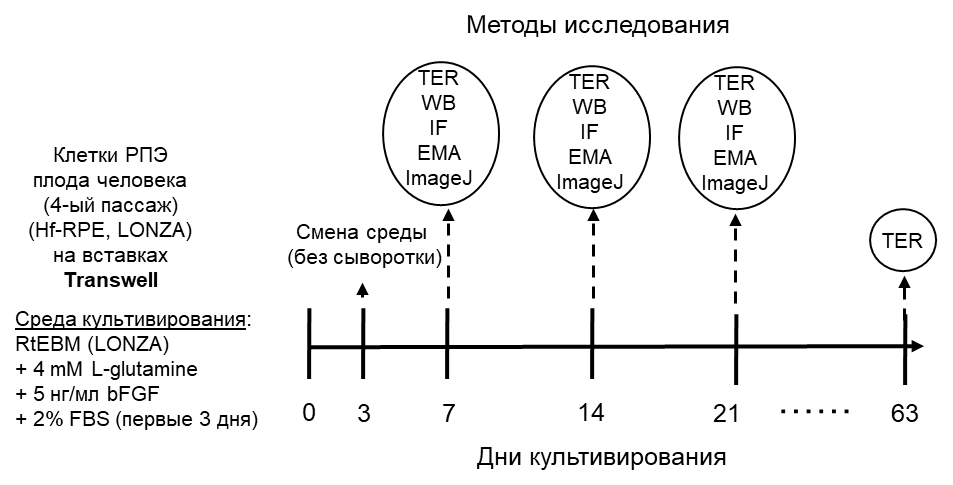
Затем авторы изучили установление апико-базальной полярности во время дифференцировки клеток РПЭ плода человека in vitro, использовав в качестве раннего индикатора поляризации эпителиальных клеток – формирование кругового пояса актина, а также использовав электронный микроскопический анализ апико-базальных срезов и иммунофлуоресцентный анализ распределения Na, K-АТФазы и Scribble, и локализацию белков комплексов апикальной полярности Par и Crb на плазматической мембране.
На 7 д.к. актиновые филаменты выявлялись в клетках РПЭ плода человека в основном как стрессовые волокна, тогда как на 14 д.к. и особенно на 21 д.к. большинство филаментов были кольцевыми. Трансмиссионная электронная микроскопия апико-базальных срезов показала увеличение высоты клеток РПЭ плода человека с ~ 5,5 мкм на 7 д.к. до ~ 9,9 мкм на 21 д.к. К 21 д.к. ядра приобретали округлую морфологию, на апикальной мембране присутствовали полностью развитые микроворсинки, а базолатеральная локализация митохондрий, типичная для поляризованных эпителиальных клеток, была более очевидной.
Проанализировав экспрессию и расположение белков апикальной полярности в течение первых 21 д.к. клеток РПЭ плода человека, авторы показали, что белки PAR3 и aPKC комплекса Par являются первым комплексом полярности, который локализуется на плазматической мембране на 7 д.к., где они остаются в течение дальнейшего процесса поляризации. В это же время наблюдалась экспрессия белка PATJ, который локализовался в цитоплазме и образовывал спутанные структуры. На 14 д.к. появилась экспрессия других белков комплекса Crb, PALS1 и CRB2, однако только PALS1 локализовался на плазматической мембране вместе с PATJ, в то время как CRB2 оставался в цитоплазме. На 14 д.к. клетки РПЭ еще митотически активны, но в то же время начальное установление плотных контактов в клетках РПЭ начинает демонстрировать некоторую степень апико-базальной полярности, поскольку Na, K-АТФаза локализуется на апикальной мембране. Таким образом, рекрутирование комплекса Crb поддерживает процесс поляризации, хотя его установление на плазматической мембране начинается без вклада CRB2. Наконец, на 21 д.к. CRB2 завершает формирование комплекса Crb, локализуясь на плазматической мембране в то же время, что и клаудин-19, а Scribble точно очерчивает базолатеральный домен. В это время большинство клеток РПЭ больше не пролиферируют и демонстрируют максимальный апикально-базальный рост. Следовательно, эта ключевая стадия поляризации завершается одновременно с локализацией CRB2 в соединительном комплексе.
Несмотря на то, что CRB2 является трансмембранным белком, который локализуется на плазматической мембране, где он выполняет свою роль как часть комплекса Crb, значительное его количество было обнаружено в цитоплазме взрослых клеток РПЭ мышей (Paniagua et al., 2015). Поскольку такой же паттерн экспрессии CRB2 авторы наблюдали и в клетках РПЭ плода человека in vitro, а также, чтобы выяснить, является ли это обычным распределением в дифференцированных эпителиальных клетках, исследователи проанализировали экспрессию и локализацию CRB2 в нескольких органах взрослой мыши (рис. 4). В результате авторы показали, что CRB2 локализуется как в цитоплазме, так и на плазматической мембране эпителиальных клеток почек, тонкого кишечника и семенниках.
Роль CRB2 во время дифференцировки и поляризации была исследована путем трансдукции свежепосеянных (0 д.к.) клеток РПЭ плода человека лентивирусами, содержащими shRNA, направленную против CRB2 (shCRB2#1 или shCRB2#2), или контрольную shRNA (shCTR) (рис. 3).
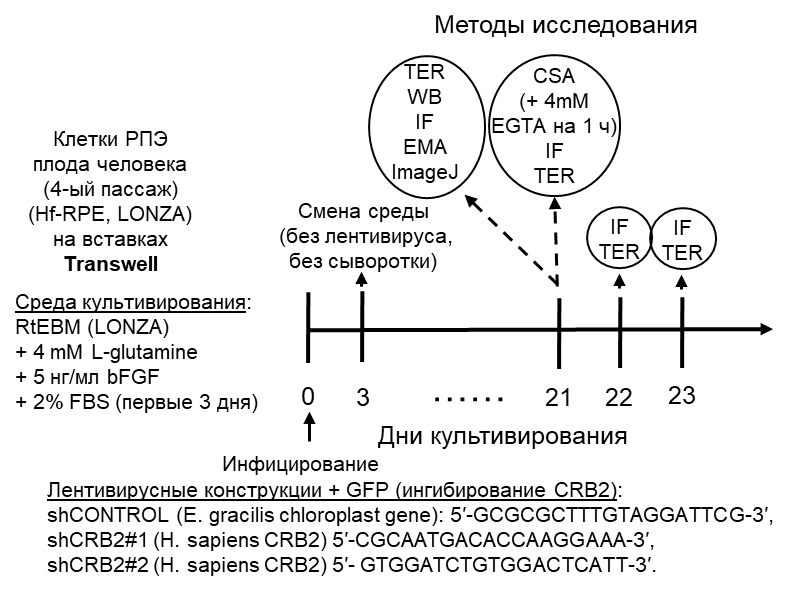
Снижение CRB2 не изменило уровни белка β-катенина, окклюдина, PAR3 и PALS1 на 21 д.к. и не повлияло на плотность клеток или TER. Тем не менее, сравнивая субклеточную локализацию белков межклеточных соединений и комплексов апикальной полярности, авторы обнаружили, что окрашивание окклюдина на плазматической мембране было снижено в некоторых клетках CRB2-нокдаун. Поэтому авторы для начала проанализировали межклеточные соединения с помощью обычной электронной микроскопии и обнаружили промежутки в поясе, образованном плотными контактами, который окружает каждую клетку. Затем авторы, использовав анализ переключения кальция (calcium switch assay, CSA), проверили влияние восстановления CRB2 на восстановление межклеточных соединений клеток и комплексов полярности. Авторы показали, что нокдаун CRB2 влияет на восстановление плотных контактов на плазматической мембране после истощения Ca2+. Кроме того, авторы показали, что появление CRB2 на клеточной мембране контролирует поддержание и восстановление белков плотных контактов окклюдина и клаудина-19, а также белка PALS1 комплекса Crb, когда эти соединения сформированы и позже разрушены, но не во время установления их de novo. Однако CRB2 не выполняет ту же роль для белка адгезионных контактов β-катенина и белка PAR3 комплекса Par.
Впрочем, остается не решенным вопрос, какую функцию выполняет CRB2, когда клетка не полностью поляризована, и этот белок распределен в цитоплазме и не является функциональной частью комплекса Crb на плазматической мембране?
Далее авторы исследовали влияние нокдауна CRB2 на дифференцированные клетки RPE in vivo (рис. 4). В субретинальное пространство (внеклеточная область между апикальной поверхностью РПЭ и фоторецепторами) 21-дневных мышей исследователи вводили лентивирусные векторы, содержащие GFP и shRNA против мРНК Crb2 мыши (shCRB2) или контрольную shRNA (shCTR). Эффекты нокдауна Crb2 анализировали через 60 дней после инъекции.
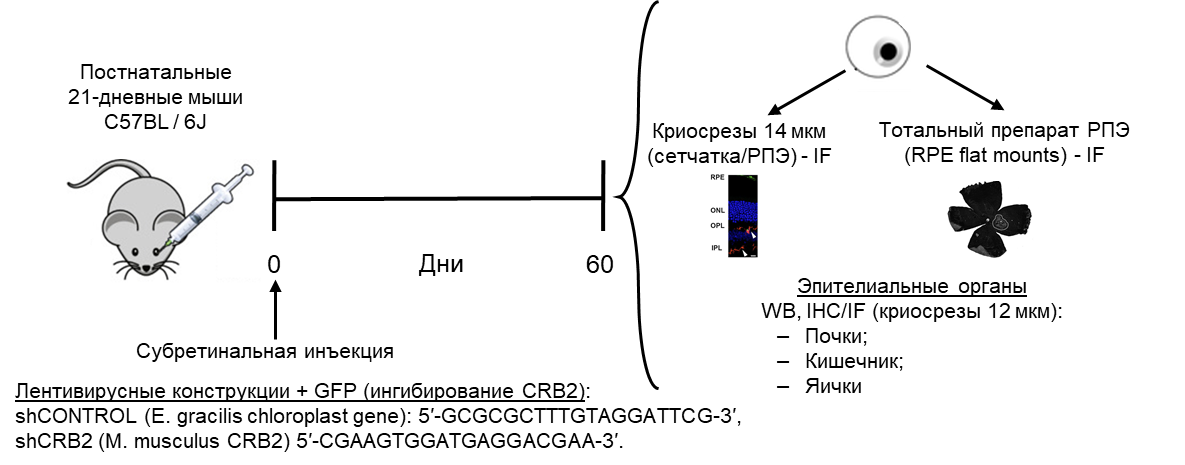
Трансдуцированная площадь, идентифицируемая по GFP-положительным клеткам, была сосредоточена в месте инъекции и составила ~10% клеток РПЭ. GFP находился в клетках РПЭ, иммуномеченных антителами против RPE65, специфического маркера РПЭ, а не в нервной сетчатке. Нокдаун CRB2 не повлиял на распределение белка ZO-1, однако распределения белков PALS1 и PAR3 были нарушены с потерей периферической локализации обоих белков. Подобные изменения немного отличаются от того, что авторы обнаружили in vitro, где в клетках CRB2-нокдаун затрагиваются плотные контакты и PALS1, но не PAR3. Авторы предполагают, что это могло быть из-за разных видов, используемых в каждом подходе (человек против мыши), из-за разной среды каждой модели (глаз мыши против культуры клеток) или из-за комбинации того и другого. Однако эти результаты согласуются с исследованиями, показывающими, что отсутствие CRB2 и CRB3 приводит к разборке белков полярности в эпителиальной ткани во время развития эмбриона мыши, но никогда не влияет на соединения клеток (Whiteman et al., 2014). В отличии от Chen et al. (2019), показавшими увеличение апоптоза в недифференцированных клетках ARPE19, трансфицированных миссенс-мутацией CRB2 (p.R1249G) in vitro, в исследовании Paniagua и соавторов, изменений в апоптозе или пролиферации клеток РПЭ плода человека при подавлении CRB2 и PALS1 выявлено не было. Авторы предполагают, что изменения в апоптозе или пролиферации клеток РПЭ могут быть более частыми, когда CRB2 отсутствует в недифференцированных клетках, а не в полностью поляризованных эпителиальных клетках, где межклеточные соединения полностью стабилизированы и противостоят этим механизмам.
В завершении исследования авторы решили проанализировать, влияют ли выявленные изменения в клетках РПЭ на состояние сетчатки. Одним из основных признаков поражения сетчатки является вторжение активированной микроглии в субретинальное пространство. Исследователи пометили клетки микроглии специфическим маркером Iba1 в криосрезах сетчатки и обнаружили их заметно большее количество в субретинальном пространстве CRB2-нокдаун. Количественная оценка клеток микроглии в тотальных препаратах РПЭ (RPE flat mounts) показала присутствие как амебоидной фагоцитарной, так и разветвленной нефагоцитарной микроглии. При этом, количество амебоидных фагоцитарных клеток было значительно выше в клетках CRB2-нокдаун, чем в контроле. Клетки обоих фенотипов были распределены вдоль субретинального пространства, хотя в месте инъекции их было немного больше.
Авторы предполагают, что длительный нокдаун CRB2 в РПЭ в конечном итоге приведет к нарушению в РПЭ, что также поддерживается результатами, полученными Chen et al. (2019). Повреждение РПЭ будет способствовать появлению микроглии в субретинальном пространстве и дегенерации фоторецепторов впоследствии.
Новость подготовила © Кузнецова А.В.
26.08.2021