
Область научных интересов: раннее эмбриональное развитие, оогенез, нейробиология развития.

Область научных интересов: механизмы дифференцировки клеток и тканей, межклеточные взаимодействия, нервный гребень и его производные.
Домовая мышь (Mus musculus) благодаря своей большой плодовитости, короткому сроку беременности и генетической близости к человеку является одним из самых распространённых модельных объектов в биологии. В течение всего 3 недель одноклеточная зигота трансформируется в организм, состоящий из сотен миллионов клеток. В течение этого короткого периода в развивающемся эмбрионе мыши должны произойти многочисленные изменения транскрипционных программ в разных типах клеток на разных временных промежутках. Еще начиная с 2017 года, во многих работах проводились исследования с использованием технологии секвенирования РНК одиночных клеток (single cell RNA-seq), посвященные изучению динамики изменения транскрипционных профилей клеток целого зародыша мыши в ходе его эмбрионального развития. Однако во всех этих исследованиях ученым приходилось жертвовать либо количеством анализируемых стадий развития, либо длиной временных интервалов, отделяющих эти стадии.
Авторы статьи, опубликованной недавно в Nature, собрали все имеющиеся данные транскриптомики одиночных клеток эмбрионов мыши и дополнили их более подробным анализом траскрипционных профилей клеток развивающегося эмбриона мыши с помощью оптимизированного протокола одноядерного транскрипционного профилирования с комбинаторным индексированием (sci-RNA-seq3). Авторы отобрали 75 эмбрионов мыши от стадии E8 до стадии P0 (postnatal day 0), т.к. на момент эксперимента они были наименее детально описаны. При определении стадии развития эмбриона мыши авторы ориентировались на морфологические признаки, в первую очередь на число сомитов и геометрию почки конечности (Рис. 1). Полученные данные авторы статьи объединили с данными других исследователей для конструирования дерева клеточных типов, охватывающего период развития мыши от зиготы до рождения. Кроме этого, авторы уделили особое внимание некоторым деталям – описанию развития постериорной части эмбриона в ходе сомитогенеза, развитию почки, боковой мезодермы и ранних нейронов.
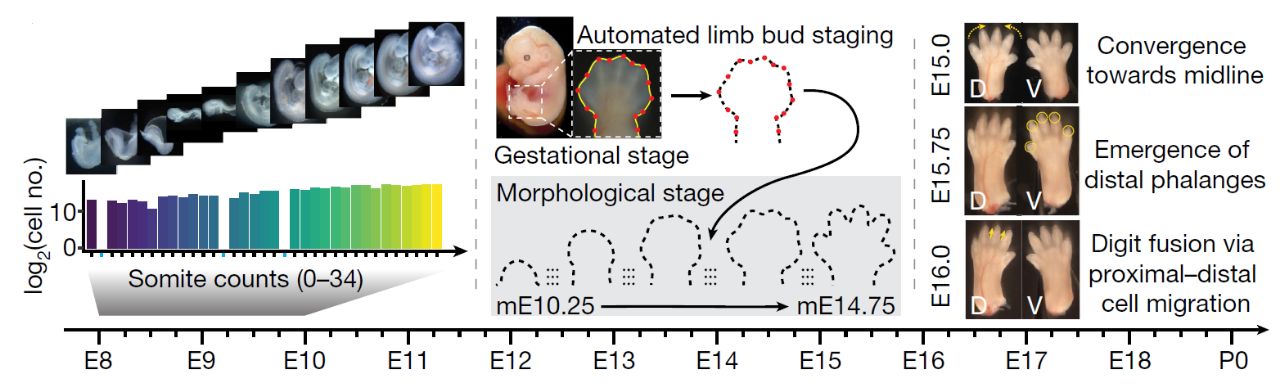
Рис. 1. В исследовании использовались эмбрионы мыши от стадии Е8 до стадии Р0. Определение стадии эмбриона проводилось на основе морфологических признаков: число сомитов и геометрия почки конечности.
Остановимся на некоторых новых данных, полученных в результате этого исследования. При изучении транскриптомов клеток, образующих постериорную часть эмбриона в ходе сомитогенеза, были выделены 3 кластера, соответствующие нейромезодермальным прогениторным клеткам (NMPs) и прогениторным клеткам спинного мозга, мезодермальным прогениторным клеткам, а также кишке и хорде (Рис. 2). Используя метод принципиальных компонент, авторы смогли установить, что лучшим критерием для идентификации нейромезодермальных прогениторных клеток, которые способны развиваться как в нервную трубку, так и в мезодерму, является экспрессия в клетках brachyury (T+), совмещенная с отсутствием экспрессии Meis1. Кроме этого индикатором бипотентности клеточной популяции НМП может служить экспрессия Cyp26a1 и Wnt3a.
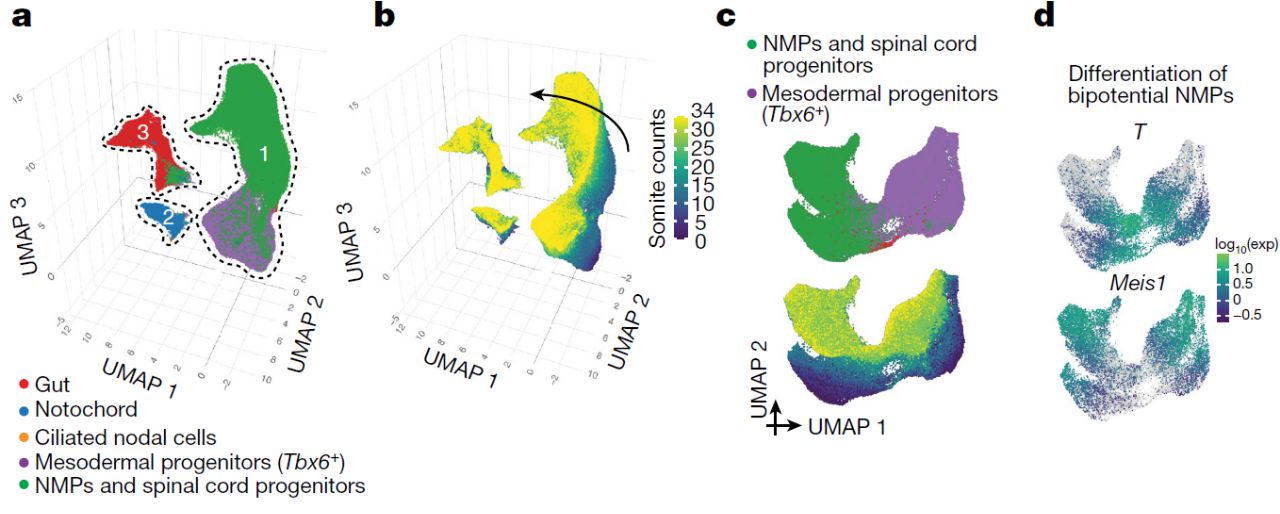
Рис. 2. Кластеры клеток из постериорной части эмбриона мыши, обнаруживаемые в ходе сомитогенеза (a, b). Первый кластер представлен нейромезодермальными прогениторными клетками (NMPs) и прогениторами спинного мозга и мезодермальными прогениорными клетками (c). Бипотентные клетки нейромезодермальные прогениторные клетки характеризуются экспрессией T и низким уровнем экспрессии Meis1 (d).
Другая группа Т+ клеток в зародыше составляет хорду. В этом кластере клеток в период 0-12 сомитов авторы выделяют две субпопуляции клеток: экспрессирующие Noto и экспрессирующие Shh (Рис. 3). Авторы предполагают, что Noto+ клетки соответсвуют постериорной хорде, в то время как предполагаемым производным Shh+ клеток является антериорная мезодерма. Кроме того, среди Noto+ клеток исследователи обнаружили несколько клеток с интенсивной экспрессией гена Foxj1 и генов, ответственных за образование подвижных ресничек. Это клетки, задействованные в установлении лево- правой оси. Видно, что они встречаются очень редко и в ограниченный временной промежуток времени (наибольшее число приходится на стадию 2 сомитов).
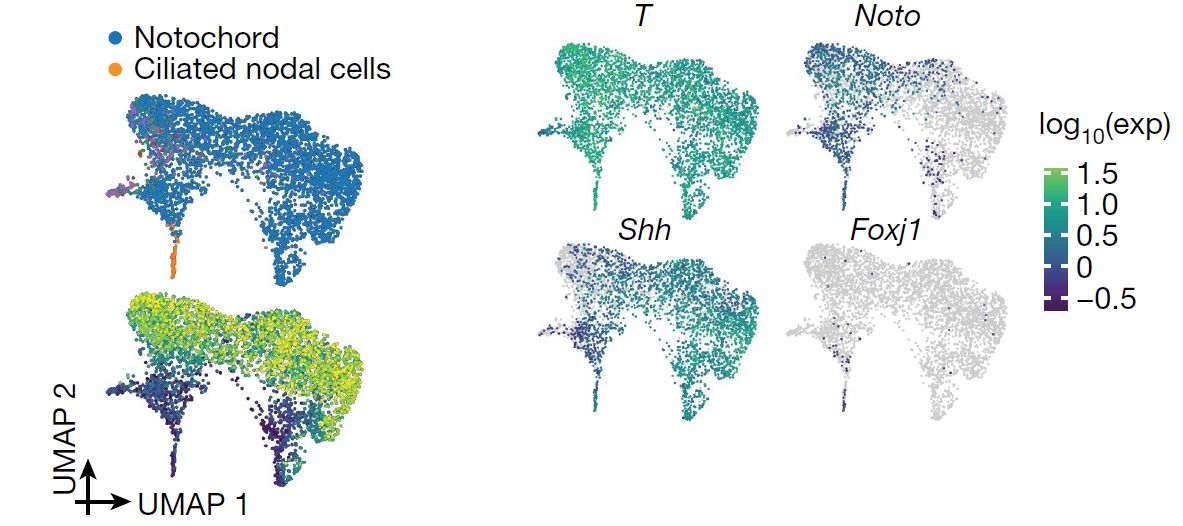
Рис. 3. Клетки хорды делятся на Noto+ и Shh+ клетки. Среди Noto+ клеток, обнаруживаются реснитчатые Foxj1+ клетки.
Далее авторы статьи подробно описывают транскрипционные преобразования, происходящие с промежуточной мезодермой (ПМ) при ее дифференцировке в нефроны. Были выявлены две основные траектории развития промежуточной мезодермы: постериорная ПМ (Gdnf+) в систему канальцев нефрона и антериорная ПМ (Ret+) в собирательную трубку (Рис. 4). В период поздней гаструляции клетки постериорной ПМ дают начало метанефрической мезенхиме, а клетки антериорной ПМ метанефрическому дивертикулу (ureteric bud). Позднее эти структуры развиваются в функциональные компоненты нефрона. Примечательно, что метанефрическая мезенхима и метанефрический дивертикул сохраняются и в период P0, что, по-видимому, связано с продолжающимся после рождения нефрогенезом у мышей. Авторы также отмечают транскрипционную «конвергенцию» постериорной и антериорной ПМ при формировании интеркалирующих клеток собирательной трубки, подтверждая двойное происхождение этих клеток.
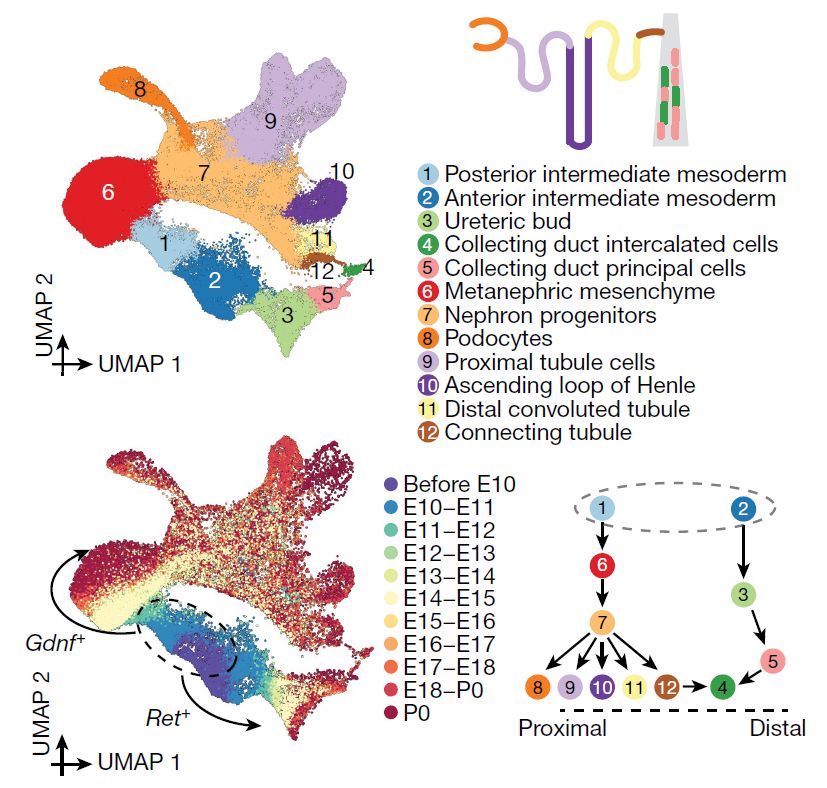
Рис. 4. Изменение транскрипционных состояний клеток промежуточной мезодермы при развитии нефрона.
Поскольку многие из производных латеральной мезодермы мало описаны в литературе, авторы использовали данные пространственной транскриптомики для выявления локализации исследуемых клеток. Это позволило им выделить 22 основных кластера латеральной и промежуточной мезодермы (рис. 5).
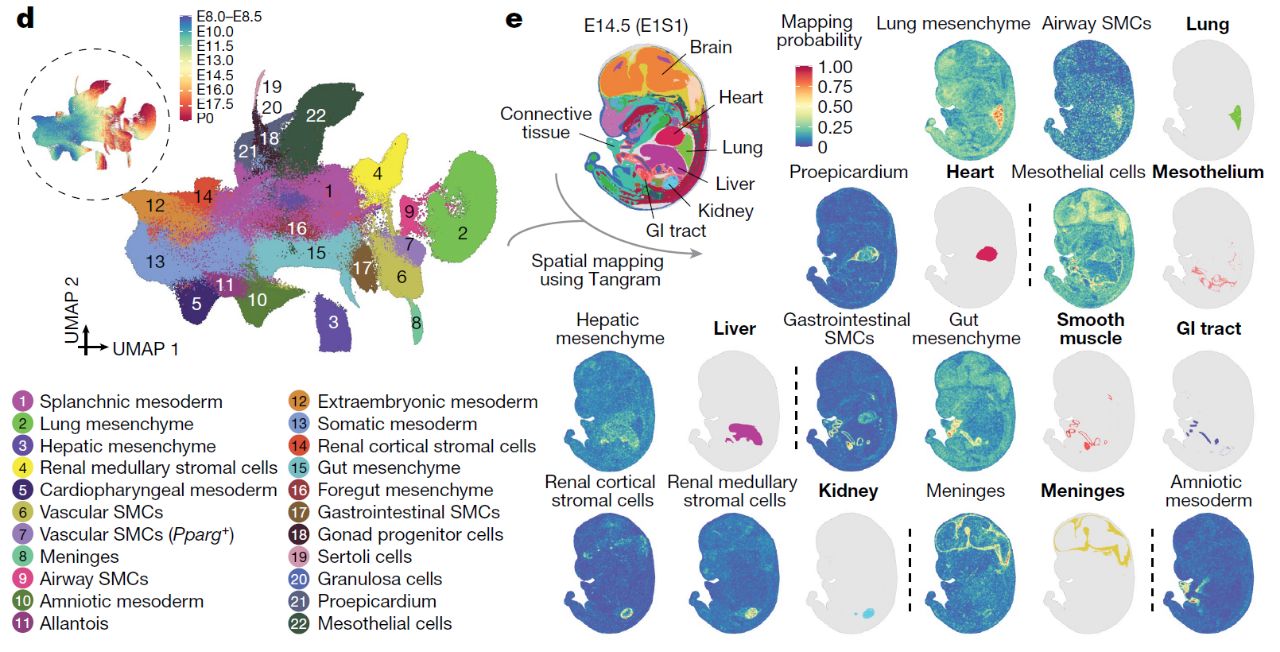
Рис. 5. 22 кластера клеток, идентифицированных в латеральной и промежуточной мезодерме (d). Пространственное происхождение клеточных субпопуляций латеральной и промежуточной мезодермы было установлено с использованием общедоступных наборов данных, Mosta, оригинальных данных авторов статьи и алгоритма Tangram.
При исследовании нейроэктодермы в период с Е8-Е13 авторы статьи описали кластеры, соответствующие будущим основным участкам мозга (Рис. 6). В ходе развития эмбриона обнаруживались многие траектории нейрогенеза, берущие начало из этих областей. Начиная со стадии 16 сомитов большая часть нейрального разнообразия достигается за счет прямого нейрогенеза (т.е. нейральные клетки происходят от радиальной глии): моторные нейроны, клетки Пуркинье, клетки Кахаля-Рециуса и др. Непрямой нейрогенез (т.е. за счет промежуточных нейральных прогениторов) начинается позже, со стадии Е10.25. Для выявления гетерогенности в популяции ранних нейральных клеток, авторы статьи проанализировали транскрипционные состояния нейроэктодермы, предшествующие стадии Е13. Это так же позволило выявить источник этой гетерогенности.
В исследовании были обнаружены 11 подтипов спинномозговых интернейронов. С помощью метода принципиальных компонент были установлены основные источники транскрипционной гетерогенности интернейронов: степень дифференцированности, спецификация в направлении глутамтэргического или ГАМКэргического нейрона, приобретение клетками вентральной или дорсальной идентичности. Кроме того, для того, чтобы установить предшественников нейральных и ненейральных клеток, авторы сравнили траскриптомные данные клеток до стадии Е13 с траскриптомными данными клеток размеченной нейроэктодермы и провели MNN (Mutual Nearest Neighbor) анализ. Это позволило получить более детальное представление о взаимном отношении прогениторных клеток нейроэктодермы.
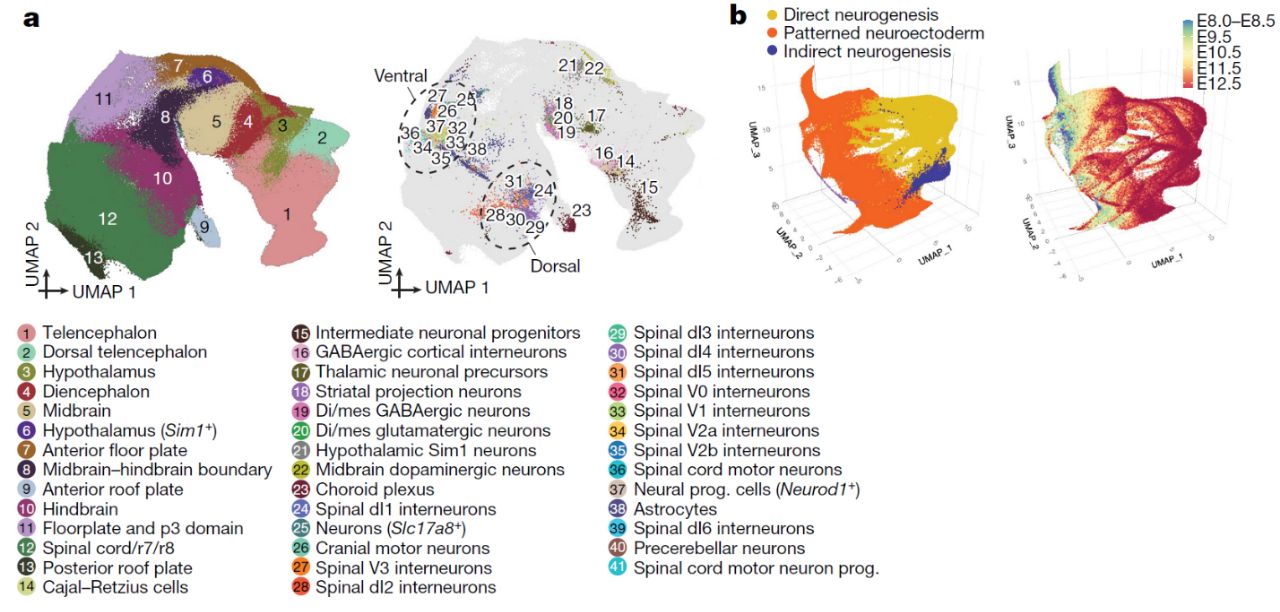
Рис. 6. Сравнение кластеров нейроэктодермы, выявленных на стадиях Е8-Е13 с кластерами предполагаемых прогениторных клеток нейроэктодермы (а). Нейроэктодермальные клетки до стадии Е13 (b).
Кроме этого, исследователями были обнаружены резкие изменения транскрипционных программ сразу после рождения мыши в нескольких типах клеток. Чтобы подтвердить наблюдаемые изменения в транскрипционном профиле этих клеток, были собраны 9 мышат из одного помета, трое из которых родились вагинально, а шесть путем Кесарева сечения (2 были сразу подвергнуты эвтаназии, остальные 4 были подвергнуты эвтаназии спустя 20, 40, 60 и 80 минут соответственно). Эксперимент подтвердил наличие быстрой смены транскрипционных состояний в гепатоцитах, адипоцитах, легких и воздухоносных путях в течение первого часа после рождения. Существует огромное эволюционное давление на момент перехода от плацентарной к внеутробной жизни, который, возможно, является таким же критическим моментом в развитии, как и гаструляция. Авторы отмечают этот результат как самый большой сюрприз этой работы.
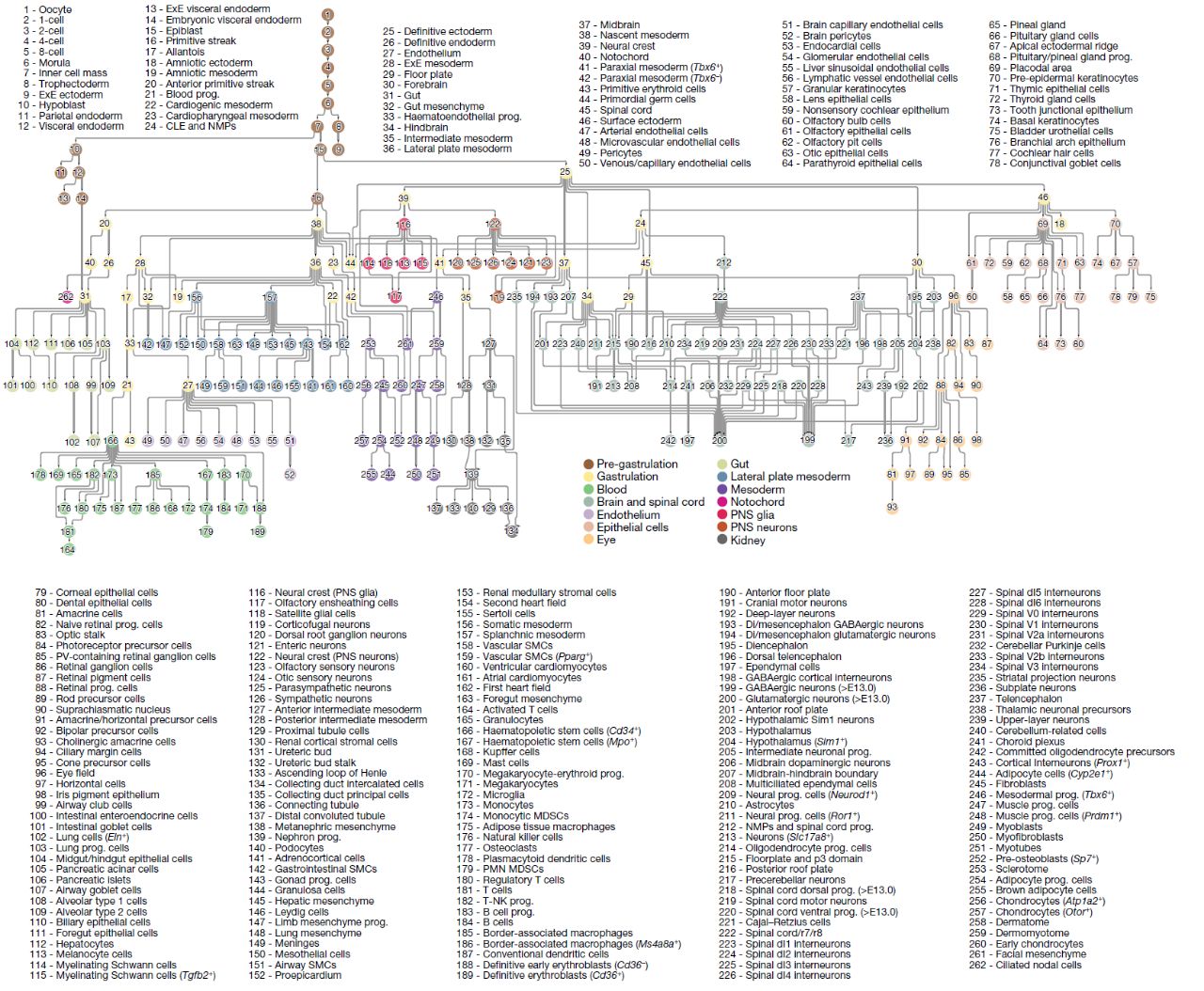
Рис. 7. Дерево клеточных типов эмбриона мыши, от зиготы до рождения.
Как итог работы, авторы статьи составили дерево клеточных типов зиготы до рождения мыши (Рис. 7) на основе четырех опубликованных массивов данных (10 000 клеток; Е0-Е8.5) и данных, полученных в этом исследовании (11,4 миллиона клеток; Е8- Р0). Выявлено 262 типа клеток, имеющих уникальные характеристики транскрипционных профилей. Проанализировав 436 ребер составленного графа, авторы статьи идентифицировали ключевые транскрипционные факторы необходимые для преобразования клеток в другой клеточный тип. Представленный набор данных может быть использован для генерации и проверки множества гипотез. Для большинства временных точек в данной работе был проанализирован один эмбрион, причем отбора по полу не проводилось. В связи с этим, в данной работе затруднительно оценить индивидуальную вариабельность и половые различия процессов развития. Тем не менее, глядя на этот величественный результат грандиозного труда, хочется отметить значение этого исследования, которое безусловно станет основой для дальнейшего всестороннего понимания развития млекопитающих.
Новость подготовили
© Д.А. Никишин и М.А. Лазарев
26.03.2024