 © Станислав Кремнев, кандидат биологических наук, старший научный сотрудник, лаборатория эволюции морфогенезов ИБР РАН.
© Станислав Кремнев, кандидат биологических наук, старший научный сотрудник, лаборатория эволюции морфогенезов ИБР РАН.
Научные интересы: морфогенез, эволюция эмбрионального развития.
В раннем эмбриональном развитии животных клетки выбирают направление дифференцировки по определенному пути в соответствии с информацией об их положении в эмбрионе. Это часто приводит к архитектурным изменениям организации эмбриона, что в свою очередь создает новые параметры позиционной информации. На сегодняшний день имеется большое количество данных о том, как дифференцировка направляет морфогенез ткани, а также получены достоверные данные о механизмах влияния морфогенеза на дифференцировку клеток (Farge, 2003; Brunet et al,. 2013). Такие циклы дифференцировки и морфогенеза являются ключом к устойчивому развитию, но до сих пор остается нерешенным вопрос, как зародыши координируют эти процессы. Один из способов – это реализация контрольных точек, при которых развитие процесса сдерживается, если не выполнены специфические условия. Shahbazi с соавторами (Shahbazi et al., 2016) получили первые данные о наличии таких контрольных точек в раннем развитии млекопитающих. В своей работе исследователи выявили механизм координации между морфогенетическим процессом формирования амниотической полости и процессом выхода из состояния наивной плюрипотентности эмбриональных клеток.
На имплантационных стадиях развития происходят важные морфогенетические процессы. В этот период в скоплении плюрипотентных клеток начинает формироваться амниотическая полость, в которой в дальнейшем будет располагаться развивающийся зародыш и окружающая его жидкость. До недавнего времени практически не было данных о механизмах формирования амниотической полости, так как оно происходит на ранних стадиях имплантации. Но благодаря недавно разработанным усовершенствованным способам культивирования in vitro эмбрионов млекопитающих это стало возможно (Harrison et., 2017).
Для выявления корреляции между морфогенезом эпибласта (образованием амниотической полости) и изменением плюрипотентности клеток Shahbazi с соавторами применили метод глубокого секвенирования. Им удалось показать, что у эмбрионов мыши на стадии E4.5 и E4.75 клетки эпибласта экспрессируют набор генов характерный для наивного плюрипотентного состояния клеток, но уже к стадии E5.0 было зарегистрировано достоверное падение экспрессии этих генов. Для подтверждения причинно-следственной связи между снижением плюрипотентности и морфогенезом эпибласта исследователи решили инкубировать эмбрионы мыши на стадии E4.5 в среде с добавлением фактора LIF, ингибитора MEK и GSK3 (среда 2i/LIF). Содержание эмбрионов в данной среде обеспечило сохранение плюрипотентного состояния в клетках эпибласта. Об этом свидетельствовал высокий уровень экспрессии гена Nanog при одновременном ингибировании экспрессии гена Podxl, белок которого располагается на апикальной мембране поляризованных клеток и в дальнейшем секретируется в формирующуюся амниотическую полость. Формирование самой полости также было заблокировано и развитие зародыша останавливалось. Отмывание от 2i/LIF приводило к возобновлению развития эмбриона и нормальному морфогенезу, что подтверждает связь кинетики выхода из наивного плюрипотентного состояния клеток с морфогенезом.
Для того чтобы выявить связь между выходом клетки из наивного плюрипотентного состояния и приобретением ею поляризации, были проведены исследования эмбриональных клеток человека (hES) и мыши (mES), культивируемых в 3D условиях (в матригеле). Исследователи выяснили, что наивные ES, культивируемые в 3D условиях в среде 2i/LIF, проходят несколько этапов. Во-первых, клетки собираются в клеточные розетки и сводят апикальные полюса клеток в одну точку. Во-вторых, клеточные везикулы перемещаются к апикальным полюсам клеток, а также формируются плотные контакты. Эти процессы являются ключевыми для накопления жидкости между апикальными поверхностями клеток. Однако авторы обнаружили, что у наивных клеток нет отрицательно заряженных покрывающих апикальную мембрану белков сиаломуцинов (Podxl). Сиаломуцины способствуют отталкиванию апикальных мембран клеток и формированию полости в центре розетки. Синтез сиаломуцина возобновлялся при отмывании 2i/LIF, что приводило к формированию люмена. При длительном культивировании в присутствии 2i/LIF клеточные розетки распадались без образования люмена, и формировалась дезорганизованная клеточная масса. Полученные результаты говорят о том, что центральным процессом в данном случае является не формирование поляризованного эпителия, а отталкивание апикальных поверхностей клеток.
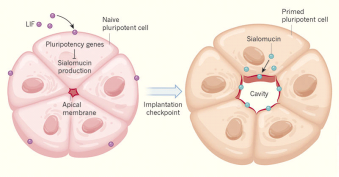
Рис. 1. Схема координации плюрипотентного состояния клеток с мофогенезом (Dumortier and Maître, 2017).
Задачей следующего этапа исследования стало выявление транскрипционных факторов, принимающих участие в люминогенезе. Первым проверенным фактором стал Nanog. Однако его оверэкспрессия без 2i/LIF не блокировала люминогенез, а направленное подавление его экспрессии не восстанавливало процесс формирования полости в присутствии 2i/LIF.В конечном итоге было выяснено, что тандемная работа факторов Oct4 и Otx2 участвует в регуляции экспрессии сиаломуцина и формировании люмена.
Несмотря на то, что была показана важная роль сиаломуцинов для формирования полостей, исследователи обнаружили, что просто оверэкспрессии этих белков в наивных клетках недостаточно. Это свидетельствует о том, что доставка сиаломуцинов к апикальному полюсу клеток требует участия дополнительных специфических белков. Таким компонентом оказался цингулин, белок, который входит в комплекс плотных клеточных контактов. Выяснено, что цингулин обеспечивает привязывание Rab11-везикул, заполненных сиаломуцином, к апикальной мембране клеток.
В ходе проведенного исследования стало очевидно, что дальнейшая работа необходима для выявления полного состава белковых взаимодействий способствующих выходу клеток эпибласта из наивного плюрипотентного состояния и формированию амниотической полости. Неожиданно оказалось, что ключевым фактором является Oct4, экспрессия которого не меняется от добавления или удаления среды 2i/LIF. результаты должны быть проверены не только на культурах клеток, но и на эмбрионах. В целом, работа Shahbazi с соавторами раскрывает механизмы синхронизации клеточной дифференцировки и морфогенеза, что является ключевым в понимании целостности развития.
Цитируемая литература:
Brunet T, Bouclet A, Ahmadi P, Mitrossilis D, Driquez B, Brunet AC, Henry L, Serman F, Béalle G, Ménager C, Dumas-Bouchiat F, Givord D, Yanicostas C, Le-Roy D, Dempsey NM, Plessis A, Farge E., 2013, Evolutionary conservation of early mesoderm specification by mechanotransduction in Bilateria, Nat Commun., 4:2821
Dumortier J.G., Maître J.L. 2017, Nature, Early embryos kept in check, 14;552(7684):178-179
Farge E., 2003, Mechanical induction of Twist in the Drosophila foregut/stomodeal primordium. Curr Biol. 2003 19;13(16):1365-77.
Harrison SE1, Sozen B1,2, Christodoulou N1, Kyprianou C1, Zernicka-Goetz M3., 2017, Assembly of embryonic and extraembryonic stem cells to mimic embryogenesis in vitro, Science, 14;356(6334)
Shahbazi M.N., Scialdone A., Skorupska N., Weberling A., Recher G., Zhu M., Jedrusik A., Devito LG., Noli L., Macaulay I.C., Buecker C., Khalaf Y., Ilic D., Voet T., Marioni J.C., Zernicka-Goetz M., 2017, Pluripotent state transitions coordinate morphogenesis in mouse and human embryos, Nature 552, 239–243
Новость подготовил © 26.01.2018 Станислав Кремнев