 © Богуславский Дмитрий Викторович, старший научный сотрудник лаборатории нейробиологии развития ИБР РАН, кандидат биологических наук.
© Богуславский Дмитрий Викторович, старший научный сотрудник лаборатории нейробиологии развития ИБР РАН, кандидат биологических наук.
Область научных интересов: молекулярная нейробиология, этология, апиология, социобиология.
МикроРНК (miRNA) – класс малых функционально значимых некодирующих РНК (sRNAs), имеющих размер около 19-24 нуклеотидов известны, как регуляторы экспрессии генов. miRNA связываются с открытыми рамками считывания (ORF) или некодирующей областью (UTR) специфических мРНК, вызывая их расщепление или ингибирование трансляции в рибосомах [1]. Около 60% генов, кодирующих белки, являются мишенями микроРНК [2]. МикроРНК играют важную роль в широком спектре биологических процессов, таких как пролиферация, дифференцировка, длительность развития клеток, апоптоз [3].
Недавние исследования показали, что чужеродная микроРНК обнаруживается у представителей различных царств живых организмов. Показан перенос от бактерий (Escherichia coli) к нематодам (Caenorhabditis elegans) [4], от грибковых патогенов (Botrytis cinerea) к растениям (Arabidopsis и Solanum lycopersicum) [5], от растений (Hordeum vulgare и Triticum aestivum) к патогенным грибам (Blumeria graminis) [6], от растений (Glycine max) к нематодам (Meloidogyne incognita, Heterodera glycines и Caenorhabditis elegans) [7] и от растений к позвоночным [8]. МикроРНК растений метилируются на 3' конце, что повышает их стабильность в различных экзогенных средах [9]. Несколькими экзогенными путями внутриклеточного и межклеточного транспорта через цитоплазматические тела (P bodies), мультивезикулярные тела (MVBs) и эндосомы, микроРНК растений переносятся в животных, где модулируют транскрипционные или посттранскрипционные процессы. Межвидовые взаимодействия, формируемые микроРНК растений и мРНК животных, могут привести к изменениям генетической регуляции в организме хозяина [10]. Однако вопрос о том, является ли межвидовая микроРНК регуляция универсальным механизмом, остается дискуссионным.
Медоносная пчела – удобная модель для изучения роли передачи малых РНК с пищей в коммуникации между растениями и опылителями. Ранее сообщалось, что микроРНК растений в пище личинок медоносных пчел регулируют развитие каст [11]. Было показано, что растительные микроРНК, которые чаще встречаются в перге (продукт молочнокислой переработки пыльцы в семьях пчел), чем в маточном молочке, могут ингибировать экспрессию гена amTOR. Этот ген связан с определением формы и уменьшением размера тела и яичников у медоносной пчелы, а также с активацией морфогенеза эмбриона в личинку. Однако регулярное поглощение чужеродных микроРНК всеми взрослыми особями было незначительно и ниже уровня, необходимого для запуска механизма регуляции трансляции микроРНК. Следовательно, гипотеза о такой регуляции, опосредованной экзогенными микроРНК растений, все еще оставалась спорной и нуждалась в уточнении.
Авторы публикации впервые подтвердили передачу достаточного для потенциального влияния на экспрессию генов количества микроРНК от растений к взрослым медоносным пчелам, кормящих личинок (пчел-кормилиц) и потребляющих большое количество перги (пыльцы). Исследовали передачу микроРНК от двух различных видов пыльценосов, таких как подсолнечник (Порядок: Asterales, Семейство: Asteraceae) и зизифус (Порядок: Rosales, Семейство: Rhamnaceae), в кишечник медоносных пчел в контролируемых условиях окружающей среды. Подсолнечник и зизифус были доминирующей растительностью в регионе и имели разное время цветения, обеспечивая пчел моноцветковой диетой. С помощью технологии RNA-Seq секвенировали суммарные микроРНК ткани средней кишки медоносных пчел-кормилиц. Дополнительное подтверждение было получено с помощью RT-qPCR. Результаты показали, что 11 растительных микроРНК были обнаружены в средней кишке медоносных пчел-кормилиц, которых кормили пыльцой подсолнечника или пыльцой зизифуса. Девять из 11 микроРНК – miR-30d, miR-143, miR-148a, miR-21, let-7 g, miR-26a, miR-126, miR-27a, miR-203 – являются общими для пыльцы этих растений, что позволяет предположить, что эти микроРНК обладают специфическими особенностями, повышающими их способность передаваться от растения-хозяина к медоносной пчеле. В общей сложности было предсказано, что 121 мРНК медоносной пчелы станут мишенью для этих 11 микроРНК растительного происхождения. Интересно, что микроРНК miR-206, полученная из зизифуса, нацелена на 53 гена медоносной пчелы. Анализы Киотской энциклопедии генов и генома (KEGG) показали, что эти целевые гены в значительной степени участвуют в сигнальном пути Wnt и биосинтезе N-гликанов. Также miR-206 оказывает значительное влияние на динамический механизм циркадных ритмов, происходящих с периодичностью, близкой к 24 часам, почти у всех живых организмов, от цианобактерий до растений, насекомых и млекопитающих [12].
МикроРНК let-7 была одной из первых микроРНК, обнаруженных у нематоды Caenorhabditis elegans. Позже было показано, что она участвует в различных процессах развития у насекомых Bombyx mori и Drosophila melanogaster. Предыдущие исследования медоносных пчел показали, что Let-7 является одной из немногих молекул, связанных с поведенческим переходом рабочих пчел от кормилиц к фуражирам. Сигнальные пути Wnt и fly (рис. 1 и 2), фосфатидилинозитола и метаболизма инозитол-фосфата, как мишени let-7, могут быть вовлечены в модуляцию поведения медоносных пчел путем регулирования функции нейронов. Биоинформационный анализ показал, что сигнальный путь Wnt играет решающую роль в поведенческом созревании медоносных пчел. miR-143 известна как многофункциональная микроРНК. Предсказанные гены-мишени экзогенного miR-143 связаны с биосинтезом аминоацил-тРНК, что было показано на 48-часовых эмбрионах медоносных пчел. miR-27 принимает участие в регуляции иммунного ответа у пчел, прежде всего в эндо- и фагоцитозе. Эндоцитоз вовлечен в противовирусную защиту медоносных пчел, а фагоцитоз связан с клеточным иммуннитетом у насекомых. Высокий уровень формирования фагосом наблюдается у медоносных пчел-кормилиц по сравнению с пчелами-фуражирами. Усиление иммунной активности у кормилиц необходимо для ухода за личинками медоносных пчел.
Хотя прямого доказательства возможного влияния найденных в кишечнике взрослых пчел-кормилиц микроРНК растений пока не получено, биоинформационный анализ позволяет предположить межвидовую функцию регуляции микроРНК между медоносной пчелой и цветущими растениями, расширяя наше понимание молекулярных взаимодействий между растениями и животными.
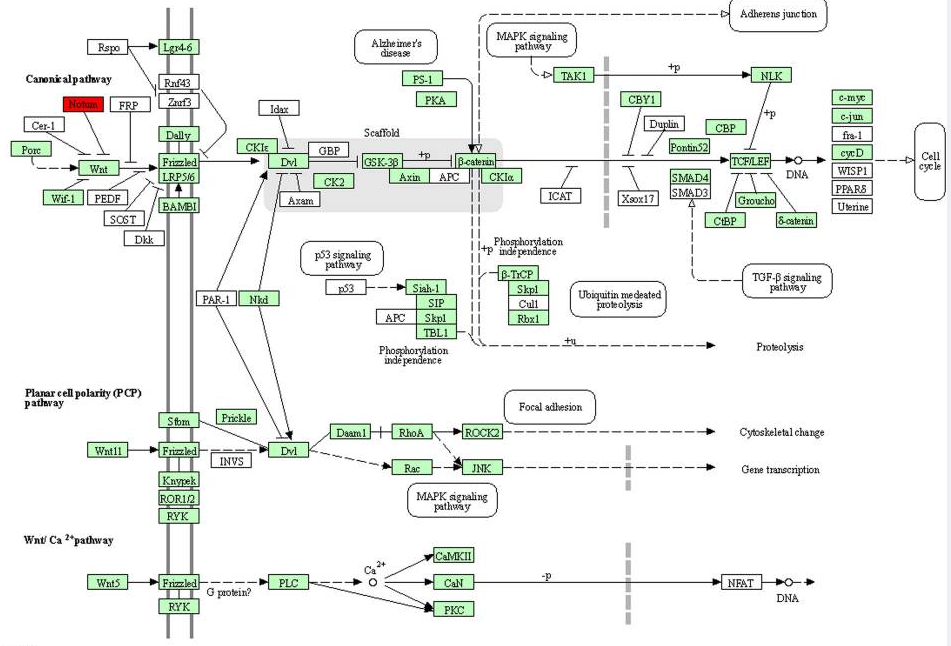
Рис. 1. KEGG анализ сигнального пути wnt у медоносной пчелы с помощью онлайн-инструмента KOBAS 3.0 (http://kobas.cbi.pku.edu.cn). Регуляция сигнального пути wnt в кишечнике медоносной пчелы экзогенным let-7 g с помощью генов-мишеней: GB54903 и GB49269. Красные поля представляют гены, идентифицированные в исследовании. Гены на зеленом фоне представляют видоспецифичные гены (Apis mellifera).
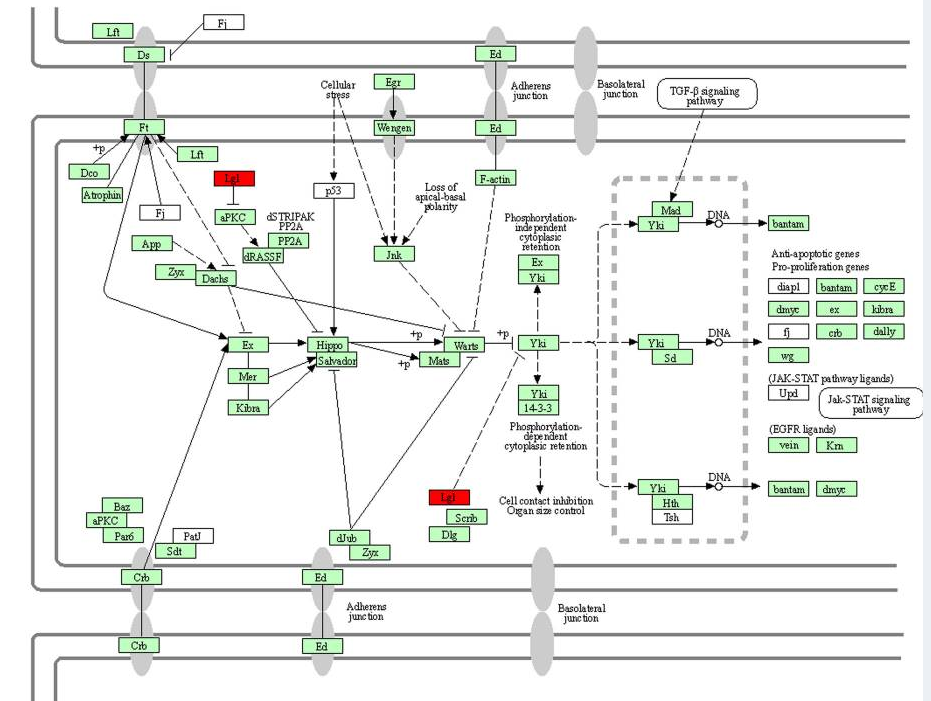
Рис. 2. Регуляция сигнального пути fly в средней кишке медоносной пчелы экзогенным let-7 g через ген-мишень GB55164. Красные поля представляют гены, идентифицированные в исследовании. Гены на зеленом фоне представляют видоспецифичные гены (Apis mellifera).
- Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004; 116 (2):281–297. doi: 10.1016/S0092-8674(04)00045-5.
- Friedman RC, Farh KK, Burge CB, Bartel DP. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 2009; 19 (1): 92–105. doi: 10.1101/gr.082701.108.
- He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet. 2004; 5 (7): 522–531. doi: 10.1038/nrg1379.
- Liu H, Wang X, Wang HD, Wu J, Ren J, Meng L, et al. Escherichia coli noncoding RNAs can affect gene expression and physiology of Caenorhabditis elegans. Nat Commun. 2012; 3 (1): 1–1.
- Weiberg A, Wang M, Lin FM, Zhao H, Zhang Z, Kaloshian I, Huang HD, Jin H. Fungal small RNAs suppress plant immunity by hijacking host RNA interference pathways. Science. 2013; 342 (6154):118–123. doi: 10.1126/science.1239705.
- Nowara D, Gay A, Lacomme C, Shaw J, Ridout C, Douchkov D, Hensel G, Kumlehn J, Schweizer P. HIGS: host-induced gene silencing in the obligate biotrophic fungal pathogen Blumeria graminis. Plant Cell. 2010; 22 (9):3130–3141. doi: 10.1105/tpc.110.077040.
- Ibrahim HM, Alkharouf NW, Meyer SL, Aly MA. Abd El Kader Y, Hussein EH, et al. post-transcriptional gene silencing of root-knot nematode in transformed soybean roots. Exp Parasitol. 2011; 127 (1):90–99. doi: 10.1016/j.exppara.2010.06.037.
- Zhang L, Hou D, Chen X, Li D, Zhu L, Zhang Y, Li J, Bian Z, Liang X, Cai X, Yin Y, Wang C, Zhang T, Zhu D, Zhang D, Xu J, Chen Q, Ba Y, Liu J, Wang Q, Chen J, Wang J, Wang M, Zhang Q, Zhang J, Zen K, Zhang CY. Exogenous plant MIR168a specifically targets mammalian LDLRAP1: evidence of cross-kingdom regulation by microRNA. Cell Res. 2012; 22 (1):107–126. doi: 10.1038/cr.2011.158.
- Ji L, Chen X. Regulation of small RNA stability: methylation and beyond. Cell Res. 2012; 22 (4):624–636. doi: 10.1038/cr.2012.36.
- Sanchita T. R, Asif MH, Trivedi PK. Dietary plant miRNAs as an augmented therapy: cross-kingdom gene regulation. RNA Biol. 2018; 15 (12):1433–1439. doi: 10.1080/15476286.2018.1551693.
- Zhu K, Liu M, Fu Z, Zhou Z, Kong Y, Liang H, Lin Z, Luo J, Zheng H, Wan P, Zhang J, Zen K, Chen J, Hu F, Zhang CY, Ren J, Chen X. Plant microRNAs in larval food regulate honeybee caste development. PLoS Genet. 2017; 13 (8):e1006946. doi: 10.1371/journal.pgen.1006946.
- Zhou W, Li Y, Wang X, Wu L, Wang Y. MiR-206-mediated dynamic mechanism of the mammalian circadian clock. BMC Syst Biol. 2011; 5 (1):1–7. doi: 10.1186/1752-0509-5-141.
Новость подготовил © Богуславский Д.В.
25.11.2021