Создание эмбриоподобных клеточных структур – это новый тренд в экспериментальной эмбриологии. Как правило, эмбриоиды создают на основе стволовых эмбриональных клеток, стволовых клеток трофобласта, и/или клеток экстраэмбриональной эктодермы. Недавно появившееся, новейшее направление в развитии этого метода, заключается в том, чтобы конструировать эмбриоиды из тотипотентных (характерными для клеток эмбриона до 8-ми клеточной стадии развития) культур клеток. Таким образом, клеточные конструкты сами будут развиваться и дифференциироваться в три первичные эмбриональные ткани. Авторы этой статьи разработали методику для поддержания в культуре клеток с чертами тотипотентности и сделали из этих клеток бластоиды (искусственные бластоцисты, аналогичные настоящим по морфологии и, как будет показано, по многим другим параметрам). Бластоиды в культуре показали способность к развитию, также они способны к имплантации в матку мыши и вызывают децидуализацию. В ходе развития in vitro бластоиды образуют аналог эмбрионов на стадии Е5.5 (Рис.1).
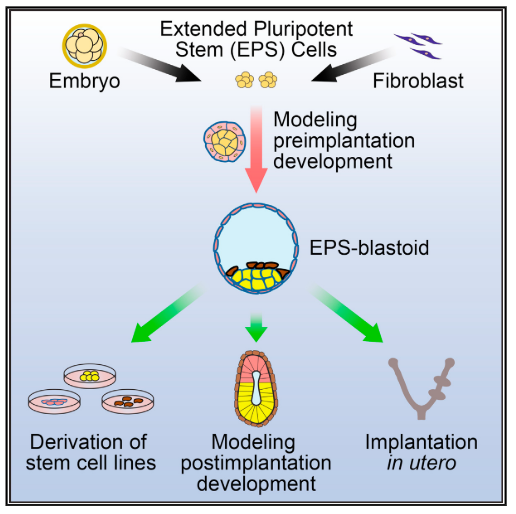
Рисунок 1. Принципиальная схема исследования.
Создание бластоидов включало в себя несколько основных шагов. Для начала была получена культура клеток с чертами тотипотентности. Протокол получения этой культуры был разработан ранее в исследовании (Yang et. Al 2017). Было показано, что получение таких клеток возможно как из бластомеров до 8-ми клеточной стадии, так и из эмбриональных стволовых клеток и из клеток с индуцированной плюрипотентностью. Специальная среда для создания и поддержания клеток с чертами тотипотентности содержит в себе фактор LIF и коктейль из ингибиторов нескольких сигнальных путей, участвующих в сегрегации внутренней клеточной массы и трофэктодермы: MAPKs, Src, Wnt, Hippo, TNKS1/2.
После получения клеток, обладающих необходимыми свойствами, авторы статьи перешли к созданию самих бластоидов. Экспериментальным путем был определен состав подходящей среды. Использованная в работе среда состояла из смеси сред: KSOM, N2B27 и TSC базальной среды. Далее был подобран набор биологически активных факторов необходимых для формирования бластоидов: FGF4, гепарин, BMP4, CHIR99021, A83-01 и Y-27632 (ингибиторы сигнальных путей). Также выяснили, что для формирования бластоидов необходима активация WNT пути. Дальше, для создания бластоидов клетки посадили в микролунки. В агрегатах клеток образовывалась полость, и к 5-6 дню бластоид достигал размеров бластоцисты на стадии Е3.5. Авторы провели сравнение полученных бластоидов с нормальными бластоцистами по морфологическим критериям и по экспрессии маркеров. У большинства бластоидов выделяются популяции клеток, аналогичные трофэктодерме (ТЭ) и внутренней клеточной массе (ВКМ), экспрессирующие характерные маркеры. Помимо этого в ходе развития в бластоиде появлялись экспрессирующие GATA4 клетки, схожие с клетками примитивной энтодермы (ПЭ). К шестому дню культивирования количество клеток в популяциях клеток “ТЭ” и “ВКМ” бластоида сравнялось с аналогичными в бластоцисте.
Процесс формирование бластоида по пространственно-временному паттерну экспрессии различных маркеров очень напоминает развитие бластоцисты в норме. Как и 8-ми клеточный бластомер, формирующийся бластоид компактизуется, на что указывает уменьшение размеров клеточных агрегатов через 18 часов после начала культивирования, а также накопление Е-кадгерина и белка плотных контактов ZO1 в зонах клеточных контактов. После компактизации бластоиды, повторяя нормальное развитие, переходят к поляризации. О начале поляризации свидетельствует начало экспрессии и накопление на апикальной поверхности белка PAR6.
Далее была изучена локализация в клетках бластоида белка YAP, компонента сигнального пути Hippo-YAP, участвующего в спецификации трофэктодермы и внутренней клеточной массы. Повторяя паттерн, который можно наблюдать в норме, на 5й день в культуре у большинства бластоидов наблюдалось цитоплазматическая локализация YAP в клетках, аналогичных ВКМ и ядерная в клетках, аналогичных ТЭ. Кроме того, подавление YAP сигналинга ингибировало также образование полости у бластоидов. Также, было показано, что в клетках, аналогах ТЭ, но не в клетках аналогах ВКМ была инактивирована одна из 2-х Х хромосом, что соответствует тому, что происходит при развитии бластоцисты.
Проведенное РНК-секвенирование и обработка результатов при помощи метода анализа главных компонент показывает, что по своему транскриптому бластоиды ближе к бластоцистам, чем к эмбрионам на стадии морулы. РНК-секвенирование единичных клеток и анализ данных по уровням экспрессии линейных маркеров клеток бластоцисты и бластоида позволил выделить в отдельные кластеры клетки ВКМ, ТЭ и ПЭ. Также в клетках бластоида выделилось три кластера клеток со смешанной экспрессией линейных маркеров. Эти клетки были обозначены, как неопределившиеся с направлением дифференцировки.
При всем сходстве нормальной бластоцисты и бластоида по морфологии и пространственным паттернам экспрессии маркеров, между ними существуют отличия, обуславливающие неспособность бластоида развиваться в жизнеспособный эмбрион. РНК-секвенирование единичных клеток позволило определить гены, которые по-разному экспрессировались в трех основных линиях клеток бластоида и бластоцисты. Для клеток внутренней клеточной массы различия в экспрессии относились к генам, связанным с поддержанием стволовости, и генам, участвующим в метилировании ДНК. Например, в бластоиде по сравнению с бластоцистой были понижены уровни экспрессии двух факторов плюрипотентности: Sox2 и Klf2, а также гены двух белков, участвующих в метилировании ДНК: Tet1 и Dnmt3L. Гены с разным уровнем экспрессии в клетках примитивной энтодермы бластоцисты и аналогичных клетках бластоида в основном относились к везикулярному транспорту и эндоцитозу. В клетках трофэктодермы значимо различались уровни экспрессии всего двух генов: Gjb2 и Arhgel6, что говорит о большом уровне соответствия между этой линией клеток у бластоида и у нормального эмбриона.
Были рассмотрены способности бластоидов к развитию и дифференцировке in vitro. Из бластоидов удалось выделить 3 линии клеток, обладающие свойствами эмбриональных стволовых клеток, стволовых клеток трофобласта, и клеток экстраэмбриональной эктодермы. В культуре бластоиды развиваются в структуры, напоминающие эмбрион на стадии зародышевого цилиндра по структуре и пространственной локализации экспрессии маркеров (Рис.2).
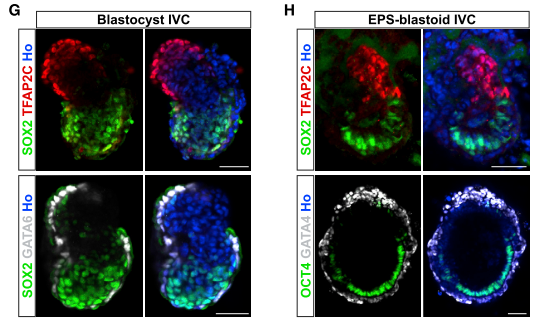
Рисунок 2. Развитие зародышевого цилиндра in vitro из нормальной бластоцисты (слева) и бластоида (справа).
Для дальнейшей проверки способности бластоида к нормальному развитию в следующем эксперименте бластоиды были перенесены в матку псевдобеременной мыши. В матках было зафиксировано образование децидуальной ткани с проницаемыми сосудами. Децидуа содержала клетки бластоида и внутри нее они развились в некую структуру, дезорганизованную по сравнению с нормальными эмбрионами (Рис.3). Несмотря на то, что модельный клеточный конструкт не поддерживает нормальное постимплантационное развитие in vivo, бластоиды несомненно имплантировались и продолжали развиваться в матке. Об этом свидетельствует присутствие OCT4+, EOMES+, и GATA4+ клеток на срезах имплантировавшегося бластоида.
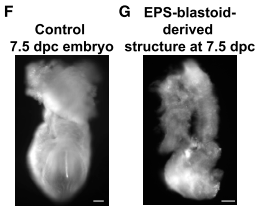
Рисунок 3. Развитие in utero нормальной бластоцисты (слева) и бластоида (справа).
Таким образом, созданная в исследовании 3D самоорганизующаяся модель эмбриона в околоимплантационные сроки является уникальным инструментом, кроме всего прочего, еще и потому, что позволяет создавать чрезвычайно близкий по свойствам к нормальному эмбриону конструкт из клеток одного типа. Или даже, как было показано в работе, из буквально одной клетки (как это происходит в жизни). На данный момент становится ясно, что развитие подобных методов планомерно приближает нас к созданию жизнеспособного и полностью функционального эмбриона из культивируемых клеток.
Новость подготовила © Измайлова Л.Ш.
25.11.2019
 ©
©