
Клетки и эволюция видов, более того, человека… Если геномы и эволюция уже привычное для нашего восприятия сочетание, то каким образом клетки позволяют нам понять, как мы стали людьми? Обзор Поллена с соавторами представляет нам буквально лавину информации, как новые молекулярные и клеточные технологии открывают нам последовательные шаги эволюционных изменений на пути от предковых гоминид к современному человеку.
Прежде всего авторы отмечают морфологические и физиологические признаки, связанные со специализацией Homo sapiens. Это особенности строения черепа и конечностей, структуры мозга, языка, гортани, пищеварительной системы и кожных покровов, и множество других модификаций. В дальнейшем авторы представляют типы молекулярных изменений, характерных для человека и выявленных методами сравнительной геномики современных и архаичных гоминид, и демонстрируют возможности современных экспериментальных систем, включая клеточные технологии и редактирование генома, позволяющие исследовать выявленную изменчивость на функциональном уровне.
Сравнительная геномика гоминид выявила миллионы нуклеотидных полиморфизмов (SNP), фиксированных в разных эволюционных линиях гоминид или значительно различающихся по частотам аллелей. Выявление функционально- и адаптивно-значимых замен, сформировавших человеческий фенотип, представляется сложной задачей. Наиболее очевидными и легко определяемыми оказались последовательности, фланкирующие районы крупных геномных перестроек, характерных для человека. Видоспецифическая изменчивость в локусах, редкие аллели которых связаны с наследственными патологиями, предполагает прямое действие отбора в фиксации таких перестроек и сопровождающей их изменчивости. Так, специфическая для человека перицентрическая инверсия на хромосоме 1 ассоциирована с генами семейства NBPF и NOTCH2NL, и дупликации или делеции этого локуса приводят к макроцефалии и микроцефалии, соответственно. Развитие методов сравнения больших массивов данных позволило выявить эволюционно-консервативные участки и выбрать из них накопившие специфическую для человека изменчивость. Они получили названия ускоренно эволюционирующих областей у человека (HARs), консервативных делеций у человека (hCONDELs) и варианты с количеством копий (CNVs). Более двух третей из них представлены некодирующими последовательностями, содержащими подтвержденные или предполагаемые сайты связывания транскрипционных факторов, или энхансеры. Этот результат свидетельствует об огромной эволюционной роли изменчивости регуляторных последовательностей.
Новые технологии нанопорового секвенирования позволяют считывать длинные непрерывные последовательности, что делает доступным анализ последовательностей с большим количеством повторов и безэталонную сборку хромосом. В сочетании с оптической идентификацией структурных изменений ДНК от Bionano Genomics становится доступным анализ роли структурной изменчивости хроматина, связанной со специфичными для разных линий гоминид перестройками и эпигенетическими модификациями, в регуляции ткане- и возраст-специфической экспрессионной активности генов.
Доступность палеогеномов позволила наблюдать последовательное формирование характерной для современного человека картины генетической изменчивости. Более того, сопоставление геномов современного человека, палеогеномов ископаемых сапиенсов, неандертальцев и денисовцев позволило выявить консервативные фрагменты архаичной ДНК гомининов, полученных в результате неполной сортировки аллелей в предковых линиях (ILS) и в результате интрогрессии. Представленность с высокой частотой этих фрагментов в популяциях человека говорит об их адаптивной значимости. Функциональный биоинформатический анализ этих последовательностей показал широкий спектр признаков, связанных с интрогрессированной ДНК неандертальцев и денисовцев. Это цвет кожи и волос, иммунный ответ на ряд вирусных заболеваний, липидный обмен, форма черепа и морфология костей, чувствительность к боли, режим сна, эмоциональные реакции и другие признаки.
Однако все рассуждения о значимости тех или иных изменений на основе их наличия или отсутствия пасуют перед простым требованием – а докажите! И вот теперь пришло время доказательств. Нужно учитывать, что это только первые (но уже многочисленные) экспериментальные работы, имеющие массу ограничений и уязвимостей, но это уже доказательства, и их количество увеличивается и качество растет.
Экспериментальные функциональные сравнения геномов. Эти сравнения подразумевают оценки дифференциальной доступности хроматина для регуляции экспрессии генов, паттернов экспрессионной активности генов и обилия белков и метаболитов в заданном образце ткани или даже в отдельных подтипах клеток из данного образца. Доступность мультиОМНых исследований позволяет в деталях проанализировать реализацию генетической информации на клеточном уровне. Доступность современных методов не эквивалентна доступности материала. Понятно, что по этическим соображениям анализ прижизненных образцов тканей и клеток человека и человекообразных обезьян в большинстве случаев невозможен. Для решения этой проблемы создаются биобанки с образцами ткани и клеток человека и обезьян, где ведется работа по содержанию посмертных образцов тканей в замороженном состоянии, в виде первичных и иммортализованных культур клеток и в виде образцов ДНК, РНК и белков, выделенных из охарактеризованных образцов тканей и клеток. По результатам анализа клеток и тканей созданы и непрерывно пополняются клеточные атласы человека и человекообразных обезьян. Задача клеточных атласов – связать генетические особенности, от структуры и доступности хроматина до характеристик транскриптома и протеома, с клеточными фенотипами. Различия фенотипов гомологичных клеточных подтипов у разных видов будет свидетельствовать об эволюции генетических систем, обеспечивающих данные изменения.
Значительное изменение экспрессионного паттерна у человека по сравнению с современными гоминидами показано для клеток, связанных с траекториями развития мозга, в том числе с временем начала синаптогенеза и длительностью процесса миелинизации. Ускоренное изменение профилей экспрессии было также показано для тканей яичек и жировой ткани. Используя МультиОМНые атласы развития гоминидов и подходы «обратной генетики», применяющие технологии изменения заданных последовательностей ДНК и анализ последствий для фенотипа (анализ пути от гена к фенотипу), удалось показать, что HAR-области коррелируют с положением энхансеров, активных в незрелых нейронах и более ранних предшественниках, предполагая связь соответствующих генов со спецификой развития человеческого мозга и формирования структуры взрослого мозга. Возникает вопрос – новые или изменившиеся структуры мозга человека связаны с новым типом нейронов, возникающим из предшественников в раннем развитии, или перераспределением консервативных старых типов в новые области? Для ответа на этот вопрос недостаточно сопоставления паттернов экспрессионной активности нейронов и их траекторий миграции в развивающемся мозге, тем более, что для гоминид этот материал недоступен. Нужны новые модели.
Модели для функциональных исследований. Одной из успешно применяемых моделей стали репортерные исследования на мышиных эмбрионах. В этих моделях используют трансгенных мышей с репортерными генами, регулируемыми специфическими для человека последовательностями. Так было подтверждено участие специфических HAR в развитии дистальных отделов конечностей и дуги глотки (HACNS1), неокортекса (HARE55), потере специфических морфологических образований (шипов) при развитии полового члена (hCONDEL569). На основе полученных результатов формируется новый класс моделей, так называемые «гуманизированные» мышиные модели с конструкциями, содержащими уже человеческие гены под регуляцией соответствующего HAR. Экспрессия человеческих генов в животных моделях позволяет оценить физиологические и морфологические инновации, связанные с изменениями структуры белка.
Мощным потенциалом для эволюционных исследований обладают модели стволовых клеток. Использование их для создания физиологически значимых систем позволяет анализировать динамику процессов дифференцировки и перемещения клеток, ответ на изменения среды, в том числе на действие различных эндогенных регуляторов развития, использовать разнообразные генетические манипуляции и на любой стадии формирования системы использовать высокопроизводительный скрининг на уровне ДНК, РНК и белков. Культивируемые стволовые клетки являются возобновляемым ресурсом, и применимы для широкого класса моделей, включая анализ патогенных изменений в регуляции генов, исследований уязвимости к видовым заболеваниям (вирусный тропизм). Основной проблемой при использовании «взрослых» стволовых клеток для эволюционных исследований является их ограниченная способность к дифференцировке, что не позволяет формировать аналоги тканей, состоящих из разных типов клеток, на основе выбранной линии стволовых клеток. Этой проблемы лишены линии индуцированных плюрипотентных стволовых клеток (iPSC), полученных из дифференцированных клеток путем перепрограммирования. В настоящий момент усилия клеточных биологов, участвующих в сравнительном анализе моделей на основе iPSC различных видов, направлены на оптимизацию протоколов создания и поддержания клеточных культур с учетом видовой специфики клеток, минимизацию последствий перепрограммирования на мутационном уровне.
Наконец, на основе стволовых клеток и iPSC созданы и успешно применяются модели органоидов для сравнительных эволюционных исследований. Органоиды воспроизводят некоторые морфологические и функциональные аспекты тканей и используются для моделирования процессов регенерации и развития. Для моделирования связей между различными типами клеток и выявления эволюционных инноваций используются гомологичные сборки органоидов разной степени сложности. Сравнение клеточных фенотипов и экспрессионных профилей клеток полученных органоидов с клеточными атласами имеет решающее значение для подтверждения точности моделирования физиологии человека и родственных видов обезьян.
Применимость iPSC для эволюционного анализа физиологических, регенерационных и онтогенетических моделей подтверждена в ряде исследований на дифференцирующихся кардиомиоцитах и органоидах мозга, полученных из iPSC человека и обезьян. Так, показано значительное совпадение дифференциальной экспрессии генов в экспериментальных моделях с наблюдаемой в естественных клетках и тканях сравниваемых видов. Анализ развития и созревания нейронов в 2D- и 3D-культурах органоидов человека и шимпанзе выявил рост продолжительности прометафазы-метафазы предшественников нейронов человека, дифференциальную экспрессию в радиальных глиальных и нейрональных клетках, повышенную активацию сигнального пути PI3K-AKT-mTOR. Эти изменения связаны с дифференциальной доступностью хроматина в клетках человека. Анализ развития кортикальных органоидов подтверждает выводы, сделанные на мышиных моделях о роли экспрессии специфичного для человека дуплицированного гомолога гена NOTCH - NOTCH2NLA, задерживающего дифференцировку нейронов, что приводит к увеличению числа нейронных предшественников и коры головного мозга. В моделях на основе iPSC используется также подход культивирования смешанных культур клеток от разных видов. В таких моделях достигается физиологически однородная среда и оцениваются эндогенные процессы роста и дифференцировки клеток. Для анализа исключительно цис-регуляторных эволюционных изменений применяют модели со слитыми аллотетраплоидными iPSC человека и шимпанзе, используя в качестве контрольных линий автотетраплоидные клетки этих-же видов.
Новые генетические подходы к анализу эволюционных изменений на клеточном уровне представлены применением систем CRISPR–Cas. Применение методов редактирования генома к iPSC и анализ органоидов коры головного мозга, полученных на основе отредактированных iPSC по архаичному аллелю NOVA1 показали отличия в экспрессии генов и сплайсинге, а на клеточном уровне – изменение поведения клеток и структуры органоидов. Сборка органоидов из контрольных и отредактированных iPSC и применение технологии single-cell секвенирования позволяет оценивать контрольные и мутантные фенотипы в пределах одного органоида, т.е. в пределах общей среды развития. Массивно-параллельные репортерные анализы (MPRA) и самотранскрибирующее секвенирование активных регуляторных областей (STARR-seq) представляют собой высокопроизводительные методы полногеномного анализа регуляторныз последовательностей. Их применение для сравнительного анализа изменчивости энхансеров и промоторов, специфичных для разных типов клеток человека и приматов, позволило выявить специфические для человека мутации со значительными регуляторными эффектами, пути, обогащенные цис-регуляторными изменениями, и влияние транс-регуляторов на цис-регуляторную активность.
В заключении, можно сказать, что открывшиеся возможности применения современных методов для анализа эволюционно-значимой изменчивости, в первую очередь человека и гоминидов, знаменуют собой новый уровень понимания эволюционных закономерностей формирования вида Homo sapiens.
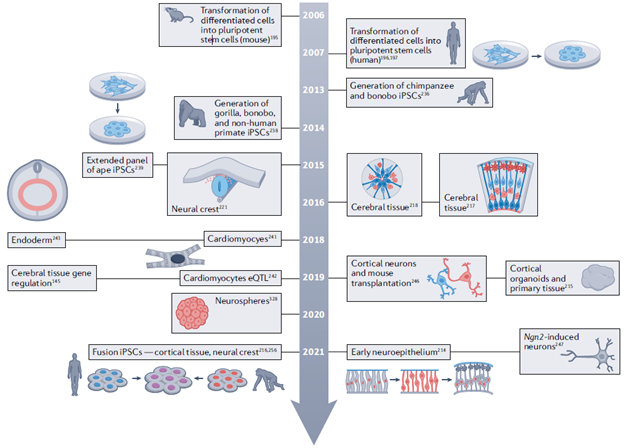
Рисунок из обзора. Вехи в использовании стволовых клеток обезьян для изучения уникальных особенностей физиологии человека. На рисунке показан график этапов использования стволовых клеток из человекообразных обезьян для изучения развития человека.
Новость подготовил
© А.М.Куликов
25.09.2023