© Ржанова Любовь Александровна, н.с., к.б.н. Лаборатория проблем регенерации ИБР РАН.
© Ржанова Любовь Александровна, н.с., к.б.н. Лаборатория проблем регенерации ИБР РАН.
© Александрова Мария Анатольевна, г.с., д.б.н., профессор. Лаборатория проблем регенерации ИБР РАН.
Дегенеративные заболевания сетчатки, такие как возрастная макулярная дистрофия (ВМД) и пигментный ретинит, вызывающие необратимую потерю зрения, характеризуются дегенерацией фоторецепторов и клеток пигментного эпителия. Для восстановления или замены поврежденных клеток изучаются возможности клеточной терапии, так некоторые типы стволовых и соматических клеток были конвертированы в клетки подобные фоторецепторам. Однако вопросы, касающиеся эффективности репрограммирования и молекулярных процессов, лежащих в его основе, еще требуют разрешения. В настоящие время большое внимание уделяется химическому репрограммированию малыми молекулами. Использование этого подхода для индукции плюрипотентных или функционально дифференцированных клеток из соматических клеток достигло значительных успехов в связи с тем, что комплексы малых молекул повышают эффективность репрограммирования и ускоряют процесс дифференцировки. В недавно опубликованной работе китайских и американских исследователей представлены данные клеточных и молекулярных механизмов химического репрограммирования малыми молекулами клеток ретинального пигментного эпителия (РПЭ) человека в фоторецепторные клетки сетчатки (Deng et al., 2022). Авторы анализировали транскриптомные и эпигенетические изменения в клетках в процессе клеточной конверсии методами секвенирования РНК, секвенирование РНК одиночных клеток и изучали метилирование ДНК.
Химическое репрограммирование клеток человека из фетального РПЭ (хиРПЭ) на 12-18 н.р. и дермальных фибробластов (хиФ) в фоторецепторные клетки (хиФР) in vitro (Mahato et al., 2020) проводили при помощи 5 низкомолекулярных факторов (5F): VPA (HDAC - ингибитор), CHIR99021 (ингибитор GSK3β), Repsox (ингибитор TGF-β), Форсколин (активатор аденилатциклазы) и IWR1 (ингибитор Wnt сигнального пути). Для стимуляции и поддержки образования фоторецепторов использовали Shh, таурин и ретиноевую кислоту. Параллельно авторы изучали эффективность клеточной конверсии методом подавления РНК-связывающего белка PTBP1 при помощи антисмысловых олигонуклеотидов (ASO) и показали, что одного подавления PTBP1 недостаточно для репрограммирования клеток фибробластов и РПЭ в фоторецепторы in vitro. Только при совместном воздействии низкомолекулярных факторов и ASO (5FA) повышалась скорость и эффективность конверсии.
В процессе химического репрограммирования in vitro клетки РПЭ человека начиная с 3-х суток экспрессировали гены, связанные с фоторецепторами (TUJ1, MAP2, RHODOPSIN (RHO), RECOVERIN (RCVRN) и CRX), что было показано методами иммунохимии и вестерн-блота. Эти фоторецептороподобные клетки были трансплантированы в субретинальное пространство глаза мышей с моделью сухой ВМД, вызванной NaIO3. Трансплантированные клетки человека успешно выживали и сохраняли характеристики фоторецептороподобных клеток после 4 недель трансплантации. На основе полученных данных авторы предположили, что клетки РПЭ человека можно рассматривать, как многообещающий источник фоторецепторов сетчатки для заместительной клеточной терапии.
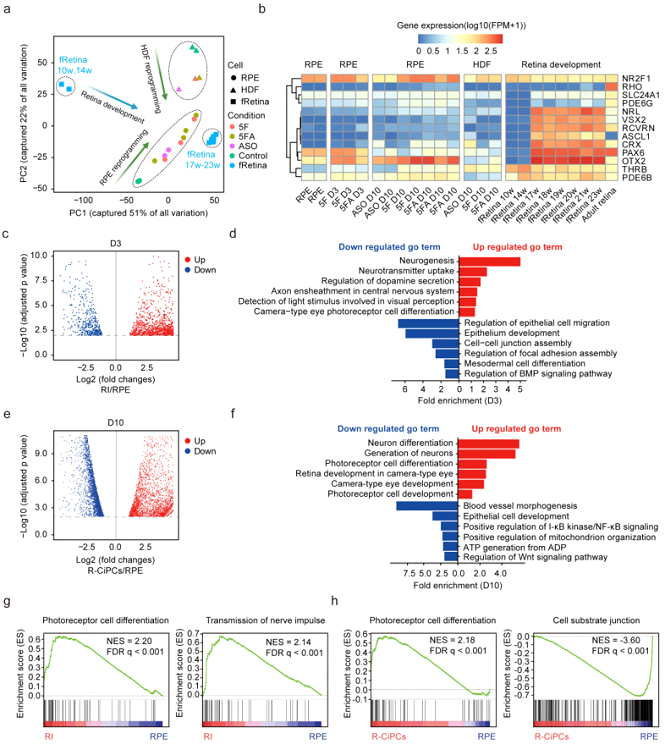
Чтобы всесторонне исследовать молекулярные изменения во время репрограммирования, авторы проводили секвенирование РНК клеток РПЭ и фибробластов на начальных (Д0), ранних (Д3, индукция 5F и 5FA) и поздних стадиях репрограммирования (Д10 с индукцией 5FA) (рис.1). Анализ основных компонентов хорошо различал каждый тип перепрограммированных клеток по их клеточному происхождению, при этом оба типа клеток следовали по пути перепрограммирования сходному с развитием сетчатки плода человека, демонстрируя эффективное изменение профиля транскрипции. Однако в хиРПЭ клетках гены фоторецепторов показали более высокие уровни экспрессии, чем в клетках хиФ. Авторы обнаружили 1068 дифференциально экспрессируемых генов (ДЭГ) между репрограммируемыми клетками и интактным РПЭ на третьи сутки конверсии. Анализ генетической онтологии выявил активацию генов участвующих в генезе нейронов, поглощении нейротрансмиттеров и дифференцировке фоторецепторных клеток (например, SOX8, IGFN1, ASCL1, RXRG, THRB и RORB), в то время как гены, отвечающие за регуляцию миграции эпителиальных клеток, развития эпителия и сборку межклеточных контактов были ингибированы (EGF и FGF2). На 10 сутки репрограммирования профиль транскриптома выявил устойчивую активацию генов специфичных для фоторецепторов палочек, но не для колбочек. Было обнаружено увеличение экспрессии нейронального транскрипционного фактора ASCL1 и активация пути глутамата, основного нейромедиатора фоторецепторов. Кроме того, в результате химической конверсии (5F) подавлялся эпителио-мезенхимальный переход, к которому склонны клетки РПЭ in vitro, за счет репрессии TGF-β сигнального пути.
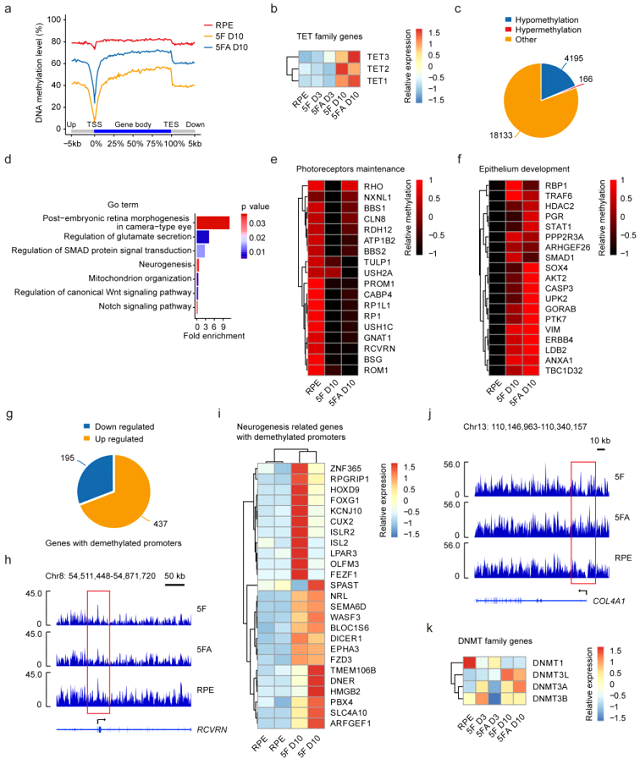
При исследовании метилирования ДНК в ходе репрограммирования, авторы отметили, что 5F индуцировали деметилирование всего генома (рис. 2). При этом 4195 генов, которые участвуют в регуляции секреции глутамата и нейрогенеза, показали резкое деметилирование в своих промоторах, что сопровождалось значительным увеличением экспрессии большинства нейрогенных генов (437 из 632 ДЭГ). 166 генов, функционально связанных с развитием эпителия, показали значительно повышенное метилирование ДНК в своих промоторах, и ослабленную экспрессию. Анализируя профили метилирования ДНК среди всех 27 535 проанализированных промоторов генов, 18 986 генов в хиФР демонстрировали близкий паттерн метилирования с фетальной сетчаткой. Изменение ландшафта метилирования ДНК в хиФР было связано с повышенной экспрессией всех генов в семействах эпигенетических факторов, TET и DNMT3, и ASCL1. Последний, как известно, пионерный нейрональный фактор транскрипции, индуцирует метилирование промоторов специфичных генов фибробластов во время их перепрограммирования в фоторецепторы (Mahato et al., 2020). Подводя итог, авторы предположили, что реконфигурация метилирования ДНК во время химического перепрограммирования является коллективным результатом эпигенетических факторов и регуляторов транскрипции.
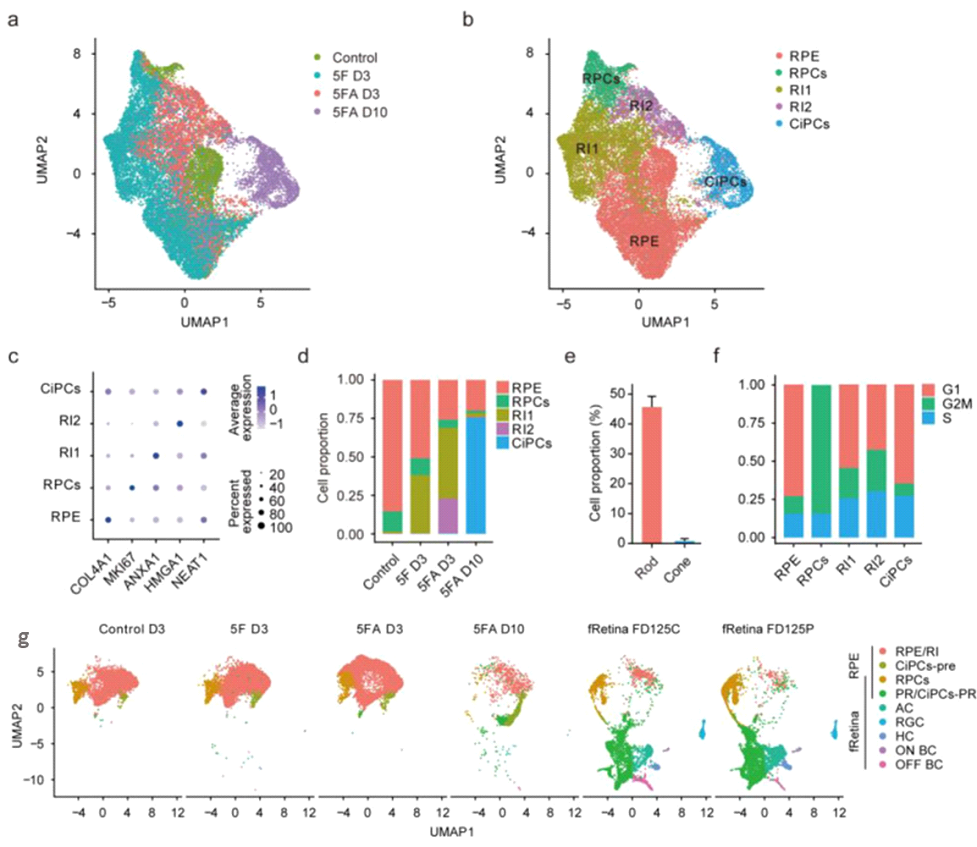
Интересно, что с помощью scRNA-seq авторы выделили пять транскрипционно различных кластеров по их уникальной экспрессии маркерных генов: клетки РПЭ; клетки-предшественники сетчатки (ПС); клетки в промежуточном состоянии - 1 (ПК-1); клетки в промежуточном состоянии - 2 (ПК-2) и хиФР (рис. 3). Оказалось, что в контрольной группе РПЭ присутствовали клетки, относящиеся к ПС. На третьи сутки после воздействия низкомолекулярных факторов основными клеточными компонентами культуры были клетки РПЭ, ПС и ПК-1. В то время как на 10 сутки конверсии доминировали хиФР клетки, из которых 46% были палочками, и только 1% колбочки. Чтобы понять молекулярные особенности клеточных подтипов, полученных в результате репрограммирования, авторы сравнили их транскриптомы с клетками РПЭ и показали, что в ПК-1 - 211 ДЭГ, ПК-2 - 1098 ДЭГ и хиФР - 859 ДЭГ. Все дифференциально экспрессируемые гены были связаны с нейрогенезом, ростом аксонов и дифференцировкой нейронов. Cell-Cycle Scoring - анализ на основе данных scRNA-seq, используя данные изменения длины фазы G1 в разных клеточных кластерах, показал, что клетки РПЭ человека после химической индукции повторно входят в клеточный цикл, пролиферируют, а после переходят в относительно стабильное состояние. Полученные результаты подтвердили, что химическое репрограммирование индуцирует постепенную конверсию клеток РПЭ от менее к более зрелым нейрональным клеткам. При помощи метода Monocle была построена псевдовременная шкала для репрограммируемых клеток РПЭ путем размещения каждой клетки в определенном положении на основе изменений экспрессии генов. Это показало на временной шкале, постепенное снижение экспрессии генов, связанных с РПЭ и увеличение генов связанных с развитием палочек. Сравнив данные scRNA-seq с результатами для сетчатки плода человека (на 125-й д.р.), авторы показали, что процесс репрограммирования клеток РПЭ в фоторецепторы напоминает раннее развитие сетчатки.
Ден с коллегами осуществили успешное репрограммирование клеток фетального РПЭ и дермальных фибробластов человека в фоторецепторные клетки, что им позволило провести сравнительный анализ эффективности репрограммирования разных типов клеток. Анализ основных компонентов на основе изменения профиля транскрипции показал, что хиФР клетки, происходящие от РПЭ или от фибробластов, хорошо различимы на основе их клеточного происхождения, и оба типа клеток следовали по пути перепрограммирования сходному с развитием сетчатки плода. Однако скорость и эффективность получения хиФР из РПЭ была намного выше, чем из фибробластов. Гены фоторецепторов демонстрировали более высокие уровни экспрессии в хиФР клетках, происходящих из РПЭ, чем из фибробластов. Данные профилей метилирования дермальных фибробластов и РПЭ показали, что большая часть различий в метилировании ДНК уже существовала до воздействия низкомолекулярных факторов. Это говорит о том, что сохраненная эпигенетическая память клеточного происхождения может способствовать разной эффективности репрограммирования исследуемых клеток. Клетки РПЭ по происхождению (Gupta et al., 2023), по эпигенетическим особенностям ближе к клеткам сетчатки (Dvoriantchikova et al., 2019), чем клетки фибробластов, поэтому эффективности репрограммирования РПЭ в фоторецепторы выше.
Проведенный авторами анализ scRNA-seq РПЭ человека и сравнение с scRNA-seq сетчатки позволяет наглядно представить репрограммирование клеток РПЭ в фоторецепторы, ощутить и понять многие тонкости этого процесса. А сравнение с scRNA-seq РПЭ и сетчатки у модельных животных позволит приблизиться к ответу на ряд вопросов, касающихся процессов трансдифференцировки и эпителио-мезенхимального перехода при регенерации и дегенерации сетчатки.
Список литературы
Deng, X., Lee, R., Lim, S. Y., Zhong, Z., Wang, J., Liu, Y., & Fan, G. (2022). Global Transcriptional and Epigenetic Reconfiguration during Chemical Reprogramming of Human Retinal Pigment Epithelial Cells into Photoreceptor-like Cells. Cells, 11(19), 3146. https://doi.org/10.3390/cells11193146
Dvoriantchikova, G., Seemungal, R. J., & Ivanov, D. (2019). The epigenetic basis for the impaired ability of adult murine retinal pigment epithelium cells to regenerate retinal tissue. Scientific Reports, 9(1), 3860. https://doi.org/10.1038/s41598-019-40262-w
Gupta, S., Lytvynchuk, L., Ardan, T., Studenovska, H., Faura, G., Eide, L., Znaor, L., Erceg, S., Stieger, K., Motlik, J., Bharti, K., & Petrovski, G. (2023). Retinal Pigment Epithelium Cell Development: Extrapolating Basic Biology to Stem Cell Research. Biomedicines, 11(2), 310. https://doi.org/10.3390/BIOMEDICINES11020310
Новость подготовили
© Ржанова Л.А. и Александрова М.А.
25.04.2023