 © Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
В феврале 2016 г в журнале Nature была опубликована статья «Naturally occurring p16Ink4a-positive cells shorten healthy lifespan» группы исследователей под руководством Jan M.van Deursen, из Mayo Clinic College of Medicine, Rochester, Minnesota, USA.
В этой статье авторы сообщают о разработке любопытной трансгенной мышиной модели с введенной генетической конструкцией, позволяющей постепенно элиминировать из организма стареющие клетки. Данная конструкция базируется на химерном белке FK506 – binding protein – caspase 8 (FKBP-Cas8), который способен в присутствии вещества AP20187 (AP) к димеризации и запуску каспазного каскада, что приводит в итоге к апоптозу клетки в которой экспрессируется FKBP-Cas8. Исследователи поставили FKBP-Cas8 под промотер гена p16 (также известный как Ink4a/ARF локус или Cdkn2a) и получили тем самым конструкцию, названную INK-ATTAC. Конструкция позволяет целенаправленно убивать стареющие клетки, поскольку известно, что экспрессия p16 является одним из характерных маркеров стареющих клеток выходящих из клеточного цикла. Авторы получили две мышиные линии, несущие данную конструкцию, первая состояла из смешанного генетического бэкграунда 129Sv×С57BL/6J×FVB, вторая была создана на основе линии C57BL/6J. В ходе проведения эксперимента исследователи, начиная с 12-го месяца жизни, еженедельно инъецировали мышам вещество AP, которое запускало INK-ATTAC и начинало апоптоз стареющих клеток (Группа +AP). В контрольной группе мышам еженедельно инъецировали пустой раствор-носитель (Группа -AP). В дальнейшем была проведена кропотливая и достаточно долгая (длительность некоторых экспериментов превысила 1000 дней) работа по сравнительному анализу содержания стареющих клеток в организме, накоплению возрастных изменений в различных тканях и органах, а также анализу возрастных изменений поведенческих реакций, таких как снижение двигательной активности и т.н. «исследовательское поведение».
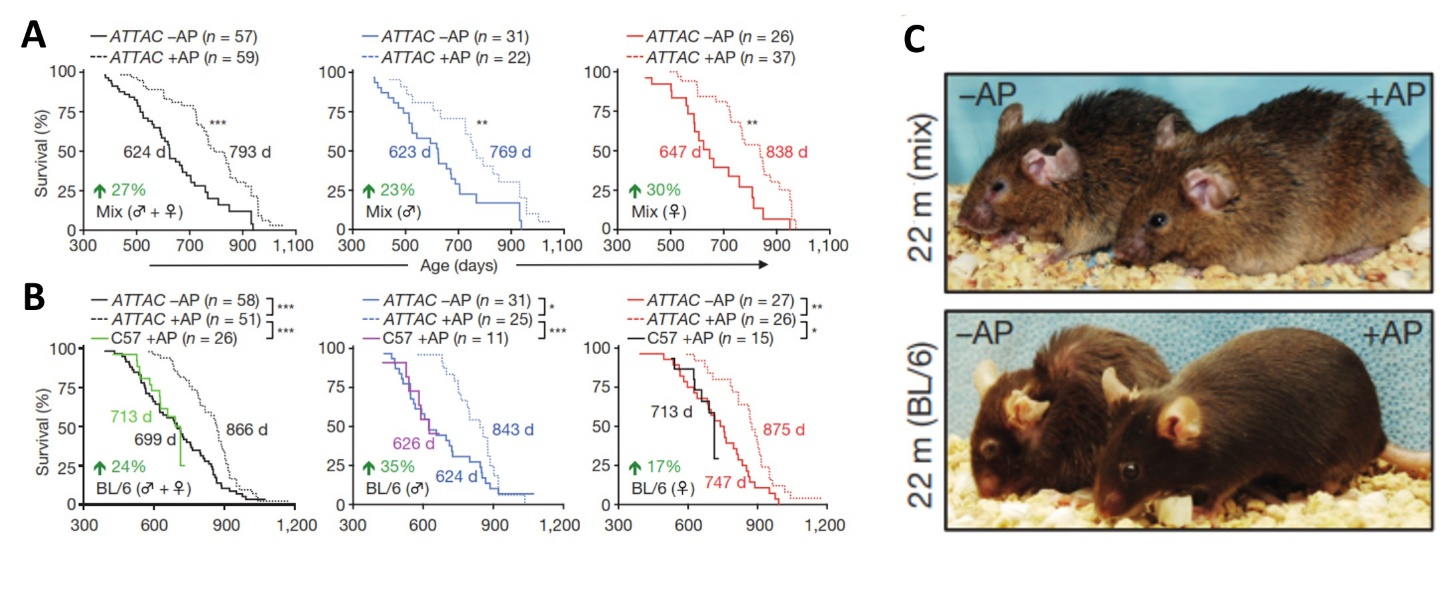 |
Рис.1. А – Графики выживания мышей первой линии, со смешанным генетическим бэкграундом (129Sv×С57BL/6J×FVB). Показано, что в случае удаления стареющих клеток медиана продолжительности жизни мышей значительно увеличивается (от 23% до 30%). B – Графики выживания мышей второй линии (С57BL/6J). Показано, что в случае удаления стареющих клеток медиана продолжительности жизни мышей значительно увеличивается (от 17% до 35%). Линия C57 + AP – негативный контроль, интактные мыши C57BL которым инъецировали AP, чтобы доказать, что само по себе вещество AP не является геронтопротектором. С – Репрезентативная фотография внешнего вида старых (22 месяца) мышей без удаления стареющих клеток (- AP) и с удалением стареющих клеток (+AP).
Что же удалось понять из данного исследования? Во-первых, и это самое главное следствие данной работы, удалось показать, что накопление стареющих p16+ клеток в ходе жизни негативно влияет на ее продолжительность. Во-вторых, в работе было проанализирована статистика смертности от онкологических заболеваний и было убедительно показано, что удаление стареющих клеток достоверно снижает количество раковых заболеваний в двух исследуемых группах мышей (на 25% и 18%). По всей видимости, делают вывод авторы, стареющие клетки могут создавать микроокружение (несмотря на то что сам по себе белок p16 является сильным онкосупрессором), которое облегчает процессы канцерогенеза. В третьих, было показано что темпы накопления возрастных изменений в различных тканях организма, таких как жир, глаза, сердце, почки, равно как и возрастные изменения поведенческих реакций – были существенно снижены в мышах с удаленными стареющими клетками.
Таким образом, полученные результаты представляют собой большую ценность для разработки лекарств и методов, направленных на увеличение общей средней продолжительности жизни, а также лечения заболеваний, связанных с преждевременно стареющими клетками или для компенсации терапий, вызывающих преждевременное старение клеток.
Новость подготовил © 2016 Дашинимаев Э.Б.