Область научных интересов: молекулярная биология, социобиология, апиология.
Инфекционные болезни представляют серьёзную угрозу для социумов, в которых особи живут в тесном контакте друг с другом. У общественных насекомых получило развитие коллективное защитное поведение – забота об инфицированных или их изоляция, что предотвращает вспышки инфекций. Авторы публикации выдвигают гипотезу, что индивидуальный иммунитет у общественных видов насекомых эволюционировал в сторону сокращённого, но всё же эффективного механизма, специализирующегося на борьбе с микробами, на которые не нацелен социальный иммунитет. Они изучали иммунный ответ черного садового муравья Lasius niger, используя комбинацию количественной оценки экспрессии генов, геномного анализа, экспериментальных заражений, поведенческих наблюдений и количественной оценки патогенов. В результате такого комплексного исследования выявлена удивительная специализация иммунных реакций на различные патогены. Индивидуальный иммунитет эффективен против бактериальных инфекций, которые не предотвращает социальный иммунитет. Но в отношении грибковых инфекций индивидуальный иммунитет бесполезен, в отличие от социального иммунитета. Эта специализация говорит о том, что рассматриваемые виды иммунитета приобрели дополнительные функции, которые, как предполагается, обеспечивают наиболее эффективную реакцию на широкий спектр патогенов. Далее, рассмотрим эту тему и проведенное исследование более подробно.
Для сложно организованных сообществ важно ограничение распространения инфекционных заболеваний из-за частых контактов между особями. У большинства видов многоклеточных животных это достигается с помощью иммунной системы, которая борется с инфекциями и повышает устойчивость на индивидуальном уровне (индивидуальный иммунитет). Кроме того, у некоторых высоко социальных видов развилось как профилактическое, так и вызванное патогенами коллективное поведение, которое снижает риск передачи патогенов между особями, и обеспечивает защиту на уровне сообщества, называемое социальным иммунитетом. О социальном иммунитете сообщалось у многих видов, включая людей, летучих мышей, гуппи, воробьёв и общественных насекомых, но взаимодействие и соотношение между индивидуальной и социальной защитой остается малоизученным (Stockmaier et al., 2021).
Механизмы социального иммунитета наиболее хорошо изучены у общественных насекомых (муравьёв, термитов, некоторых пчёл и ос), которые используют целый ряд социальных защитных механизмов, таких как перестройка социального взаимодействия, изоляция заражённых рабочих, уничтожение заражённого потомства, повышение температуры в гнезде (Stroeymeyt et al., 2018; Philip et al., 2000). Из-за высокой эффективности механизмов социального иммунитета в предотвращении вспышек заболеваний было высказано предположение, что высоко социальным видам больше не требуется сильный индивидуальный иммунитет. Однако эта гипотеза не подтверждается фактами. Геномные исследования показали, что основные иммунные пути насекомых (пути NF-кB Toll и IMD) у пчел и термитов упрощены, но эти результаты не были дополнены функциональными исследованиями. Кроме того, описанное упрощение в основном затрагивает регуляторные и эффекторные гены, в то время как основные компоненты этих путей сохраняются и демонстрируют признаки положительного отбора у общественных насекомых. Экспрессия отдельных иммунных генов индуцируется у маток и рабочих особей муравьев при инфекциях, это говорит о том, что индивидуальный иммунитет может быть вполне функциональным у этих видов.
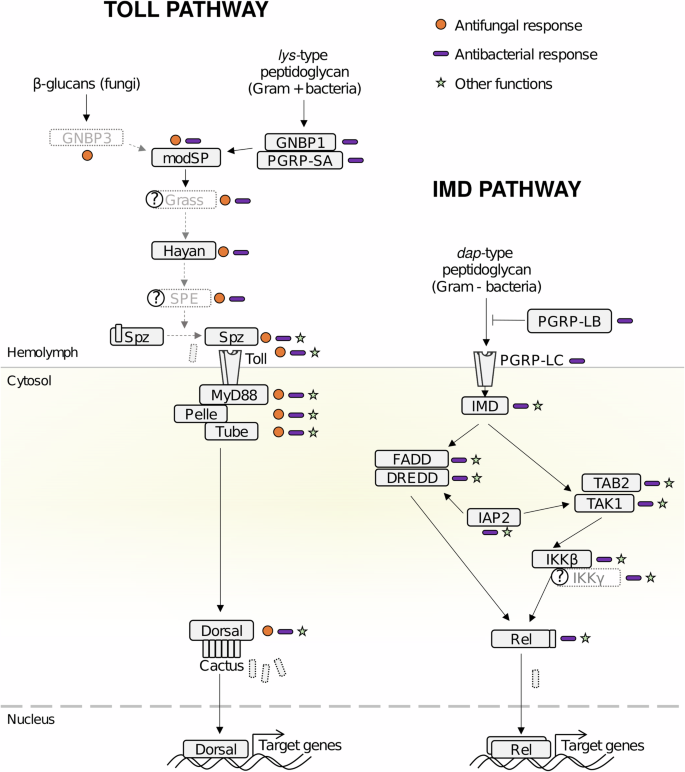
Геном L. niger кодирует полные пути NF-κB
Семейство факторов транскрипции NF-кB играет центральную роль в координации экспрессии широкого спектра генов, контролирующих иммунные реакции. Они участвуют в активации и регуляции экспрессии ключевых молекул, которые связаны с различными заболеваниями – от воспалений до онкологии у позвоночных. У Drosophila путь IMD в основном реагирует на пептидогликан (PGN) грамотрицательных бактерий, который является компонентом клеточной стенки всех грамотрицательных и некоторых грамположительных бактерий, а путь Toll в основном реагирует на PGN грамположительных и некоторых грамотрицательных бактерий, а также на β-глюканы клеточных стенок грибов (рис. 1) (Buchon et al., 2014). Несмотря на отдельные различия, основные компоненты этих путей в значительной степени сохраняются у разных насекомых, включая перепончатокрылых, таких как шмели, медоносные пчёлы и муравьи. Геном L. niger кодирует гомологи всех ключевых компонентов сигнального пути IMD (рис. 1), кроме IKKγ, но есть белок-кандидат с функциональными доменами «необходимого модулятора NF-κB», который может выполнять функцию IKKγ у L. niger, что позволяет предположить, что путь IMD у этого вида функционально завершён.
Рис. 1: Иммунные пути NF-κB D. melanogaster и L. niger. У дрозофилы активация пути IMD опосредована распознаванием PGN мембранным рецептором PGRP-LC, который запускает внутриклеточный сигнальный каскад, активируя белок Imd, содержащий домен апоптоза. Imd образует комплексы с FADD и каспазой DREDD и активируется путём расщепления и убиквитинилирования, опосредованного DREDD и Iap2 соответственно. Это приводит к активации комплекса Tab2/Tak1, который активирует комплекс IKK, что, в свою очередь, приводит к активации расщепления фактора транскрипции NF-κB Relish. Расщеплённый Relish димеризуется, перемещается в ядро и регулирует экспрессию генов-мишеней. Путь Toll начинается со связывания PGN-лизина и β-глюканов с их рецепторами, что запускает внеклеточный ферментативный каскад, активируя расщепление сериновых протеаз, включая ModSP, Grass, Hayan и Spätzle-Processing-Enzyme (SPE). Кульминацией каскада является расщепление Spätzle (Spz) ферментом SPE и его связывание с мембранным рецептором Toll. Каскад внутриклеточных сигналов, следующий за Toll, запускает деградацию ингибитора NF-κB Cactus, который высвобождает факторы транскрипции Dorsal и Dorsal-Interacting Factor (DIF), которые перемещаются в ядро и регулируют экспрессию генов-мишеней. Прямоугольники с чёрными линиями указывают на наличие гомолога в геноме L. niger. Серые прямоугольники с пунктирными линиями указывают на отсутствие гомолога. Вопросительные знаки указывают на неопределённость (наличие генов из того же семейства со значительной гомологией, но без чёткой идентификации). Стрелки указывают на белок-белковые взаимодействия, описанные в литературе по D. melanogaster. Кружки обозначают гены, участвующие в противогрибковом иммунитете, палочки — в антибактериальном иммунитете, а звёздочки — не иммунные функции.
В совокупности эти данные свидетельствуют о том, что оба пути у L. niger структурно схожи с путями у других перепончатокрылых. Однако, несмотря на то, что путь IMD, по-видимому, является завершённым и, следовательно, может быть полностью функциональным, меньшее количество генов, кодирующих путь Toll, по сравнению с другими перепончатокрылыми, и псевдогенизация одной копии поднимают вопрос о том, может ли путь Toll в L. niger правильно распознавать грибы.
Индивидуальный иммунитет L. niger зависит от набора противомикробных пептидов
Затем был проведен поиск генов, кодирующих противомикробные пептиды (AMP), основные иммунные эффекторы, контролируемые сигнальными путями NF-κB. AMP — это короткие катионные пептиды, которые в больших количествах секретируются жировой тканью для борьбы с проникающими микробами. Селективная активация сигнальных путей Toll или IMD приводит к активации подмножества генов AMP, адаптированных к классу обнаруженных патогенов. В геноме L. niger обнаружили только четыре гена, кодирующих АМП, предположительно участвующих в иммунитете: один гименоптецин (Hym), два дефензина (Def 1 и 2) и один крустин (Cru). Гименоптецины — это АМП широкого спектра действия, специфичные для перепончатокрылых. У L. niger промотор Hym содержит до 4 сайтов связывания для Relish (фактора транскрипции пути IMD) и 2 сайта связывания для Dorsal (основного фактора транскрипции пути Toll), что указывает на контроль со стороны пути IMD с возможным влиянием пути Toll. Дефензины широко распространены среди многоклеточных животных и в первую очередь активны против грамположительных бактерий, а также иногда против грамотрицательных бактерий и грибков. Промотор L. niger Def1 не содержит предполагаемых сайтов связывания NF-κB, что позволяет предположить, что его регуляция не зависит от этих путей. Промотор L. niger Def2 содержит два предполагаемых сайта связывания Dorsal, что позволяет предположить, что он регулируется Toll-зависимым образом. Крустины — это большое семейство АМП, которые в основном встречаются у ракообразных. У L. niger промотор Cru не содержит предполагаемого сайта связывания Relish и только один сайт связывания Dorsal, что указывает на слабую регуляцию по пути Toll или независимую от NF-κB регуляцию.
Синтез антимикробных пептидов у L. niger вызывается бактериальными, но не грибковыми инфекциями
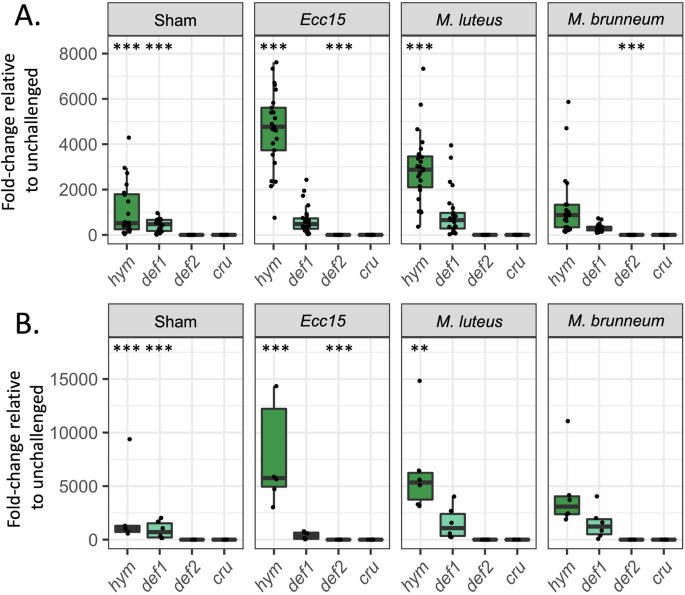
Чтобы экспериментально оценить способность этих AMП реагировать на микробные инфекции, вводили различные микробы в брюшную полость рабочих особей L. niger: Erwinia carotovora carotovora 15 (Ecc15), грамотрицательную бактерию, которая, как ожидается, активирует путь IMD, Micrococcus luteus, грамположительную бактерию, которая, как ожидается, активирует путь Toll, и конидиоспоры Metarhizium brunneum, энтомопатогенный гриб широкого профиля, который, как ожидается, активирует Toll-путь. Сравнение экспрессии генов у здоровых и обработанных по контрольной схеме муравьёв (которым вводили стерильный буфер) показало значительную индукцию AMП при повреждении тканей для Hym и Def1, но не для Def2 или Cru (рис. 2) В целом эти результаты показывают, что Hym реагирует как на повреждение тканей, так и на бактериальные сигналы, в то время как Def1 реагирует только на повреждение тканей. Def2 и Сru соответственно подавляются или не реагируют на раздражители и, таким образом, вряд ли являются основными факторами системного иммунного ответа. Примечательно, что Hym, Def1 и Cru не вырабатывались в ответ на заражение грибком, что позволяет предположить, что пути NF-κB L. niger не реагируют на грибковые инфекции выработкой АМП. Повторение такого же эксперимента с использованием муравьиных маток, продемонстрировало такую же иммунную способность, как и у рабочих особей (рис. 2B). Это указывает на то, что способность особи вырабатывать иммунный ответ на воздействие микроорганизмов не зависит от касты у L. niger. Введение термически обработанных спор Beauveria bassiana, ещё одного энтомопатогенного гриба, привело к экспрессии AMП, сопоставимой с той, что наблюдалась после введения термически обработанных спор M. brunneum. Это указывает на то, что отсутствие специфической для гриба реакции является общей чертой индивидуального иммунитета L. niger, а не специфической для M. brunneum.
Рис. 2: экспрессия генов AMП при индивидуальном иммунном ответе. RT-qPCR-анализ индукции генов, кодирующих AMП, в ответ на инфекции у рабочих особей (A) и у маток (B), выраженный в виде кратного изменения экспрессии по сравнению с особями, не подвергшимися воздействию (N = 20–26). Точки обозначают отдельные данные. Диаграммы обозначают медиану и межквартильный размах биологических повторений. Верхние/нижние границы — это значения в пределах 1,5-кратного межквартильного размаха выше/ниже 75-го процентиля. Звездочки в контрольной группе указывают на значительную разницу по сравнению с контрольной группой без заражения. Звездочки в группе с заражением указывают на значительную разницу по сравнению с контрольной группой без заражения. ***p < 0,001; **p < 0,01.
Муравьи восприимчивы к условно-патогенным бактериальным инфекциям
Результаты показывают, что иммунная система L. niger специфически реагирует на бактерии, но не на грибы. Это поднимает вопрос о давлении отбора, которое позволяет эволюционировать такой специализированной иммунной системе. В колониях редко наблюдаются массовые бактериальные инфекции, однако известно, что кутикула нескольких видов муравьёв часто содержит патогенные бактерии. Таким образом, авторы предположили, что антибактериальный иммунный ответ может быть экологически целесообразным для борьбы с инфекциями, то есть с комменсальными бактериями, которые становятся патогенными, когда проникают во внутренние ткани через кутикулу.
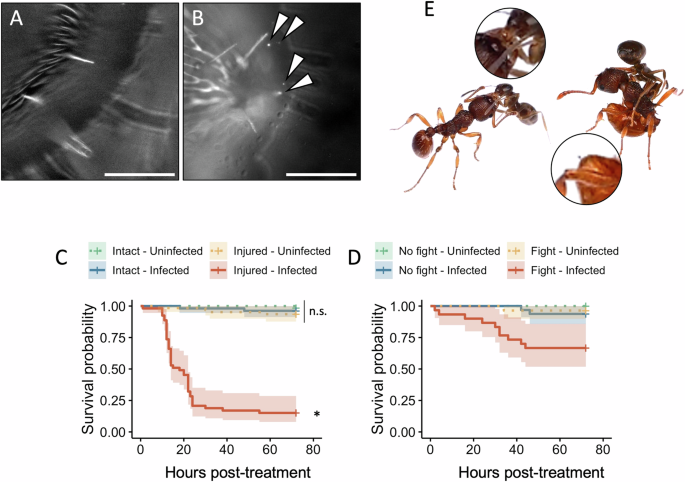
Это проверено на бактериях Pseudomonas entomophila, обитающих в почве энтомопатогенных бактериях-универсалах. Сначала убедились, что P. entomophila прикрепляется к кутикуле рабочих особей, ненадолго окунув их в суспензию флуоресцентных бактерий низкой плотности. Через 10 минут бактерии были видны на грудке муравьев, что указывает на то, что воздействие в природе может привести к появлению бактерий на кутикуле (рис. 3A, B). Затем проверили последствия воздействия P. entomophila после стерильного удаления одной антенны (рис. 3C). Не наблюдалось существенного влияния стерильной травмы или воздействия только на выживаемость муравьев, но большинство муравьев, подвергшихся воздействию P. entomophila после ранения, погибли в течение суток, что указывает на то, что рана является фатальным путем проникновения энтомопатогенных бактерий.
Рис. 3: Рабочие особи восприимчивы к условно-патогенным бактериальным инфекциям. A–B Кутикула грудки рабочей особи, погруженной (A) в стерильный раствор или (B) в суспензию P. entomophila-GFP (стрелки). Масштабная линейка = 100 мкм. N = 5. C Выживаемость рабочих особей L. niger в зависимости от целостности тела (нетронутые vs. поврежденные) и воздействия суспензии P. entomophila (неинфицированные vs. инфицированные). Штриховкой обозначены 95-процентные доверительные интервалы. N = 30 особей. «n.s.» означает отсутствие значимой разницы между вариантами, а звёздочка указывает на статистически значимую разницу со всеми остальными вариантами. D Выживаемость рабочих особей L. niger в зависимости от борьбы с рабочими особями M. rubra (без борьбы vs. с борьбой) и воздействия суспензии P. entomophila (неинфицированные vs. инфицированные). Штриховкой обозначены 95-процентные доверительные интервалы. N = 30 особей. E Иллюстрации агрессивного поведения L. niger и M. rubra. Слева — захват нижней челюсти. Справа — M. rubra вытягивает жало.
Затем оценили экологическую значимость таких условно-патогенных бактериальных инфекций. Муравьи обычно агрессивны по отношению к другим видам, поэтому предположили, что межвидовые драки могут привести к травмам, которые могут быть смертельными, если в кутикуле муравья содержатся энтомопатогенные бактерии. Авторы проверили это, организовав парные встречи между рабочими L. niger и Myrmica rubra, симпатрическими видами, затем подвергнув их воздействию P. entomophila и наблюдая за их выживанием. Во время столкновений («схваток») наблюдали агрессивное поведение, такое как укусы, которые могут привести к микротравмам, особенно на суставах, или когда рабочие особи M. rubra вытягивают жало, что может привести к колотым ранам (рис. 3E). Хотя только одна схватка привела к видимым повреждениям (потеря антенн), смертность L. niger после контакта с P. entomophila после схватки была в пять-десять раз выше, чем после контакта с бактериями или после одиночной схватки (рис. 3D). Ни один муравей не погиб в контрольной группе (без борьбы — без воздействия). Борьба с внешними бактериями угрожает выживанию муравьёв, что является следствием повреждений кутикулы, связанных с борьбой, поскольку эти результаты в точности совпадают с результатами, полученными при повреждениях, нанесённых экспериментатором (рис. 3C). В совокупности эти результаты свидетельствуют о том, что рабочие муравьи подвержены бактериальным инфекциям, возникающим в результате повреждения кутикулы, и что такие повреждения могут возникать в экологически значимых условиях, таких как территориальные бои.
Затем оценили экологическую значимость таких условно-патогенных бактериальных инфекций. Муравьи обычно агрессивны по отношению к другим видам, поэтому предположили, что межвидовые драки могут привести к травмам, которые могут быть смертельными, если в кутикуле муравья содержатся энтомопатогенные бактерии. Авторы проверили это, организовав парные встречи между рабочими L. niger и Myrmica rubra, симпатрическими видами, затем подвергнув их воздействию P. entomophila и наблюдая за их выживанием. Во время столкновений («схваток») наблюдали агрессивное поведение, такое как укусы, которые могут привести к микротравмам, особенно на суставах, или когда рабочие особи M. rubra вытягивают жало, что может привести к колотым ранам (рис. 3E). Хотя только одна схватка привела к видимым повреждениям (потеря антенн), смертность L. niger после контакта с P. entomophila после схватки была в пять-десять раз выше, чем после контакта с бактериями или после одиночной схватки (рис. 3D). Ни один муравей не погиб в контрольной группе (без борьбы — без воздействия). Борьба с внешними бактериями угрожает выживанию муравьёв, что является следствием повреждений кутикулы, связанных с борьбой, поскольку эти результаты в точности совпадают с результатами, полученными при повреждениях, нанесённых экспериментатором (рис. 3C). В совокупности эти результаты свидетельствуют о том, что рабочие муравьи подвержены бактериальным инфекциям, возникающим в результате повреждения кутикулы, и что такие повреждения могут возникать в экологически значимых условиях, таких как территориальные бои.
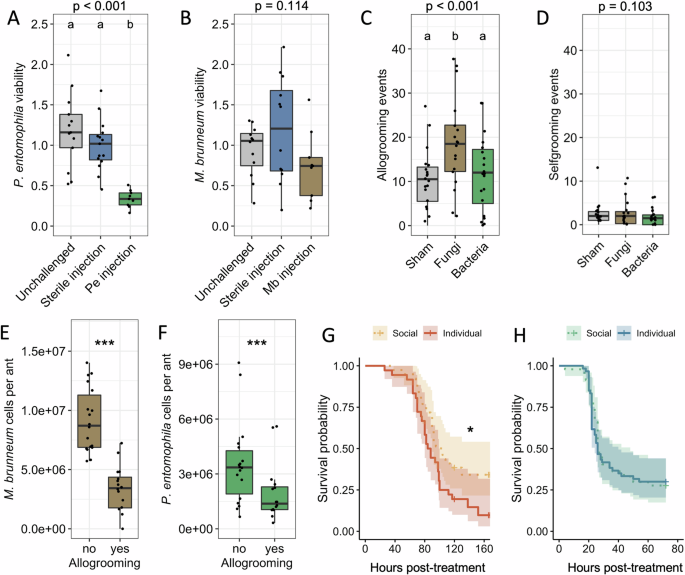
Чтобы подтвердить, что индивидуальный иммунитет эффективен против бактерий, но не против грибов, авторы сравнили противомикробную активность гемолимфы у муравьёв, которым ничего не вводили, и у муравьёв, которым вводили стерильную воду или предварительно вводили убитые нагреванием бактерии или грибки, чтобы вызвать специфический иммунный ответ. Гемолимфу обрабатывали, чтобы удалить иммунные клетки и предотвратить меланизацию, тем самым гарантируя, что основными иммунными эффекторами являются AMП. Результаты показывают, что праймирование муравьев термически убитой P. entomophila значительно повысило активность их гемолимфы против данного микроба, в то время как стерильная инъекция этого не сделала (рис. 4A). Напротив, ни стерильная инъекция, ни праймирование муравьев термически убитым M. brunneum не увеличивали активность их гемолимфы в отношении данного грибка (рис. 4B). Это подтверждает, что внутренняя бактериальная инфекция вызывает антибактериальный ответ, но внутренняя грибковая инфекция не вызывает противогрибковый ответ.
Рис. 4: индивидуальный и социальный иммунитет обеспечивают защиту от различных классов патогенов. Жизнеспособность (A) P. entomophila и (B) M. brunneum, инкубированных в гемолимфе, полученной от муравьев, не подвергшихся заражению (серого цвета), инъекция стерильного раствора (синего цвета) или зараженных микробами, убитых нагреванием (P. entomophila ‘Pe’, зеленый; M. brunneum ‘Mb’, коричневый; N = 9-15). Количество случаев (C) взаимного ухода и (D) самоочищения, наблюдаемых после внешнего воздействия на муравья стерильным буфером, спорами грибов или бактериями (N = 18–20). Количественная ПЦР (E) M. brunneum и (F) P. entomophila до и после взаимного ухода со стороны соседей по гнезду (N = 16). (A–F) Точки обозначают отдельные данные. Диаграммы обозначают медиану и межквартильный размах повторений. Верхние/нижние штрихи обозначают значения в пределах 1,5 межквартильного размаха выше/ниже 75-го процентиля. (A–D) Значения P для основного эффекта воздействия указаны в верхней части каждого графика. Буквами обозначены группы, которые статистически отличались с поправкой Бенджамини-Хохберга на множественные сравнения. (E–F) ***p < 0,001 (LMM). Выживаемость раненых муравьёв, подвергшихся воздействию (G) M. brunneum или (H) P. entomophila, при совместном содержании или в изоляции (N = 60 для G и N = 40 для H). Штриховкой обозначены 95% доверительные интервалы. Данные были проанализированы с помощью модели Кокса со смешанным эффектом. *p < 0,05.
Аллогруминг — основной механизм социального иммунитета, который заключается в удалении инфекционных частиц с кутикулы муравья его сородичами. Было обнаружено, что внешнее воздействие чистой воды, бактерий или грибов вызывало достоверно различные уровни аллогруминга (рис. 4C), но не самоочищения (рис. 4D). Была измерена также эффективность аллогруминга в удалении микробов с кутикулы муравьёв. Нагрузка на муравьёв после аллогруминга значительно снизилась, но в большей степени для грибов (рис. 4E; снижение на 62% после аллогруминга), чем для бактерий (рис. 4F; снижение на 41% после аллогруминга). В целом, эти результаты показывают, что воздействие бактерий не усиливает аллогруминг и что базовый уровень аллогруминга (одинаковый у муравьёв, подвергшихся воздействию бактерий и контрольной группы) менее эффективен в снижении микробной нагрузки, чем индуцированный уровень аллогруминга, вызванный воздействием грибов.
Гипотеза о том, что социальный иммунитет эффективен против грибковых, но не бактериальных инфекций, подразумевает, что социальная жизнь должна давать преимущество в выживании муравьям, заражённым грибками, но не бактериями. Авторы проверили это, сравнив выживаемость муравьёв, содержавшихся группами или в изоляции, после воздействия спор M. brunneum или после получения травм и воздействия P. entomophila. Как и предполагалось, муравьи, содержащиеся группами, выживали значительно лучше при воздействии грибков, но не при бактериальных инфекциях (рис. 4G, H; медиана выживаемости в группе по сравнению с изоляцией, M. brunneum: 102 часа против 86 часов; P. entomophila: 26 часов против 27 часов). Повторив эксперимент с другим живым грибом, B. bassiana, и другой бактерией, Ecc15, обнаружили аналогичные результаты: муравьи, содержавшиеся в группах, лучше выживали при заражении B. bassiana (медиана выживаемости в группе по сравнению с изоляцией: 132 ч по сравнению с 113 ч), но не при заражении Ecc15.
Таким образом, эти результаты подтверждают гипотезу о том, что индивидуальный и социальный иммунитет дополняют друг друга в борьбе с разными классами патогенов. Индивидуальный иммунитет эффективен против бактериальных инфекций, в то время как социальный иммунитет неэффективен против последних, но обеспечивает защиту от грибковых инфекций.
Список литературы
- Stockmaier S, Stroeymeyt N, Shattuck EC, Hawley DM, Meyers LA, Bolnick DI. Infectious diseases and social distancing in nature. Science. 2021 Mar 5;371(6533):eabc8881. doi: 10.1126/science.abc8881.
- Stroeymeyt N, Grasse AV, Crespi A, Mersch DP, Cremer S, Keller L. Social network plasticity decreases disease transmission in a eusocial insect. Science. 2018 Nov 23; 362(6417):941-945. doi: 10.1126/science.aat4793.
- Philip T. Starks, Caroline A. Blackie, Thomas D. Seeley. Fever in honeybee colonies. Naturwissenschaften, 2000, 87:229–231.
- Buchon, N., Silverman, N. & Cherry, S. Immunity in Drosophila melanogaster - from microbial recognition to whole-organism physiology. Nat. Rev. Immunol. 2014, 14, 796–810.
Новость подготовил
Богуславский Дмитрий Викторович, старший научный сотрудник лаборатории нейробиологии развития ИБР РАН, кандидат биологических наук.
25.02.2025