Накопление короткой некодирующей РНК в стареющем мозге - причина когнитивных нарушений?
По материалам статьи Widespread Accumulation of Ribosome-Associated Isolated 3′ UTRs in Neuronal Cell Populations of the Aging Brain. Peter H. Sudmant, Hyeseung Lee, Daniel Dominguez, Myriam Heiman, Christopher B. Burge. Cell Reports, Volume 25, Issue 9, P2447-2456.E4, November 27, 2018.
https://doi.org/10.1016/j.celrep.2018.10.094
 © Богуславский Дмитрий Викторович, старший научный сотрудник лаборатории нейробиологии развития ИБР РАН, кандидат биологических наук. Область научных интересов: молекулярная нейробиология, этология, апиология, социобиология.
© Богуславский Дмитрий Викторович, старший научный сотрудник лаборатории нейробиологии развития ИБР РАН, кандидат биологических наук. Область научных интересов: молекулярная нейробиология, этология, апиология, социобиология.
Старение характеризуется нарушением молекулярных функций и прогрессивным накоплением клеточных повреждений (Lopez-Otın et al., 2013). В человеческом мозге эти процессы в сочетании с генетическими и экологическими факторами могут приводить к нейродегенеративным нарушениям и общему снижению памяти и когнитивных способностей. Нейродегенеративные нарушения, как правило, влияют на определенные популяции клеток и области мозга - явление, известное как избирательная уязвимость нейронов (Mattson, Magnus, 2006). Причины, по которым отдельные клетки и области мозга проявляют повышенную восприимчивость к возрастным стрессам, и лежащие в их основе молекулярные механизмы, пока не совсем ясны.
Исследователи из Массачусетского технологического института обнаружили, что с возрастом в отдельных нейронах мозга происходит накопление коротких фрагментов РНК, которые образуются при окислительном стрессе, что приводит к необратимым изменениям в мозге.
Авторы статьи обнаружили, что тип повреждений, известный как окислительный стресс, создает необычные нагромождения коротких фрагментов РНК в отдельных нейронах. Эти накопления РНК коррелируют с уменьшением синтеза белка. Исследователи наблюдали такое явление как у мышей, так и у человека особенно в части мозга, называемой стриатумом – участком, вовлеченным в такие заболевания, как болезнь Паркинсона и Хантингтона.
Исследователи использовали технику, разработанную Myriam Heiman, которая позволила им изолировать и секвенировать мРНК из определенных типов клеток. Она включает в себя мечение рибосом зеленым флуоресцентным белком (GFP) так, что, когда образец ткани анализируется, исследователи могут использовать флуоресцентную метку для выделения и секвенирования РНК только из этих клеток. Это позволило им определить, какие белки производятся различными типами клеток.
У молодых мышей (шесть недель) и старых двухлетних мышей (эквивалентно людям в возрасте 70-80 лет) исследователи помечали рибосомы от дофаминергических D1 и D2 проекционных нейронов, которые составляют около 95 процентов нервных клеток стриатума. У людей эти два типа нейронов связаны с несколькими нейродегенеративными старческими заболеваниями.
К удивлению исследователей у нейронов D1 от старых мышей (но не у нейронов от молодых мышей или D2 нейронов от старых мышей) они обнаружили сотни генов, которые экспрессировали только короткий фрагмент исходной последовательности мРНК. Эти фрагменты, известные как 3' нетранслируемые области (UTR), были прикреплены к рибосомам, что не позволяло рибосомам синтезировать нормальные белки. 3' UTR-фрагменты происходят из примерно 400 генов с широким спектром функций. Между тем, многие другие гены транслировались нормально.
Эти результаты побудили авторов статьи изучить возможную роль окислительного стресса в накоплении 3' UTR. Нейроны расходуют много энергии, что приводит к появлению большого числа свободных радикалов.
Было найдено, что активация ответа на окислительный стресс была выше у нейронов D1 по сравнению с нейронами D2, что свидетельствует о том, что они действительно подвергаются большему окислительному повреждению. Исследователи предлагают модель синтеза отдельных 3' UTR с участием фермента ABCE1, который обычно отделяет рибосомы от мРНК после завершения трансляции. Этот фермент содержит железо-серные кластеры, которые могут быть повреждены свободными радикалами, что делает его менее эффективным при удалении рибосом, которые затем застревают на мРНК. Это приводит к расщеплению мРНК ферментами, работающими перед застрявшими рибосомами (см. рис.).
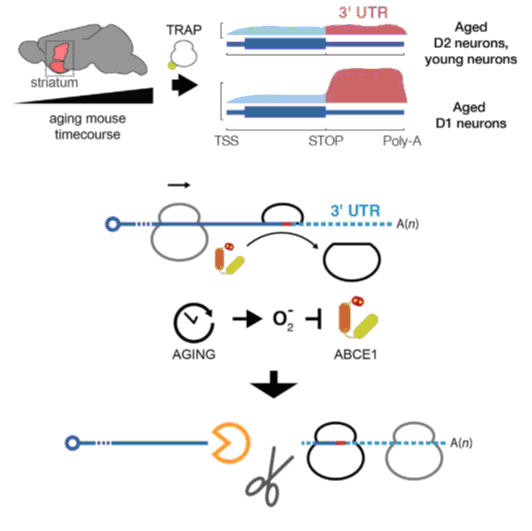
В человеческой мозговой ткани было найдено постепенное увеличение количества 3' UTR с возрастом, что соответствует предложенной модели постепенного повреждения окислительным стрессом. Подобное накопление фрагментов мРНК было обнаружено во многих отделах человеческого мозга, включая метаболически активную лобную часть новой коры. Напротив, в большинстве других типов человеческих тканей, за исключением ткани печени, которая подвергается воздействию большого количества потенциально токсичных молекул, накопления фрагментов мРНК с возрастом не происходило.
Авторы предполагают, что этот вид клеточного повреждения может сочетаться с генетическими и экологическими факторами, вызывая общее снижение когнитивных способностей или даже нейродегенеративные состояния, такие как болезнь Паркинсона.
Новость подготовил © 2019 Богуславский Д.В.
25.01.2019