Dahl, J. A. et al. Broad histone H3K4me3 domains in mouse oocytes modulate maternal-to-zygotic transition. nature19360 (2016). Nature, 537, 548–552 (22 September 2016) doi:10.1038/nature19360
Zhang, B. et al. Allelic reprogramming of the histone modification H3K4me3 in early mammalian development. nature19361 (2016). Nature 537, 553–557 (22 September 2016) doi:10.1038/nature19361
Liu, X. et al. Distinct features of H3K4me3 and H3K27me3 chromatin domains in pre-implantation embryos. nature19362 (2016). Nature 537, 558–562 (22 September 2016) oi:10.1038/nature19362
 © Минин Андрей Александрович
кбн, заведующий лабораторией экспериментальной эмбриологии.
Область научных интересов: молекулярная биология раннего развития.
© Минин Андрей Александрович
кбн, заведующий лабораторией экспериментальной эмбриологии.
Область научных интересов: молекулярная биология раннего развития.
Появившаяся в журнале Nature статья представляет несомненный интерес для всех, занимающихся проблемами биологии развития, генетики и эволюции. Это связано с важным концептуальным характером огромной по охвату экспериментальных объектов работы, проделанной в лаборатории Итаи Янаи в Израильском Институте Технологии (Itai Yanai, The Technion-Israel Institute of Technology, Department of Biology).Чтобы оценить значение рассматриваемой работы, кажется полезным обратиться к истории проблемы.
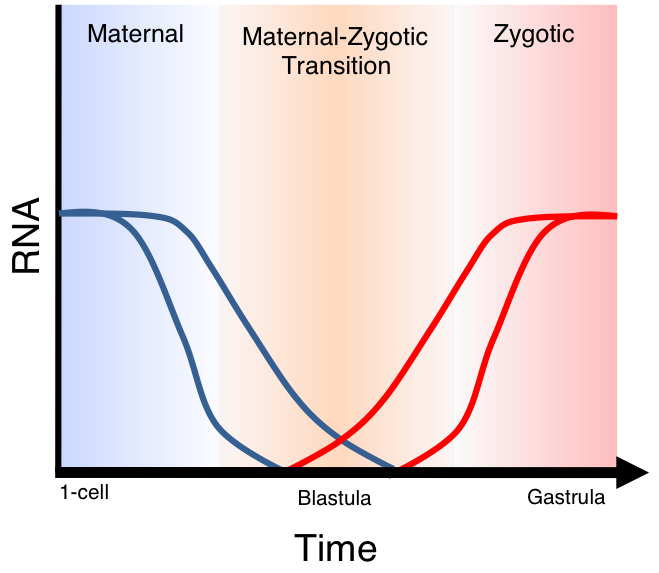
Переход от работы материнских факторов развития к активации генома зародыша в эмбриогенезе имеет долгую и драматическую историю изучения. Этот процесс называют активацией генома зиготы (zygotic genome activation, ZGA), переходом на средней бластуле (MBT), maternal zygota transition (MZT), морфогенетической функцией ядер (по Нейфаху). Проблема по-прежнему остается открытой, далеко не все понятно в механизмах этого процесса. Истории его изучения и актуальным вопросам посвящены недавние обзоры (Д. В. Онищук, А. С. Воронина. Активация генома зародыша и регуляция плюрипотентности клеток. Успехи биологической химии, т. 55, 2015, с. 197–222; Korzh, V. (2009) Before maternal- zygotic transition . There was morphogenetic function of nuclei, Zebrafish, 6, 295–302. 18. Корж В. П., Минин А. А. (2010) Краткая история вьюна, или зачем помнить о морфогенетической функции ядер, Онтогенез, 41, 150–158). В 2016 году сделан следующий шаг в изучении этого важнейшего направления биологии развития. Как это часто бывает, новые данные были получены благодаря прогрессу методических подходов в исследовании работы генома.
|
Укладка ДНК в пространственную структуру является результатом взаимодействия нуклеотидов и гистонов, которое в свою очередь зависит от их модификации. Участки ДНК, в которых она связана с гистонами, давно уже научились секвенировать. Для этого используется метод иммунопреципитации обломков ДНК антителами к разным модификациям гистонов с последующим разрушением нуклеазами несвязанной с антителами ДНК. Достигнуты впечатляющие успехи в изучении упаковки регуляторных областей генома и промоторов генов, влияющей на ингибирование и активацию транскрипции. Именно этот глобальный уровень регуляции работы генома путем его упаковки определяет дифференцировочные потенции клетки и, в конечном счете, ее судьбу.
Задача исследования процессов модификации гистонов и ДНК и их взаимодействия в яйце выглядела очевидной. Несколько лет назад были получены первые данные на дрозофиле и ксенопусе, у них зиготическая активация близка по времени со средней бластулой и происходит в зародыше, содержащем сотни ядер. Однако самые современные методы секвенирования не обладают необходимой чувствительностью для анализа изменений в укладке ДНК зародыша млекопитающих в процессе перехода к зиготической транскрипции. Напомним, что у этой группы животных переход начинается уже на стадии двух бластомеров, когда геном представлен всего двумя копиями на зародыш. И вот недавно был разработан новый метод анализа геномной ДНК (DNA-μChIP-seq), микромодификация метода секвенирования, сопряженного с иммунопреципитацией.
Иммунопреципитация геномной ДНК из необходимого количества ранних зародышей мыши позволяет набрать достаточное для секвенирования количество материала, это и было проделано во всех трех комментируемых работах. Основное внимание в этих работах было уделено анализу ДНК в участках связывания триметилированного по лизину 3 и лизину 27 гистона Н3 (H3K4me3 и H3K27me3). Об этих формах модификации гистона Н3 давно уже известно, что их взаимодействие с ДНК генома определяет разнонаправленную регуляцию транскрипции находящихся в этих участках генов. И вот теперь показано, что около 22% участков генома ооцита ассоциировано сH3K4me3-связывающими доменами и коррелирует с присутствием в них деметилированной ДНК. Эти участки соответствуют регионам начала трансляции в двухклеточных эмбрионах и областям зиготической активации генома. Активное разрушение структуры H3K4me3-связывающих доменов осуществляется путем деметилирования гистона лизин-деметилазами KDM5A and KDM5B, активность которых необходима для нормальной активации генома зиготы и раннего развития (Dahl, J. A. et al. 2016). Эти результаты открывают широкое поле деятельности для изучения природы генов, участвующих в процессах раннего развития, 22% - это тысячи генов. Быстрые изменения доменов генома, связывающих H3K4me3, наблюдается как при переходе к зиготической транскрипции, так и при формировании стволовых клеток во внутренней клеточной массе и трофобласте бластоцисты (Liu, X.et al. 2016).
В 2016 году открыта еще одна важная особенность изменений гистон-связывающих доменов в раннем развитии мыши. Обнаружено, что отцовский геном, попадая в яйцо, претерпевает особые изменения, определяемые материнскими факторами. Тем самым, процесс перепрограммирования генома зиготы оказывается тесно связан с процессом оплодотворения. В отцовской части генома важную роль играет неканонический паттерн метилированного гистона Н3 (ncH3K4me3), который ассоциирован, в отличие от материнского канонического, не с CpG-богатыми регионами промоторов, а почти исключительно с частично метилированными доменами ДНК. Удаление неканонических ncH3K4me3 требует зиготической транскрипции, но не зависит от пассивного разведения модификации ДНК в результате репликации (Zhang et al., 2016). Повторим, все эти процессы у мыши начинаются практически сразу после оплодотворения, на стадии двух бластомеров.
Быстрое перепрограммирование генома млекопитающих на ранних стадиях развития с участием эпигенетических факторов, обнаруженное в комментируемых работах, открывает новые горизонты для изучения как раннего эмбриогенеза, так и формирования мульти- и плюрипотентности у клеток зародыша. Особый интерес вызывает сравнение процесса активации зиготической транскрипции у разных групп животных, ведь у низших позвоночных ZGA, чаще именуемая у них МВТ, наступает в развитии гораздо позже, а не как у млекопитающих, практически одновременно с перепрограммированием отцовского генома, связанным с оплодотворением.
Тот факт, что все три статьи вышли в авторитетном журнале одновременно, указывает на важность поднятой проблемы, ну и, конечно, на высокий уровень конкуренции в актуальной области изучения проблем индивидуального развития.
Новость подготовил © 2016 Минин А.A.
24.10.2016