

© Ким Адамейко, младший научный сотрудник лаборатории биохимии процессов онтогенеза. Научные интересы: биоинформатика, транскриптомика, хроматин, беспозвоночные.
Junior research scientist Laboratory of Biochemistry. Interests: bioinformatics, transcriptomics, chromatin, invertebrates.
© Александр Финошин, аспирант лаборатории биохимии процессов онтогенеза. Область научных интересов: клеточная пластичность, протеомика, гомеостаз клеточного протеома, регенерация, металлопротеины.
Губки, предположительно древнейшие многоклеточные, обладают уникальной способностью к полной регенерации тела из отдельных механически разделённых клеток [1]. Ферритины представляют собой консервативное семейство железо-связывающих белков, представленное у всех видов живых организмов. У животных они играют важную роль в устойчивости к окислительно-восстановительному стрессу, иммунном ответе и дифференцировке клеток. Каким образом организованы гены ферритинов у базальных эволюционно древних групп животных и какую роль они играют в процессах развития этих организмов, оставалось до недавнего времени неизвестным. В статье, написанной междисциплинарным коллективом авторов из ИБР и других институтов РАН, Сколтеха, МГУ и КФУ, с помощью методов протеомики, спектральной микроскопии и биоинформатики была изучена роль ферритинов в процессе реагрегации морских губок Halisarca dujardinii (H.d.) и Halichondria panicea (H.p.).
В геноме губки H.d. были обнаружены три варианта гена ферритина, два из которых (HdF1a и HdF1b) консервативны и являются результатом недавней дупликации, а третий, HdF2, имеет заметные отличия не только от первых двух, но и от большинства ферритинов эукариот. В транскриптоме губки H.p. были найдены несколько близких консервативных транскриптов, условно объединенных под именем HpF1 (секвенирование генома этого вида, которое позволит установить точное число копий гена, в планах лаборатории). Нативный электрофорез в сочетании со специфическим окрашиванием и масс-спектрометрией подтвердил присутствие ионов железа и ферритинов в комплексах губки (у эукариот они состоят, как правило, из 24 субъединиц), а 3D-моделирование предсказало способность консервативных белков HdF1 и HpF1, но не атипичного HdF2 связывать ионы железа.
Низкое сходство с «классическими» ферритинами эукариот имеют многие секретируемые с помощью сигнального пептида ферритины насекомых, но и вне этой клады у многих видов беспозвоночных, в том числе у пресноводной губки Ephydatia muelleri, были найдены подобные атипичные ферритины. Для них характерны многочисленные аминокислотные замены в железо-связывающих доменах белка и отсутствие регуляторного железо-зависимого мотива-шпильки (IRE, iron-responsive element) в мРНК. Вероятно, эти атипичные ферритины имеют сниженную способность к связыванию и/или хранению железа, и их включение в ферритиновые комплексы позволяет более тонко настраивать метаболизм железа в клетке в ответ на стресс.
В ходе исследования проведен анализ первичной структуры регуляторных участков генов ферритинов губки H.d., которые определяют дифференциальную экспрессию этих генов в развитии. Анализ регуляторных 5’-областей генов ферритина H.d. выявил не только особенности атипичного варианта HdF2, но и отличия близких копий HdF1a и HdF1b между собой (рис. 1). Интересно, что обе копии имеют CpG-острова на расстоянии около 500 п.о. выше старта транскрипции, но если HdF1b в этом острове содержит мотив связывания GC box широкого класса транскрипционных факторов с цинковыми пальцами, то HdF1a – мотив HRE+HAS (hypoxia response element, hypoxia ancillary sequence) более специализированного фактора HIF, участвующего в ответе на гипоксию. HdF2 также содержит данный мотив, но не в CpG-острове. В промоторных областях ферритинов H.d. присутствуют и другие мотивы, такие как металло- и антиоксидантно-зависимый элементы MRE (metal-responsive element) и ARE (antioxidant response element).
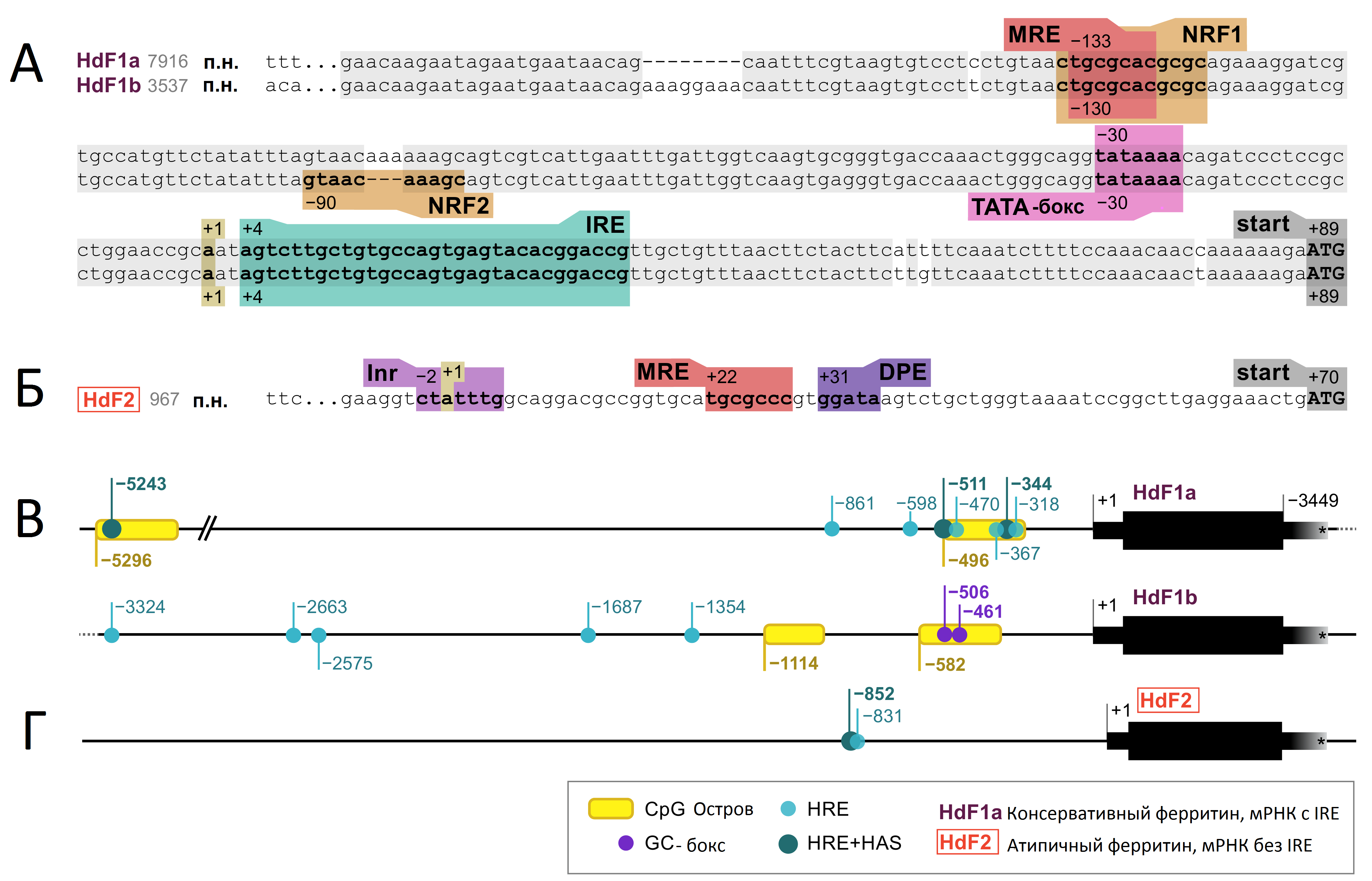
Рис 1. Регуляторные области генов ферритина губки Halisarca dujardinii HdF1a/b (A, В) и HdF2 (Б, Г)
В предыдущих работах авторы показали, что многие гены губки H.d., участвующие в синтезе гема, метаболизме железа и ответе на гипоксию, значимо меняют уровни экспрессии в процессе формирования клеточных агрегатов (измерения производились сразу и спустя сутки после диссоциации тканей губки) [2]. В новой работе набор транскриптомных данных был расширен образцами, собранными в разные периоды годового жизненного цикла губки: зима (начало сперматогенеза и оогенеза), лето (начало роста тканей) и осень (конец роста тканей). Оказалось, что консервативный ферритин HdF1a/b входит в топ-10 наиболее экспрессирующихся генов наряду с такими генами, как актин и тубулин, в то время как атипичный HdF2 имеет уровень экспрессии на три порядка ниже. Эти ферритины различаются и профилями дифференциальной экспрессии при реагрегации. Так, суммарная экспрессия HdF1a/b (на уровне транскриптома невозможно разделить экспрессию столь близких копий) значительно снижается в диссоциированных клетках губок, собранных зимой и осенью, и частично восстанавливается при реагрегации; в летних же образцах она существенно не меняется после диссоциации, но значимо снижается при реагрегации (рис. 2А). Интересно, что атипичный ферритин HdF2 увеличивал экспрессию в образцах всех сезонов (рис. 2Б). График, демонстрирующий экспрессионные отличия транскриптомных образцов с помощью метода главных компонент (рис. 2В), также показывает схожесть процессов реагрегации у осенних и зимних образцов и обособленность этого процесса у летних.
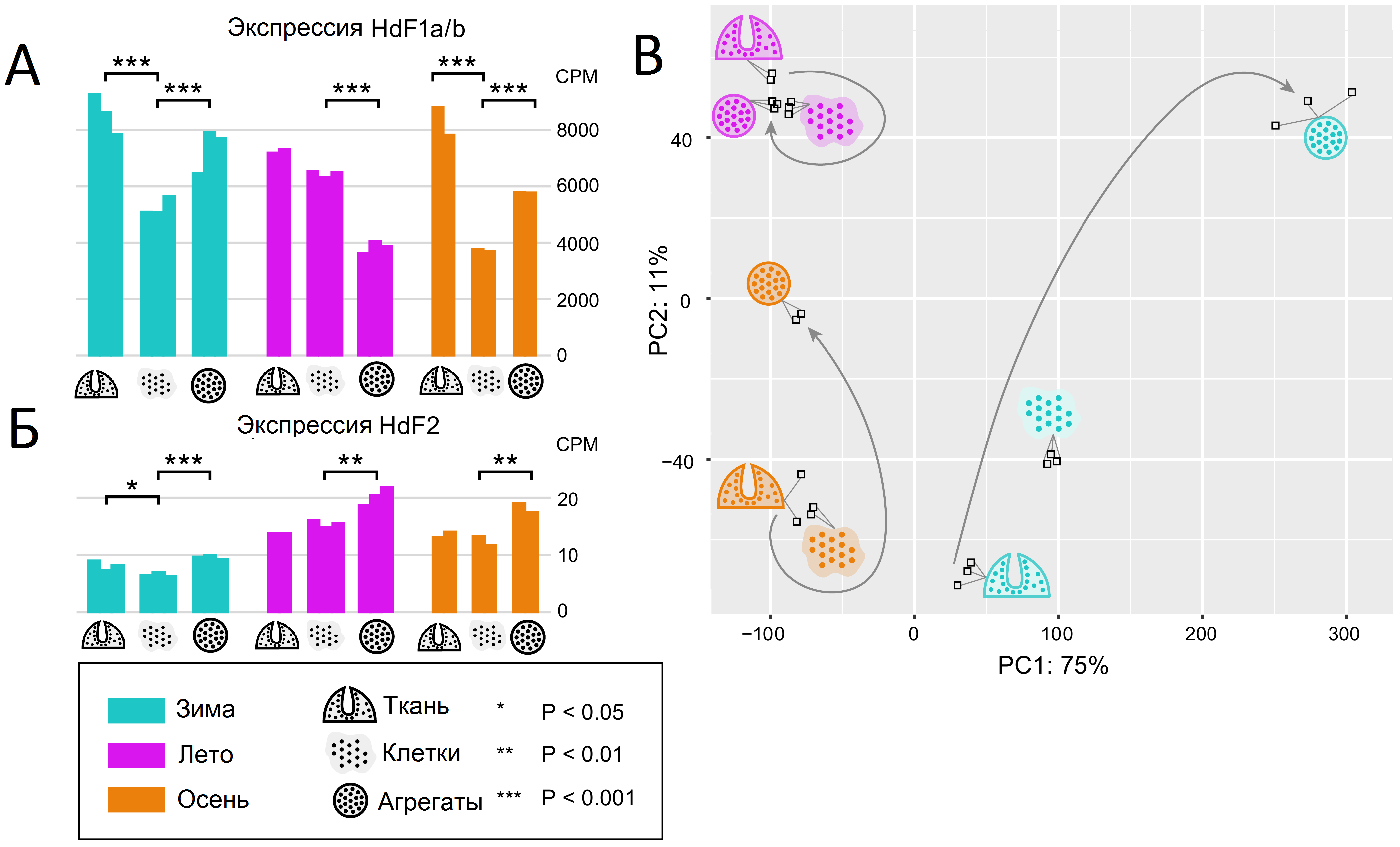
Рис. 2. Экспрессия ферритинов губки Halisarca dujardinii (А, Б) и график главных компонент (В) транскриптомных образцов, собранных в разные сезоны и на разных стадиях эксперимента по реагрегации
Таким образом, различающиеся экспрессионные профили ферритинов могут быть обусловлены не только различиями в регуляторных областях, но стадиями развития, сменяющимися в течение годового жизненного цикла губок Белого моря – региона с ярко выраженной сезонностью. Жизнь в приливной зоне связана с резкими изменениями температуры и содержания кислорода в воде, а эксперимент с реагрегацией моделирует ответ на стресс и механические повреждения тела. В данной работе показан важный вклад ферритинов – белков, непосредственно участвующих в метаболизме железа, и, как следствие, кислорода – в обеспечение морфогенетической пластичности губок.
[1] Borisenko, I.; Bolshakov, F.V.; Ereskovsky, A.; Lavrov, A.I. Expression of Wnt and TGF-Beta Pathway Components during Whole-Body Regeneration from Cell Aggregates in Demosponge Halisarca dujardinii. Genes 2021, 12, 944. https://doi.org/10.3390/genes12060944
[2] Finoshin AD, Adameyko KI, Mikhailov KV, Kravchuk OI, Georgiev AA, et al. (2020) Iron metabolic pathways in the processes of sponge plasticity. PLOS ONE 15(2): e0228722. https://doi.org/10.1371/journal.pone.0228722 Также см. заметку в разделе «Новости биологии развития» - «Метаболизм железа регулирует морфогенез морских губок»
Новость подготовили ©Ким Адамейко, Александр Финошин
24.09.2021