Область научных интересов: нейроэтология, нейробиология, нейротрансмиттеры, поведение.
Изменения окружающей среды могут вынуждать животных мигрировать, предполагая более интенсивную локомоцию или физическую нагрузку, чем в обычных условиях. Известно, что физические нагрузки активируют функции мозга. Бег улучшает память, усиливает нейрогенез, облегчает принятие решений, снижает тревожность и депрессию, уменьшая неблагоприятное влияние стресса. Эти изменения могут играть важную роль в адаптации нервной системы к изменяющейся окружающей среде и условиям жизни. У позвоночных эти эффекты двигательной активности опосредованы несколькими нейромодуляторными и нейротрофическими системами мозга [Heijnen et al., 2015]. Относительно недавно у грызунов были выявлены изменения в экспрессии генов и состоянии открытого хроматина во фронтальной коре и гиппокампе под влиянием двигательной активности, которые сохранялись даже у потомков двух последующих поколений тренированных животных [Yang et al., 2021; Mezheritskiy, Dyakonova 2022].
Исследования на различных первичноротых (беспозвоночных) животных свидетельствуют о том, что эти эффекты видоспецифичной интенсивной локомоции могли сформироваться уже на ранних этапах эволюции животных [Dyakonova et al., 2022]. Например, у нематоды C. elegans двигательная активность (плавание) способствует обучению и запоминанию, а также оказывает защитное действие от нейродегенеративных заболеваний. У насекомых интенсивная локомоция повышает выносливость, улучшает сон и пищевое поведение, ориентацию, повышает агрессивность и устойчивость к некоторым раздражителям. Многие из этих эффектов ранее были описаны у млекопитающих как благоприятные последствия бега, что указывает на определенное сходство между отдаленно родственными видами. Результаты, полученные на первичноротых организмах, открыли новые перспективы для выяснения молекулярных механизмов, лежащих в основе влияния физических упражнений на функции мозга и адаптацию к новым условиям. Ведь, многие беспозвоночные являются превосходными экспериментальными моделями.
У пресноводной улитки Lymnaea stagnalis интенсивное мышечное ползание в условиях низкой воды сопровождается формированием памяти, что облегчает последующее поведение в новой, совершенно сухой среде [Dyakonova et al., 2019]. Улитки после однократной физической нагрузки быстрее принимают решения и демонстрируют более высокую скорость передвижения в новой среде [Korshunova et al., 2016]. Эти поведенческие изменения коррелировали с возбуждением серотониновых нейронов после физической нагрузки, за которым следовало дофамин-зависимое снижение активности серотониновой системы у отдохнувших после физической нагрузки животных [Dyakonova et al., 2019]. Сравнение поведения, нейрональной активности и метаболизма серотонина у тренированных, контрольных и отдохнувших животных позволило предположить, что отдых после физической нагрузки — это особое состояние нервной системы [Aonuma et al., 2020]. Оно отличалось от состояния контрольных, нетренированных животных и имело ещё более выраженные отличия от животных, взятыми сразу после физической нагрузки.
Транскрипционные изменения, происходящие при физической нагрузке и отдыхе, а также сопутствующие формированию памяти о физической нагрузке в нервной системе, были неизвестны. Мы предположили, что интенсивная локомоция и отдых вызывают разные изменения транскрипции в ЦНС и провели профилирование и аннотацию экспрессии генов центральных ганглиев улитки при трех поведенческих состояниях: (1) в контроле (обычные аквариумные условия плюс хандлинг); (2) интенсивная локомоция на мелководье в течение двух часов; (3) два часа отдыха в глубокой воде после периода двухчасовой нагрузки. Нам хотелось ответить на три вопроса. Какие гены и функциональные генные сети реагируют на физическую нагрузку и отдых в центральной нервной системе? Насколько различаются изменения, вызванные физической нагрузкой и отдыхом на уровне экспрессии генов? Существуют ли у улиток и млекопитающих общие (консервативные?) гены, реагирующие на физическую нагрузку?
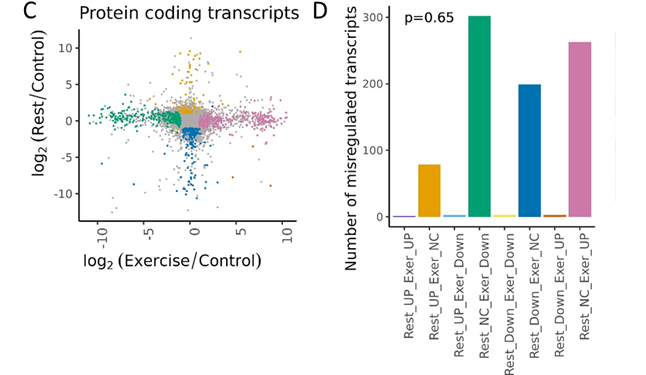
Мы обнаружили, что физическая активность и отдых после нее, действительно, вызывают изменения в экспрессии разных генов. Это хорошо видно на первом рисунке, иллюстрирующем изменения в количественном распределении транскриптов (по оси Х : 2 часа локомоции по сравнению с контролем, а по оси У: 2 часа отдыха после локомоции по сравнению с контролем). Видно, что оба состояния отличны от контроля, но большинство генов изменило свою экспрессию либо при нагрузке, либо при отдыхе (точки «прижимаются» к осям). Та же закономерность видна и на соседнем рисунке, который представляет количественное распределение в соответствии со знаком изменений экспрессии: повышения или понижения.
Рис. 1. Гены, дифференциально экспрессирующиеся у L. stagnalis в ответ на физическую нагрузку и отдых, представляют собой разные множества. Диаграмма рассеяния двоичного логарифма кратности изменений уровней экспрессии изоформ после отдыха и после упражнений относительно контрольных значений. Число транскриптов, кодирующих белки, в группах, которые сходно или разнонаправлено регулируются в состоянии покоя и при физической нагрузке с цветовым кодом для каждой группы.
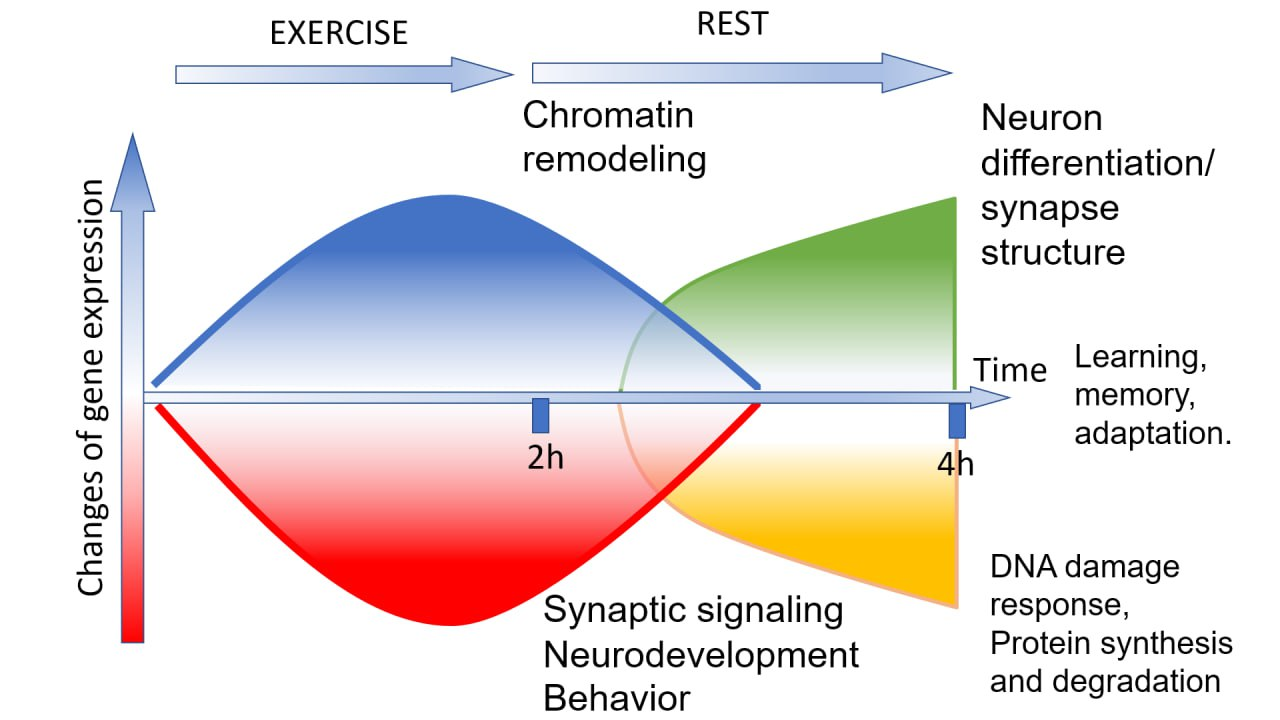
Функциональная аннотация генов показала, что два часа интенсивной локомоции индуцируют в основном гены, модифицирующие хроматин, везикулярный транспорт и клеточный цикл, в то время как гены, связанные с нейроразвитием, поведением, синаптической активностью и гормональным ответом, напротив, преимущественно репрессируются. Эти изменения полностью нормализовались через два часа последующего отдыха. В свою очередь, отдых индуцировал экспрессию генов, функционирующих в нейрональной дифференцировке и структуре/активности синапсов, в то время как гены, отвечающие за митотические процессы, трансляцию и деградацию белков, репрессировались.
Рис. 2 Схематическое изображение основных функциональных изменений в нервной системе улитки под влиянием нагрузки и отдыха, предложенное на основании данных сравнительного анализа транскриптомов ЦНС и предыдущих поведенческих исследований.
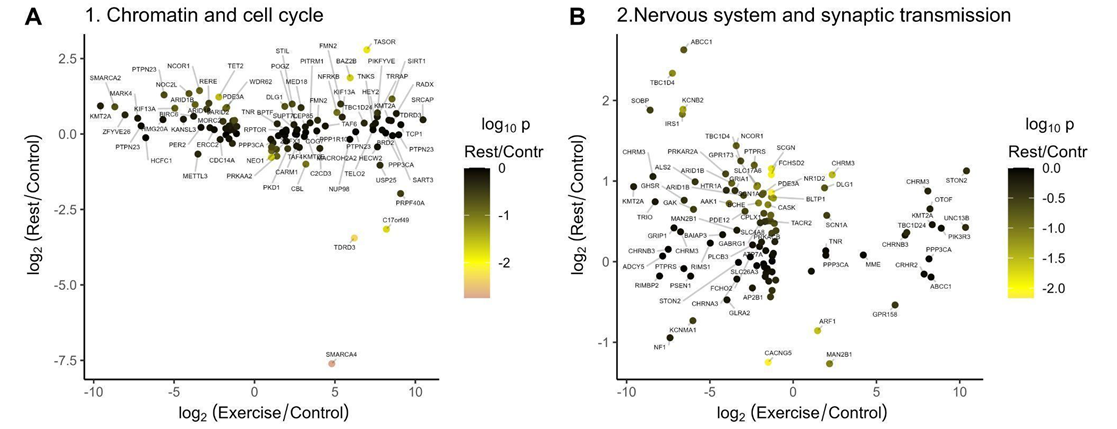
Интенсивная локомоция регулирует множество транскрипционных коактиваторов и репрессоров у L. stagnalis, в то время как отдых индуцирует другой набор транскрипционных модуляторов, которые, вероятно, опосредуют переключение между двумя различными наборами генов, затрагиваемыми физическими упражнениями и отдыхом. Примечательно, что дефицит этих транскрипционных регуляторов связан с дефектами нейроразвития у мышей и людей, включая TDRD3 [Zhu et al., 2023]; SmarcA4 [Zhang et al., 2016]; Kmt2a/Mll1 [Jakovcevski et al., 2016], TRRAP [Cogné et al., 2019], фактор транскрипции AUTS2 [Biel et al., 2022] и многие другие, что позволяет предположить, что эти ТФ играют важную роль в нейрональных функциях у далеких в эволюционном отношении видов.
Рис. 3. Гены из кластеров аннотаций, регуляция которых меняется после физической нагрузки или отдыха. Большинство транскриптов, подавляемых или индуцируемых при физической нагрузке, нормализуются у животных в состоянии покоя. Цвета соответствуют логарифмическим значениям (p-значениям) изменений экспрессии генов у животных в состоянии покоя по сравнению с контрольными.
В прошлом году были опубликованы данные транскриптомного анализа изменений содержания мРНК в нейронах гиппокампа у мышей после четырех недель произвольных упражнений (бег в колесе) (Methi et al., 2024).
Мы оценили, отличается ли перекрытие множеств генов, регулируемых у улиток и в гиппокампе мышей физической нагрузкой, от случайного. У улиток обнаружено 9806 генов, гомологичных генам мышей, и их можно сопоставить с геном ETEREZID у мышей. В гиппокампе мышей обнаружено 328 индуцируемых и 811 репрессируемых физическими упражнениями генов. Из 314 транскриптов, репрессированных физической нагрузкой у улитки с уникальными мышиными аннотациями, 50 были подавлены и 25 активировались у мышей (26 и 11 ожидалось случайно, p = 4 x 10-10, критерий хи-квадрат Пирсона), тогда как из 252 транскриптов, индуцированных физической нагрузкой, 31 был подавлен, а 9 были индуцированы (21 и 8,5 ожидалось случайно, p = 0,06, критерий хи-квадрат Пирсона) в гиппокампе мышей.
Таким образом, перекрытие множеств генов, регулируемых у улиток и в гиппокампе мышей физической нагрузкой отличается от случайного, особенно это проявилось в отношении генов, чья активность была подавлена физической нагрузкой у улитки. В отношении группы генов, изменивших экспрессию после отдыха у улитки, более высокая достоверность неслучайного отличия от множества генов, регулируемых упражнениями в гиппокампе мышей, получена, наоборот, для генов, число транскриптов которых повысилось.
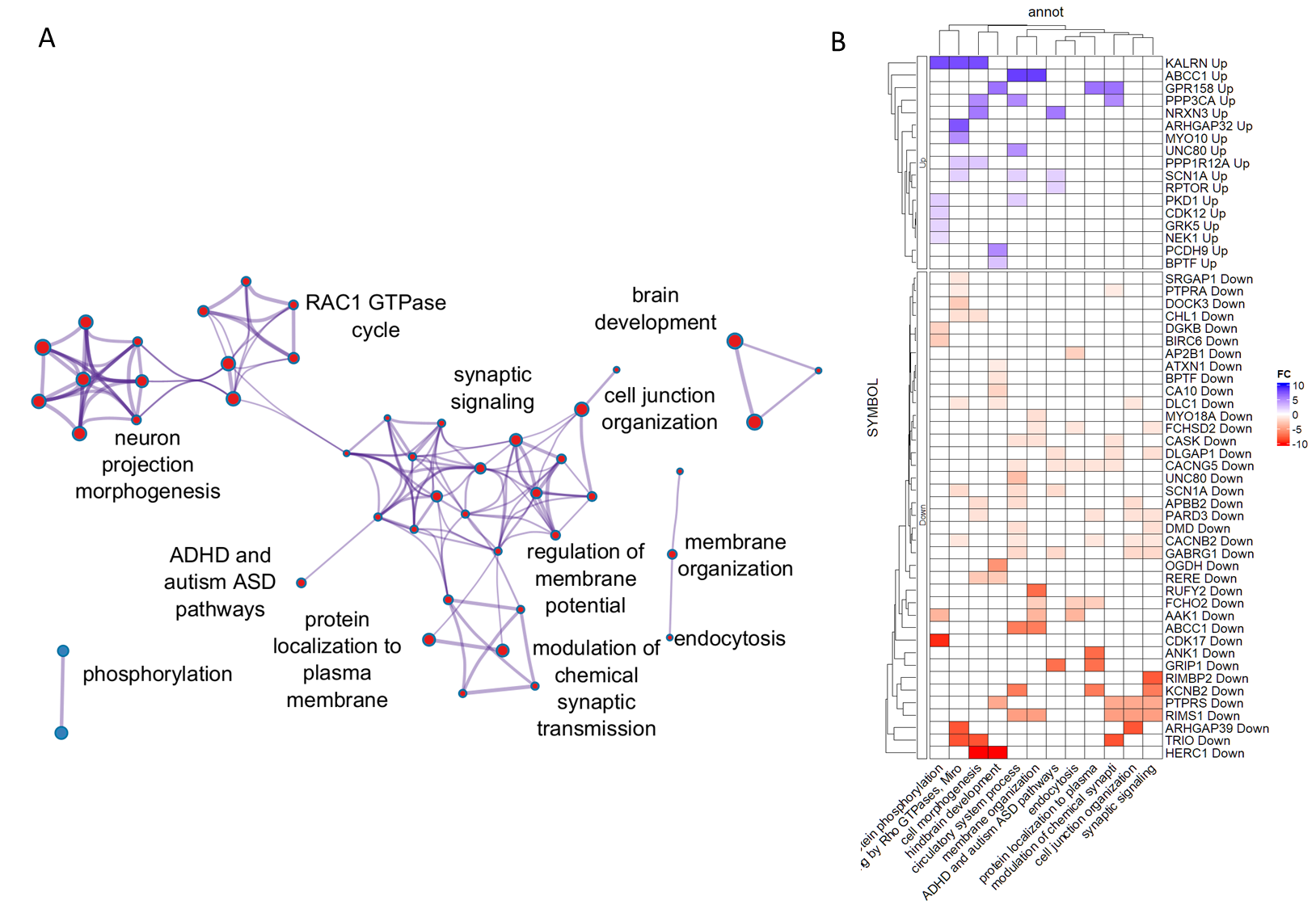
Анализ генов, регулируемых физической нагрузкой, с помощью Metascape выявил аннотации гомологичных генов человека, связанных с синаптической сигнализацией, химической синаптической передачей и заболеваниями аутистического спектра.
Рис. 4. Аннотация общих генов, регулируемых физической нагрузкой у улиток и мышей. A. Кластеризация аннотаций, представленных в избыточном количестве в списках генов с изменившимся числом транскриптов. B. Кластеризация генов и соответствующих аннотаций. Цвета соответствуют логарифмическому изменению (кратности изменения) у улитки после физической нагрузки.
Среди генов, экспрессия которых повышается при физической нагрузке как у улиток, так и у мышей, присутствуют ARRDC2 и Unc80. Белок ARRDC2 локализован в цитоплазматической и везикулярной мембранах и принадлежит к семейству белков аррестина, играющих важную роль в десенсибилизации и интернализации рецепторов, сопряжённых с G-белком (GPCR). У улиток его экспрессия остаётся слегка повышенной и после отдыха. Острая аэробная нагрузка также увеличивала экспрессию Arrdc2 и Arrdc3 в скелетных мышцах [Gordon et al., 2019], и было высказано предположение, что Arrdc2 участвует в атрофии, вызванной бездействием, особенно в стареющих мышцах [Laskin et al., 2024].
Unc80 кодирует белок, который является компонентом потенциал-независимого комплекса ионных каналов «утечки». Каналы утечки играют важную роль в установлении и поддержании мембранного потенциала покоя (МП) в нейронах у беспозвоночных и млекопитающих [Pierce-Shimomura et al., 2008]. По крайней мере, у улиток, изменения МП, действительно, были обнаружены в нейронах после нагрузки и в ЦНС и после их полной изоляции [Dyakonova et al., 2019]. Вероятно, что долгосрочные изменения, вызванные произвольными упражнениями, также связаны с регуляцией МП в некоторых нейронах гиппокампа у мышей. Однако до сих пор проблематично обнаружить изменения уровня МП в нейронах мозга млекопитающих. Примечательно, что Unc 80 широко распространен в нервной системе и у нематоды C. elegans, при этом черви с нокаутированным геном Unc80, способны ползать, но не способны переключаться на более интенсивную и быструю локомоцию, например, на плавание [Pierce-Shimomura et al., 2008]. Следовательно, Unc 80 участвует в нейрональном и нервно-мышечном обеспечении интенсивной локомоции у различных видов, что делает его наряду с Arrdc2 одним из наиболее вероятных кандидатов на роль эволюционно-консервативного генного ответа, индуцированного двигательной активностью. У человека мутации в Unc80 связаны с врожденной инфантильной энцефалопатией, умственной отсталостью и проблемами роста [Parra-Díaz et al., 2025].
Среди транскриптов, экспрессия которых в ЦНС улиток и гиппокампе мышей снижается под действием физической активности, можно назвать Inpp4a; Aak1; Arid1b; Smurf2; Bptf; Dgkb; Mllt10; Cacnb2.
Инозитолполифосфат-4-фосфатаза типа I A (Inpp4a) модулирует прогрессирование клеточного цикла и выживаемость клеток. В нейронах она участвует в регуляции транспорта везикул, реорганизации цитоскелета и экспрессии глутаматных рецепторов N-метил-D-аспартатного типа (NMDA-рецепторов) на поверхности клетки, защищая нейроны от эксайтотоксичности и гибели.
Aak1 относится к подсемейству серин/треониновых протеинкиназ SNF1 и также участвует в эндоцитозе рецепторов через клатриновую ось и миграции дочерних клеток нейробластов [Knop et al., 2024]. Снижение ее активности способствует уменьшению боли [Kostich et al., 2016], в то время как повышение содержания ее белкового продукта недавно было связано с депрессивным расстройством [Xu et al., 2025]. Эти данные согласуются с наблюдаемым снижением экспрессии AAK1 после физических упражнений и известными обезболивающими и антидепрессивными эффектами физических упражнений.
Продукт гена ARID1B также участвует в пролиферации и дифференцировке нейрональных предшественников путем ремоделирования хроматина и восстановления поврежденной ДНК. Вместе со SMARCA4 он входит в комплекс ремоделирования хроматина, специфичный для нейрональных прогениторных клеток (комплекс npBAF), и комплекс ремоделирования хроматина, специфичный для нейрональных прогениторных клеток (комплекс nBAF), который вызывает переключение со стволового/прогениторного на постмитотический механизм ремоделирования хроматина. ARID1B — один из наиболее часто мутирующих генов у лиц с интеллектуальной инвалидностью [van der Sluijs et al., 2024].
Mllt10 и Bptf являются транскрипционными факторами. Bptf (транскрипционный фактор с бромодоменом и PHD-доменом) также участвует в ремоделировании хроматина и является одним из ключевых регуляторов путей нейрогенеза в комплексе NURF, наряду с упомянутым выше SMARCA4, регуляция которого также меняется при физической нагрузке у улиток. Снижение экспрессии Smurf2 может свидетельствовать об активации высококонсервативного сигнального пути, а именно рецептора трансформирующего фактора роста бетта (TGFBR). TGFBR необходим для развития нервной системы и функционирования нервной системы на протяжении всей жизни и нарушается при нейродегенеративных заболеваниях
Снижение экспрессии транскриптов Dgkb (диацилглицеролкиназа бета) как у улиток, так и у мышей предполагает повышенную продукцию диацилглицерина/ДАГ и снижение продукции фосфатидной кислоты после физической нагрузки. Dgkb преобразует диацилглицерол/ДАГ в фосфатидную кислоту/фосфатидат/ПА и регулирует соответствующие уровни этих двух биоактивных липидов. Эти данные также указывает на изменения в GPCR и повышенную цитозольную сигнализацию Ca2+. Интересно, что у мышей с нокаутом Dgkb наблюдается ряд психомоторных изменений в поведении, таких как снижение тревожности и депрессии, а также гиперактивность [Kakefuda et al., 2010]. Эти изменения схожи с поведенческими последствиями физических упражнений у мышей и улиток. Поэтому можно предположить, что, по крайней мере частично, эти поведенческие эффекты могут быть опосредованы снижением количества транскриптов Dgkb после физических упражнений. Также было показано, что DGKβ регулирует образование шипиков в дендритах, играя важную роль в когнитивных процессах, включая память [Shirai et al., 2010].
Таким образом, мы идентифицировали гены, участвующие в транскрипционном ответе нервной системы L. stagnalis на интенсивную локомоцию и последующий отдых. Этот транскрипционный ответ предполагает, что отдых после тренировки функционально значим для положительного эффекта упражнений. Отдых активирует гены, связанные с нейрональным развитием, которые могут способствовать обучению, памяти и адаптации к окружающей среде. Мы также наблюдали сходство транскрипционного ответа на тренировку у грызунов и моллюсков на уровне крупных функциональных кластеров и отдельных генов. У человека гомологичные гены играют ключевую роль в нормальном развитии и сложных неврологических функциях, а их мутации связаны с нарушениями поведения, обучения и развития нервной системы.
- Aonuma, H.; Mezheritskiy, M.; Boldyshev, B.; Totani, Y.; Vorontsov, D.; Zakharov, I.; Ito, E.; Dyakonova, V. The Role of Serotonin in the Influence of Intense Locomotion on the Behavior Under Uncertainty in the Mollusk Lymnaea stagnalis. Front. Physiol. 2020, 11, 221, doi:10.3389/fphys.2020.00221.
- Biel, A.; Castanza, A.S.; Rutherford, R.; Fair, S.R.; Chifamba, L.; Wester, J.C.; Hester, M.E.; Hevner, R.F. AUTS2 syndrome: molecular mechanisms and model systems. Front. Mol. Neurosci. 2022, 15, 858582, doi:10.3389/fnmol.2022.858582.
- Cogné, B.; Ehresmann, S.; Beauregard-Lacroix, E.; Rousseau, J.; Besnard, T.; Garcia, T.; Petrovski, S.; Avni, S.; McWalter, K.; Blackburn, P.R.; Sanders, S.J.; Uguen, K.; Harris, J.; Cohen, J.S.; Blyth, M.; Lehman, A.; Berg, J.; Li, M.H.; Kini, U.; Joss, S.; Campeau, P.M. Missense variants in the histone acetyltransferase complex component gene TRRAP cause autism and syndromic intellectual disability. Am. J. Hum. Genet. 2019, 104, 530–541, doi:10.1016/j.ajhg.2019.01.010.
- Dyakonova, T.L.; Sultanakhmetov, G.S.; Mezheritskiy, M.I.; Sakharov, D.A.; Dyakonova, V.E. Storage and erasure of behavioural experiences at the single neuron level. Sci. Rep. 2019, 9, 14733, doi:10.1038/s41598-019-51331-5.
- Gordon, B.S.; Rossetti, M.L.; Eroshkin, A.M. Arrdc2 and Arrdc3 elicit divergent changes in gene expression in skeletal muscle following anabolic and catabolic stimuli. Physiol. Genomics 2019, 51, 208–217, doi:10.1152/physiolgenomics.00007.2019.
- Heijnen, S.; Hommel, B.; Kibele, A.; Colzato, L.S. Neuromodulation of Aerobic Exercise-A Review. Front. Psychol. 2015, 6, 1890, doi:10.3389/fpsyg.2015.01890.
- Jakovcevski, M.; Ruan, H.; Shen, E.Y.; Dincer, A.; Javidfar, B.; Ma, Q.; Peter, C.J.; Cheung, I.; Mitchell, A.C.; Jiang, Y.; Lin, C.L.; Pothula, V.; Stewart, A.F.; Ernst, P.; Yao, W.-D.; Akbarian, S. Neuronal Kmt2a/Mll1 histone methyltransferase is essential for prefrontal synaptic plasticity and working memory. J. Neurosci. 2015, 35, 5097–5108, doi:10.1523/JNEUROSCI.3004-14.2015.
- Kakefuda, K.; Oyagi, A.; Ishisaka, M.; Tsuruma, K.; Shimazawa, M.; Yokota, K.; Shirai, Y.; Horie, K.; Saito, N.; Takeda, J.; Hara, H. Diacylglycerol kinase β knockout mice exhibit lithium-sensitive behavioral abnormalities. PLoS ONE 2010, 5, e13447, doi:10.1371/journal.pone.0013447.
- Knop, F.; Zounarová, A.; Šabata, V.; Middelkoop, T.C.; Macůrková, M. Caenorhabditis elegans SEL-5/AAK1 regulates cell migration and cell outgrowth independently of its kinase activity. eLife 2024, 13, doi:10.7554/eLife.91054.
- Korshunova, T.A.; Vorontsov, D.D.; Dyakonova, V.E. Previous motor activity affects the transition from uncertainty to decision making in snails. J. Exp. Biol. 2016, 219, 3635–3641, doi:10.1242/jeb.146837.
- Kostich, W.; Hamman, B.D.; Li, Y.-W.; Naidu, S.; Dandapani, K.; Feng, J.; Easton, A.; Bourin, C.; Baker, K.; Allen, J.; Savelieva, K.; Louis, J.V.; Dokania, M.; Elavazhagan, S.; Vattikundala, P.; Sharma, V.; Das, M.L.; Shankar, G.; Kumar, A.; Holenarsipur, V.K.; Albright, C.F. Inhibition of AAK1 kinase as a novel therapeutic approach to treat neuropathic pain. J. Pharmacol. Exp. Ther. 2016, 358, 371–386, doi:10.1124/jpet.116.235333.
- Laskin, G.R.; Cabrera, A.R.; Greene, N.P.; Tomko, R.J.; Vied, C.; Gordon, B.S. The mechanosensitive gene arrestin domain containing 2 regulates myotube diameter with direct implications for disuse atrophy with aging. Am J Physiol, Cell Physiol 2024, 326, C768–C783, doi:10.1152/ajpcell.00444.2023.
- Methi, A.; Islam, M.R.; Kaurani, L.; Sakib, M.S.; Krüger, D.M.; Pena, T.; Burkhardt, S.; Liebetanz, D.; Fischer, A. A Single-Cell Transcriptomic Analysis of the Mouse Hippocampus After Voluntary Exercise. Mol. Neurobiol. 2024, 61, 5628–5645, doi:10.1007/s12035-023-03869-9.
- Mezheritskiy, M.I.; Dyakonova, V.E. Direct and inherited epigenetic changes in the nervous system caused by intensive locomotion: possible adaptive significance. Russ. J. Dev. Biol. 2022, 53, 295–308, doi:10.1134/S1062360422050058.
- Parra-Díaz, P.; Monteil, A.; Calame, D.; Hadouiri, N.; Soliani, L.; Spinelli, E.; Caron, E.J.; Dieterich, K.; Kritzer, A.; Riley, K.; Serratosa Fernández, J.M.; Tanner, J.A.; Tevissen, H.; Thauvin, C.; Vera-Medialdea, R.; Waltz, S.M.; Beltrán-Corbellini, Á.; García Morales, I.; Sánchez-Miranda Román, I.; Toledano, R.; Gil-Nagel, A. Genotype-Phenotype Landscape of NALCN and UNC80-Related Disorders. Neurology 2025, 104, e213429, doi:10.1212/WNL.0000000000213429.
- Pierce-Shimomura, J.T.; Chen, B.L.; Mun, J.J.; Ho, R.; Sarkis, R.; McIntire, S.L. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc Natl Acad Sci USA 2008, 105, 20982–20987, doi:10.1073/pnas.0810359105.
- Shirai, Y.; Kouzuki, T.; Kakefuda, K.; Moriguchi, S.; Oyagi, A.; Horie, K.; Morita, S.; Shimazawa, M.; Fukunaga, K.; Takeda, J.; Saito, N.; Hara, H. Essential role of neuron-enriched diacylglycerol kinase (DGK), DGKbeta in neurite spine formation, contributing to cognitive function. PLoS ONE 2010, 5, e11602, doi:10.1371/journal.pone.0011602.
- Xu, Y.; Zhang, R.; Du, X.; Huang, Y.; Gao, Y.; Wen, Y.; Qiao, D.; Sun, N.; Liu, Z. Identification of aberrant plasma vesicles containing AAK1 and CCDC18-AS1 in adolescents with major depressive disorder and preliminary exploration of treatment efficacy. Genomics 2025, 117, 110993, doi:10.1016/j.ygeno.2025.110993.
- van der Sluijs, P.J.; Gösgens, M.; Dingemans, A.J.M.; Striano, P.; Riva, A.; Mignot, C.; Faudet, A.; Vasileiou, G.; Walther, M.; Schrier Vergano, S.A.; Alders, M.; Alkuraya, F.S.; Alorainy, I.; Alsaif, H.S.; Anderlid, B.; Bache, I.; van Beek, I.; Blanluet, M.; van Bon, B.W.; Brunet, T.; Santen, G.W.E. ARID1B-related disorder in 87 adults: Natural history and self-sustainability. Genetics in Medicine Open 2024, 2, 101873, doi:10.1016/j.gimo.2024.101873.
- Zhang, Z.; Cao, M.; Chang, C.-W.; Wang, C.; Shi, X.; Zhan, X.; Birnbaum, S.G.; Bezprozvanny, I.; Huber, K.M.; Wu, J.I. Autism-Associated Chromatin Regulator Brg1/SmarcA4 Is Required for Synapse Development and Myocyte Enhancer Factor 2-Mediated Synapse Remodeling. Mol. Cell. Biol. 2016, 36, 70–83, doi:10.1128/MCB.00534-15.
- Zhu, X.; Joo, Y.; Bossi, S.; McDevitt, R.; Xie, A.; Wang, Y.; Xue, Y.; Su, S.; Lee, S.K.; Sah, N.; Zhang, S.; Ye, R.; Pinto, A.; Zhang, Y.; Araki, K.; Araki, M.; Morales, M.; Mattson, M.; van Praag, H.; Wang, W. Tdrd3-null mice show post-transcriptional and behavioral impairments associated with neurogenesis and synaptic plasticity. Res. Sq. 2023, doi:10.21203/rs.3.rs-2597043/v1.
Новость подготовила
© В.Е.Дьяконова
24.07.2025
Работа поддержана грантом РНФ 25-14-00147