 © Григорян Элеонора Норайровна, главный научный сотрудник лаборатории проблем регенерации. д.б.н.
© Григорян Элеонора Норайровна, главный научный сотрудник лаборатории проблем регенерации. д.б.н.
Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
Статья Eroglu et al., вышедшая в журнале Nature Cell Biology в мае 2022 г, представляет новые результаты, во многом проясняющие вопрос о регенерации сердечной мышцы у хвостатых амфибий. Если для многих органов амфибий, таких как хвост, конечности, спинной и головной мозг, глаз, кишечник и челюсти, вопрос клеточных источников их регенерации в общих чертах решен, то в отношении сердца сохраняется много неясного.
Давно обнаружена возможность дедифференцировки и пролиферации предсуществующих кардиомиоцитов, однако, в экспериментах эти процессы не обеспечивают регенерацию сердца. Это связано с неспособностью кардиомиоцитов завершить клеточный цикл и обеспечить прогресс пролиферации (Oberpriller, Oberpriller, 1974). В этих обстоятельствах понятным решением были многократные попытки стимулировать пролиферацию кардиомиоцитов, завершающиеся, однако, появлением полиплоидных и многоядерных клеток (Sadek, Olson, 2020).
В качестве альтернативного подхода стал поиск и исследование резидентных клеток-предшественников, локализованных у взрослых тритонов (как и у рыб) в эпикарде. У рыб клетки предшественники удавалось активировать благодаря выяснению, а затем и применению факторов паракринной сигнализации, ВКМ и модуляции воспалительной реакции. Однако, результаты попыток проследить за судьбой эпикард-ассоциированных клеток-предшественников с помощью генетического маркирования и трансплантаций не были однозначны и не показывали достоверно их участие в восстановлении сердечной мышцы. По мнению Eroglu et al. (2022), отрицательный ответ зачастую был связан с исходно низкой частотой конверсии клеток эпикарда, невысокой их пластичностью. Препятствием были также недостаточная точность (специфичность) их маркирования, как и маркирования границ переходных форм клеток. К этим сложностям следует добавить обязательный сопутствующий повреждению ответ со стороны фибробластов, периваскулярных и гладкомышечных клеток и адипоцитов.
Для взрослых тритонов вопросы регенерации сердца были еще дальше от разрешения, чем у рыб, не только в отношении клеток-источников, но и определения сигнальных факторов – активаторов регенеративного ответа. Для тритонов не существовало также способов генетического маркирования, что было связано с недостаточностью сведений о геноме Pl. waltl, частично прочитанным относительно недавно (Elewa et al., 2017). Авторы работы Eroglu et al. (2020) разработали, новый независимый от генетического маркирования способ отслеживать судьбу клеток - предшественников эпикарда тритонов (Pl. waltl), что позволило выяснить частоту и динамику их конверсии в кардиомиоциты в норме и в условиях криоповреждения сердечной мышцы.
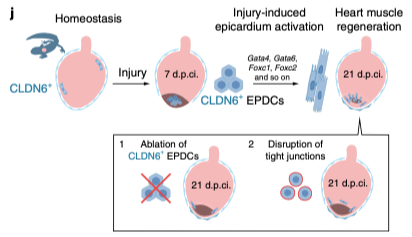
Для решения задачи применяли секвенирование РНК отдельных клеток (scRNA-seq), что дало возможность идентифицировать экспрессию гена и белка плотных контактов CLDN6, в качестве гомеостатического маркера клеток эпикарда. Удалось также осуществить трансгенез с помощью инъецированных в ооциты тритонов плазмиды Tol2-CAG:-loxP-mCherry-stop-loxP-h2bYFP и Tol2 транспозазы и благодаря этому получить трансгенных животных. TAT-Cre-опосредованная рекомбинация и ее высокая специфичность были ключевым элементом работы, при этом использовались и многие другие методы: криоповреждение апекса вентрального желудочка сердца постметаморфных животных, эхокардиография, клеточная диссоциация и сортинг, клеточное культивирование, иммуноцитохимия с использованием антител против белка CLDN6, маркеров пролиферации, подсчет Cre+ ядерного сигнала для определения границ между эпикардом и миокардом и другие. Важность экспрессии белка CLDN6 и зависимых от нее структуры и функции плотных контактов клеток предшественников эпикарда для регенерации были проверены элиминацией CLDN6+ клеток или нарушением самих контактов (рис. 1).
В результате было выяснено, что в норме, при нормальном гомеостазе имеет место конверсия клеток-предшественников эпикарда в кардиомиоциты, происходящая с низкой скоростью. После криоповреждения картина меняется. Несмотря на то, что относительно низкая степень специфического маркирования не давала возможности определить полный вклад эпикард-ассоциированных предшественников в производство новых кардиомиоцитов, предполагается, что как минимум 15% клеток миокарда замещаются за счет клеток-предшественников эпикарда. После криоповреждения желудочка сердца клетки-предшественники способы мигрировать из эпикарда в область повреждения, формировать там сотоподобные структуры, имеющие CLDN6+ фокальные контакты и, более того, дифференцироваться в кардиомиоциты, способные встроиться в структуру сердечной мышцы. Транскрипционный профиль этих клеток был представлен ключевыми, специфическими для кардиомиоцитов транскрипционными факторами Gata4, Gata6, Foxc1 and Foxc2, регистрируемыми в разной мере в ходе дифференцировки клеток предшественников в ходе регенерации. Другой особенностью части конвертирумых клеток-предшественников была ко-экспрессия мезенхимного маркерного белка виментина, гладкомышечного актина, обычно маркирующего гладкомышечные клетки и миофибробласты. Это свидетельствовало о дополнительном производстве клетками эпикарда клеток немиоцитарных линий.
Таким образом, впервые благодаря новым методам отслеживания судьбы клеток-предшественников эпикарда и производства ими клеточных линий, были определены траектории их конверсии в иные типы, а также генетические профили этих клеток в норме и при повреждении сердца тритона. Работа имеет хорошие перспективы исследований в двух направлениях. Первое – идентификация и молекулярно-генетическая характеристика исходных популяций клеток эпикарда, обладающих потенциалом конверсии в кардиомиоциты. Второе – использование данной модели и подходов способствует разработке способов стимуляции конверсии и пролиферации клеток эпикарда у видов животных и человека, не способных к восстановлению сердечной мышцы.
Ссылки
Elewa A., Wang H., Talavera-Lopez C., et al. Reading and editing the Pleurodeles waltl genome reveals novel features of tetrapod regeneration. Nat Commun. 8(1), 2286. doi: 10.1038/s41467-017-01964-9 (2017).
Oberpriller J. O., Oberpriller J. C. Response of the adult newt ventricle to injury. J. Exp. Zool. 187, 249–259 (1974).
Sadek H., Olson E.N. Toward the goal of human heart regeneration. Cell Stem Cell 26, 7–16. (2020).
Новость подготовила
© Григорян Э.Н.
24.05.2022