 © Лазебный Олег Евгеньевич
- старший научный сотрудник лаборатории эволюционной генетики развития ИБР РАН, кандидат биологических наук. Область научных интересов: генетика поведения, генетика количественных признаков, популяционная и эволюционная генетика.
© Лазебный Олег Евгеньевич
- старший научный сотрудник лаборатории эволюционной генетики развития ИБР РАН, кандидат биологических наук. Область научных интересов: генетика поведения, генетика количественных признаков, популяционная и эволюционная генетика.
Ученые из Научно-исследовательского института Скриппса (Scripps Research Institute: https://www.scripps.edu/) раскрыли механизм деактивации вирусом бактериальной иммунной системы. У многих видов бактерий эта система представляет собой сложный комплекс CRISPR/Cas, направляемый специфической cr-РНК. В центре комплекса находится узел наблюдения, который распознает вирусную ДНК и вызывает ее разрушение. Однако вирусы могут наносить ответный удар и отключать узел наблюдения с использованием «анти-CRISPR» белков. До вчерашнего дня никто не знал, как работает анти-CRISPR-система.
Впервые исследователи под руководством Габриэля Ландера (Gabriel C. Lander) расшифровали структуру вирусных анти-CRISPR белков, связанных с бактериальным наблюдательным комплексом CRISPR, выявив, каким образом вирусы выводят из строя бактериальную систему защиты: анти-CRISPR белки блокируют способность CRISPR-системы идентифицировать и атаковать вирусный геном. Один из анти-CRISPR-белков даже «имитирует» ДНК, чтобы сбить с толку детекторную машину.
Проиллюстрируем функционирование CRISPR/Cas-комплекса на примере CRISPR-опосредованной иммунной системы типа I-F Pseudomonas aeruginosa (рис. 1).
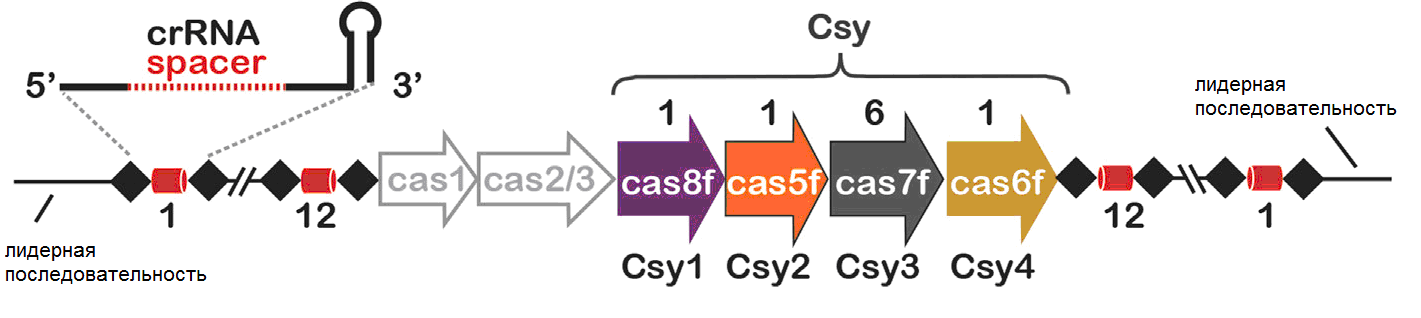
Рисунок 1. Схема CRISPR-опосредованной иммунной системы типа I-F синегнойной палочки (P. aeruginosa, штамм PA14).
Наблюдательный (детекторный) РНК (crРНК)-направляемый CRISPR-комплекс, сокращенно обозначаемый Csy-комплекс, состоит из шести генов cas (названия генов в комплексе даны под стрелками), окруженных двумя CRISPR-массивами. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats – сгруппированные регулярно перемежающиеся короткие палиндромные повторы) – блоки прямых палиндромных, т.е. взаимокомплементарных последовательностей, способных складываться в шпильки, повторов ДНК размером 28 пар нуклеотидов (черные ромбы). Эти повторы перемежаются спейсерами размером 32 п.н. (красные цилиндры) – уникальными последовательностями, заимствованными у фагов и плазмид, с которыми сталкивалась бактериальная клетка или ее предки. Каждый CRISPR-массив состоит из 12 повторов со спейсерами, лежащих после лидерной последовательности, обогащенной «легкоплавкими» АТ-парами.
Со временем ученые обнаружили, что они могут воспользоваться природной способностью комплекса CRISPR деградировать участки вирусной РНК и использовать системы CRISPR для модификации генов практически любого организма.
Хотя CRISPR/Cas9 является самой известной из систем CRISPR-редактирования, существует 19 различных типов CRISPR-систем, каждая из которых может иметь свои преимущества для генной инженерии. По мере исследования структуры этих систем открывается больше возможностей использования их в качестве инструментов для редактирования генома.
Используя метод криоэлектронной микроскопии, исследователи обнаружили три важных аспекта систем CRISPR и анти-CRISPR. Во-первых, они увидели, как комплекс наблюдения CRISPR анализирует генетический материал вируса, чтобы обнаружить сайт, который он должен атаковать. Белки в комплексе обернуты вокруг crРНК (рис. 2), обнажая определенные участки бактериальной РНК. Эти участки РНК сканируют вирусную ДНК в поиске последовательностей, которые они могут распознать.
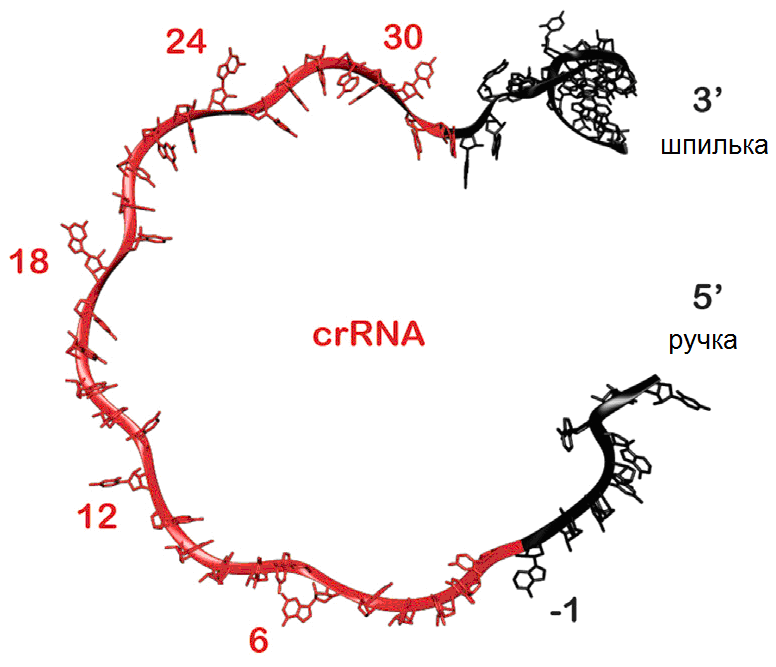
Рисунок 2. CRISPR-РНК – составная единица Csy-комплекса.
Csy-комплекс может очень быстро «прочитывать» протяженные последовательности ДНК и попадать точно в цель. При идентификации сайта-мишени на вирусной ДНК комплекс CRISPR инициирует активацию других молекул для уничтожения генома вируса.
Во-вторых, исследователи проанализировали процесс блокирования вирусными анти-CRISPR белками комплекса наблюдения (рис. 3). Они обнаружили, что один из анти-CRISPR белков перекрывает открытый участок cr-РНК, тем самым предотвращая Csy-комплекс от сканирования вирусной ДНК.
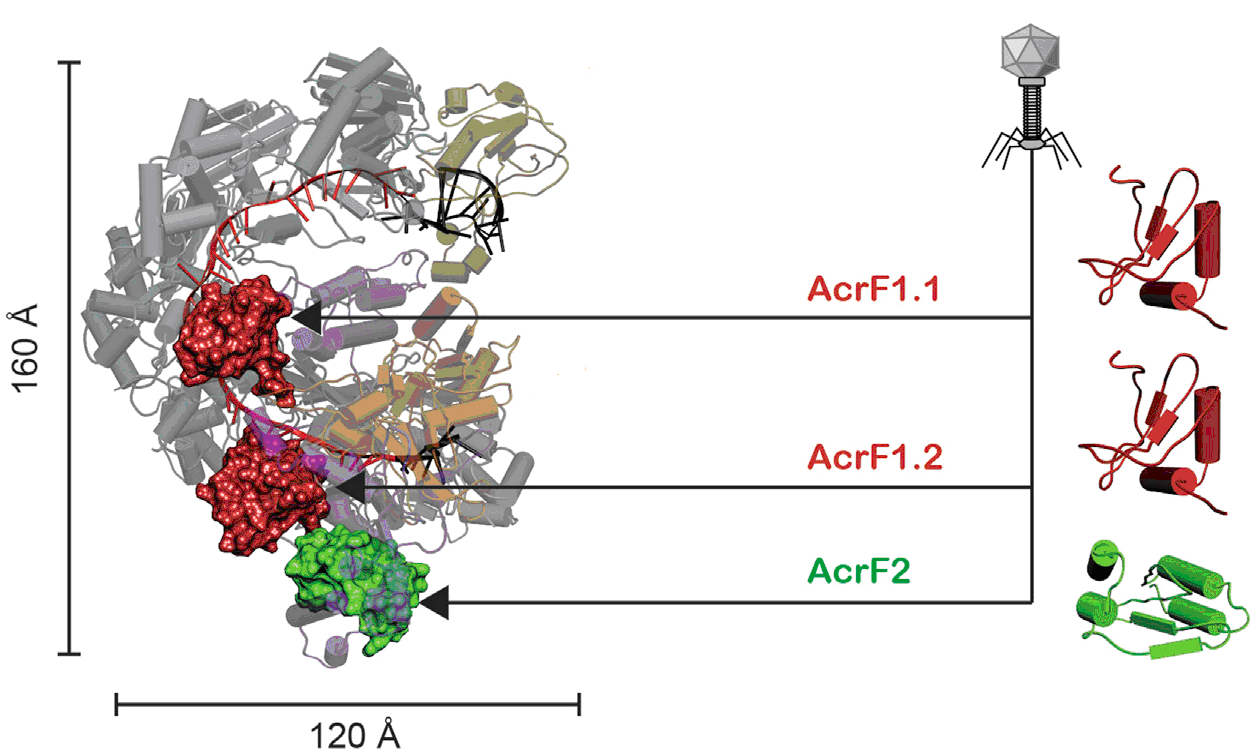
Рисунок 3. Атомная модель Csy-комплекса (слегка затенен), связанного с анти-CRISPR белками (AcrF1.1, AcrF1.2 и AcrF2). AcrF1 и AcrF2 помечены красным и зеленым цветом. Справа показана трехмерная структура этих белков.
По-видимому, анти-CRISPR белки эволюционировали таким образом, чтобы нацелиться на важнейшую часть Csy-комплекса. Мутации в этих участках бактериальной cr-РНК, которые помогли бы избежать вирусных атак, в любом случае должны приводить к невозможности функционирования самой системы CRISPR.
Наконец, второй тип анти-CRISPR-белка использует другой трюк: обладая характерной топологией и отрицательным зарядом, этот анти-CRISPR белок мимикрирует под ДНК, обманывая Csy-комплекс, который связывается с этим иммобилизованным белком, вместо атакующей вирусной ДНК.
Исследователи полагают, что новая информация об анти-CRISPR белках может привести к созданию более сложных и эффективных инструментов редактирования генома. Возможно, анти-CRISPR белки могут использоваться в системах CRISPR генного драйва для запуска или выключения редактирования гена.
Источник: www.scripps.edu/newsandviews/e_20170403/lander.html
Новость подготовил © 2017 Лазебный О.Е.
24.04.2017