Центрическое слияние хромосом (Робертсоновские транслокации) – вид хромосомных перестроек, при которых происходит слияние двух одноплечих акроцентрических хромосом с образованием одной двуплечей метацентрической. На нашем сайте Новостей уже не раз освещались исследовательские работы, посвящённые Робертсоновским транслокациям (см. недавний комментарий Тамбовцевой В.Г. «Путём запрограммированного слияния хромосом получен стабильный кариотип мыши» от 12.12.2022 к статье Wang и соавторов в журнале Science, которая посвящена хромосомной инженерии млекопитающих; или комментарий Баклушинской И.Ю. «Контакты негомологичных хромосом в мейозе как прелюдия к транслокациям Робертсоновского типа» от 04.05.2020).
Чем же интересны такие транслокации? Прежде всего они могут приводить к изменению числа хромосом в кариотипе видов, а значит, играть роль в видообразовании и влиять на ход эволюции в целом. Это возможно благодаря уникальной особенности таких перестроек не нарушать общее число генов (что может быть фатальным для организма), а изменять число хромосом, способствуя генетической изоляции популяции - условию, необходимому для эволюции новых видов (рис. 1).
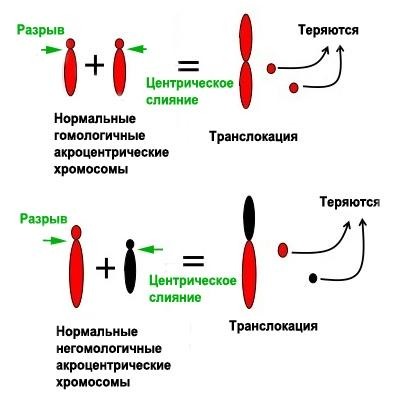
Рис. 1. Схема возникновения Робертсоновских транслокаций
Ярким примером Робертсоновской транслокации, меняющей кариотип, является вторая хромосома человека, которая возникла из-за слияния двух предковых хромосомам 2a и 2b у шимпанзе. Другой пример – кариотипы собаки и рыжей лисицы. Все 38 аутосом у собаки (Canis familiaris) являются акроцентриками, в то время как у рыжей лисицы (Vulpes vulpes), другого представителя псовых, все 16 пар аутосом являются метацентриками и происхождение 8-ми из них можно считать продуктом центрических слияний акроцентриков предковой формы (ссылка).
Мы задались вопросом, могут ли Робертсоновские транслокации возникать не только вследствие ионизирующего излучения (окружающая среда), а быть результатом мутаций, нарушающих стабильную структуру гетерохроматина прицентромерных районов (внутренняя среда клетки). Ведь в таком случае эти мутации потенциально могли бы влиять на ход эволюционного процесса через изменение хромосомного набора и иметь фундаментальное биологическое значение. Очевидно, что у таких мутантов будет повышенная частота нерасхождения хромосом. Отметим, что правильная сегрегация сестринских хроматид между дочерними клетками требует скоординированного взаимодействия центросом, центромер, кинетохоров, фибрилл веретена, топоизомераз, протеолитических ферментов и моторных белков. Каждый этап этого процесса контролирует определённый набор генов. Мутации в этих генах приводят к нерасхождению хромосом, однако они не нарушают структуру хроматина прицентромерных районов, и вряд ли будут способствовать центрическому слиянию.
С другой стороны, хромосомы должны быть "подготовлены" (или структурно организованы), когда они вступают в мейоз (или митоз). Структурная дезорганизация хромосом или их участков, контролирующих правильное спаривание гомологов во время мейоза, часто приводит к неправильной сегрегации гомологичных хромосом (явлению «нерасхождения»). Одним из способов организации эукариотического генома является формирование хромоцентра (схема на рис. 2). Эта ядерная структура возникает в дифференцированных соматических и половых клетках во время интерфазы и профазы мейоза и образуется в результате объединения прицентромерных районов всех или отдельных групп хромосом. Хромоцентр вовлечен в регуляцию поведения хромосом в делящихся клетках не только у насекомых, но и у растений, млекопитающих, моллюсков и даже дрожжей. Исследования на дрозофиле и мышах ясно показали, что его дезорганизация приводит к геномному дисбалансу (ссылка).
Детальное изучение хромоцентра в ооцитах дрозофилы показало, что его структура генетически запрограммирована. Оказалось, что мутации гена Trf2 (TBP-related factor 2) нарушают его формирование (рис. 2) (ссылка). Этот ген принадлежит к консервативному семейству генов TATA box-binding protein (Tbp) и кодирует альтернативный TBP базовый транскрипционный фактор, гомологичный белку Trf2 позвоночных.
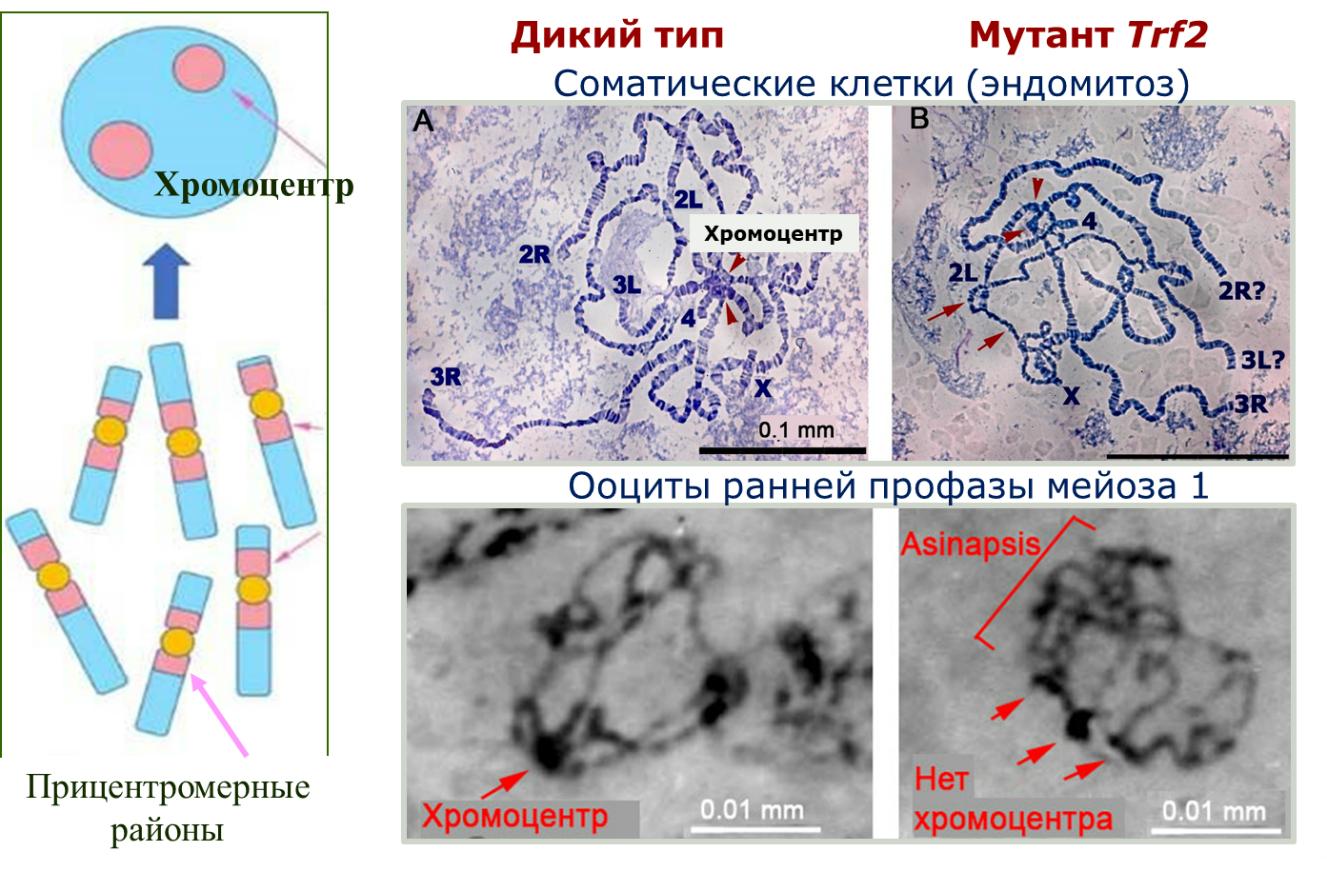
Рис. 2. TRF2 важен для формирования особой структуры хромосом, которая объединяет прицентромерный гетерохроматин в единый компартмент –хромоцентр
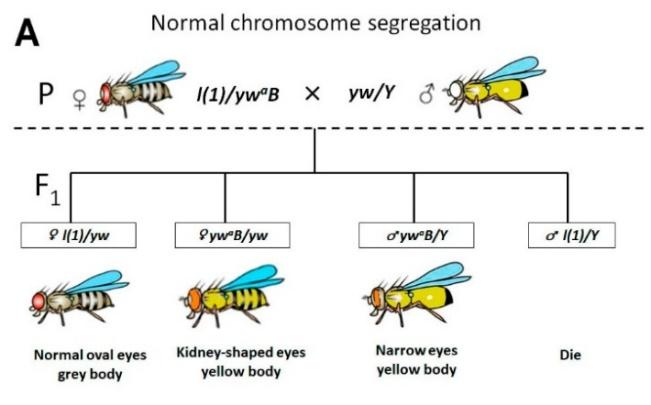
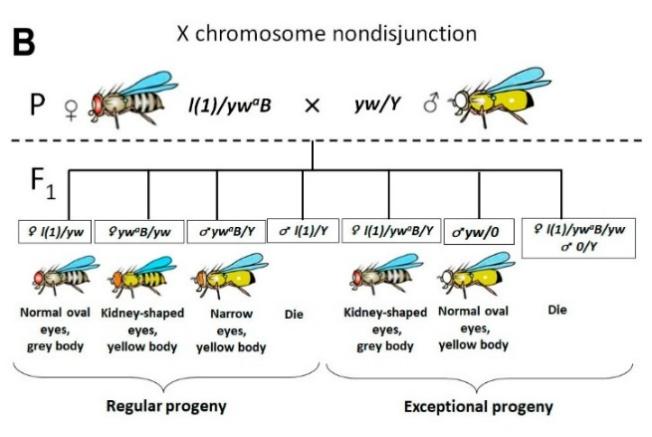
Консервативность Trf2 позволяет изучать его функции у дрозофилы. Учитывая специфический фенотип мутантов Trf2, связанный с нарушением прицентромерного гетерохроматина, мы предположили, что даже незначительное снижение активности этого гена может привести к центрическому слиянию хромосом. Отметим, что дрозофила является удобным организмом для такого рода исследований. У этого организма всего 4 хромосомы и две из них (Х-хромосома и хромосома IV) являются акроцентриками. Кроме того, у дрозофилы известно множество маркерных мутаций, которые позволяют проследить события нерасхождения хромосом в простых генетических экспериментах. На рис. 3 показано, как по количеству фенотипических классов (нормальных и исключительных) у потомков в первом поколении F1 можно выявить события нерасхождния Х-хромосомы и зафиксировать Робертсоновскую транслокацию.
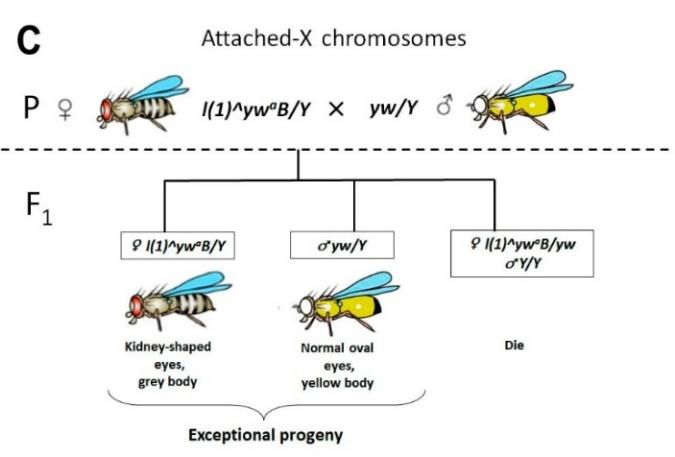
Для начала мы рассчитали частоту нерасхождения и наличие сцепленных Х- хромосом в линиях с летальными мутациями гена Trf2. Сцепление Х-хромосом у дрозофилы — это особый случай центрического слияния, в котором участвуют две гомологичные акроцентрические хромосомы. В результате, мы задокументировали образование таких изохромосом в двух из семи проанализированных линиях (рис. 4).
Мы не исключаем возможность центромерного слияния между X и четвертой хромосомами в наших экспериментах, но напрямую это не проверяли. Тем не менее, мы наблюдали образование микроядер в клетках S2 с обедненным Trf2, что может быть следствием анеуплоидии и запаздывания расхождения хромосом в митозе вследствие транслокаций между негомологичными хромосомами (см. далее по тексту).
Рис. 3. Схема генетического
эксперимента.
Фенотипические классы потомков F1 при: А – нормальном
расхождении Х-хромосом; В – при нерасхождении Х-хромосом у родительской
самки; С – при наличии сцепленных Х-хромосом у родительской самки.
Далее мы рассчитали частоту нерасхождения Х-хромосом и частоту встречаемости самок с нерасхождением Х-хромосом в этих линиях. Результаты представлены на рис. 4. Оказалось, что эти линии можно условно разбить на 2 класса: слабые (1) и сильные (2) аллели Trf2 - линии с низкой и линии с высокой частотой нерасхождения Х-хромосом соответственно (рис. 4А). При этом частота встречаемости родительских самок с нерасхождением в линиях первой группы оказалась в два-три раза выше, чем во второй (рис. 4В). Редкость самок с высокой частотой нерасхождения Х-хромосомы (из второй группы) можно объяснить тем, что в этих линиях эффект мутации Trf2 на дестабилизацию хромосом сильнее, чем в других, и многие гаметы погибают во время мейоза самок, выпадая из анализа. Более низкий уровень нерасхождения в оставшихся аллелях Trf2 позволяет выжить большему числу самок, производящих исключительное потомство, что повышает вероятность их обнаружения. Тем не менее, у всех мутантных аллелей Trf2 частота нерасхождения Х-хромосомы значительно превышала контрольную, рассчитанную для линии с балансерной хромосомой FM7a, на которой поддерживались летальные аллели Trf2 (1,4%), и для линии с аллелем Trf2 дикого типа, но с тем же, что и у мутантов Trf2, генетическим фоном (1,5%) (рис. 4).
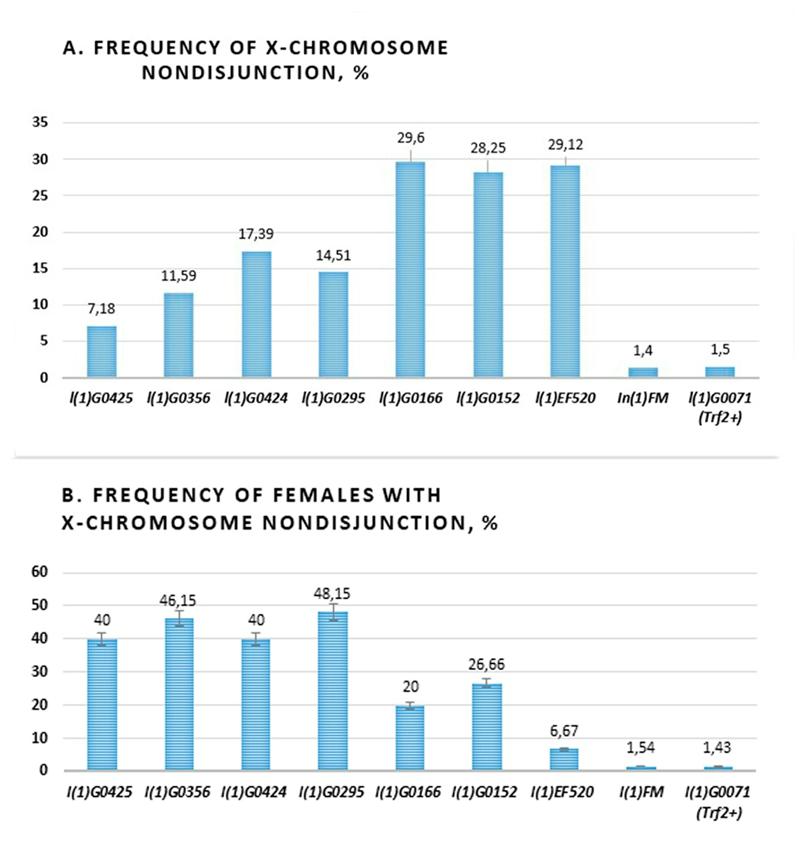
Рис. 4. Частота нерасхождения Х-хромосом в линиях с разными аллелями Trf2.
А - частота нерасхождения Х-хромосом. В - частота встречаемости родительских самок с нерасхождением Х-хромосомы. Последние 2 столбика на диаграммах – линии
контрольных дрозофил. Красным пунктиром выделены линии, где были обнаружены
самки со сцепленными Х-хромосомами. Планки погрешностей: стандартное отклонение (SD).
Оказалось, что в двух, l(1)G0425 и l(1)G0356, из семи протестированных линиях были самки со сцепленными Х-хромосомами. Мы заметили, что сцепление Х-хромосом возникало только в линиях со слабыми аллелями Trf2, у которых была низкая частота нерасхождения Х-хромосом, но которые встречались чаще (первая группа). Мы полагаем, что только слабые аллели Trf2 способны создать оптимальные "пограничные" условия дестабилизации генома, позволяющие выживать исключительным потомкам, в том числе с центрическим слиянием. Это означает, что даже небольшое снижение экспрессии Trf2 может создавать риск хромосомного дисбаланса и Робертсоновских транслокаций. Центрическое слияние хромосом часто сопровождает патологические генетически наследуемые синдромы человека (трисомия 13 (синдром Патау) и трисомия 21 (синдром Дауна)). Такие хромосомные перестройки, как и другие, могут быть вызваны экологическими факторами риска (например, ионизирующей радиацией или химическими канцерогенами), но, как мы впервые показали, могут быть обусловлены мутациями, которые дестабилизируют компактную структуру хроматина в перицентромерных областях.
Чтобы продемонстрировать наличие сцепленных Х-хромосом у родительских самок из линий l(1)G0425 и l(1)G0356, мы приготовили давленные препараты метафазных пластинок нейробластов мозга личинок. На препаратах ясно видно, что у самок этих линий Х-хромосомы формируют не V-подобные структуры, в норме характерные одноплечим акроцентрикам, а Х-подобные структуры, характерные метацентрикам (двуплечим хромосомам), дополнительно такие самки несут Y-хромосому, полученную от отца (см. схему на рис. 3С и рис. 5).
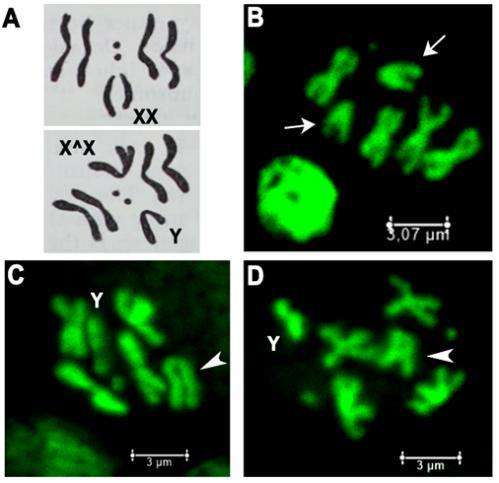
Рис. 5. Мутации Trf2 вызывают сцепление Х-хромосом.
А - схемы метафазных пластинок с нормальными Х-хромосомами (сверху) и сцепленными Х-хромосомами (снизу). В-D - метафазные пластинки нейробластов из мозга личинок: В -
особи дикого типа; С – мутанта l(1)G0425^FM7a/Y; D – мутанта l(1)G0356^FM7a/Y. Стрелками указаны нормальные Х-хромосомы (B), треугольными указателями –
сцепленные Х-хромосомы мутантов (C и D). Значком “Y” обозначена Y-хромосома.
Снижение экспрессии Trf2 подавляет транскрипцию гена D1 chromosomal protein.
Расщепление хромоцентра предполагает нарушение межхромосомных эктопических контактов в прицентромерной области гетерохроматина. D1 chromosomal protein (D1) кодирует связывающийся с сателлитной ДНК белок, который отвечает за упаковку прицентромерной ДНК хромосом в хромоцентры. Истощение D1 приводит к нарушению целостности ядра клетки и образованию микроядер. Поскольку Trf2 кодирует базовый фактор транскрипции, мы предположили, что он может управлять инициацией транскрипции гена D1. Мы проанализировали промоторную зону этого гена и показали наличие TRF2-зависимого промотора у этого гена.
Далее мы исследовали корреляцию сниженной экспрессии Trf2 c уровнем экспрессии гена D1. Для этого были сконструированы мухи с индуцибельной экспрессией шпилечной РНК для тканеспецифической инактивации Trf2 по пути РНК-интерференции (РНКи). Также в эксперименте использовали мутантов с пониженной экспрессией Trf2 и клеточную культуру S2 с индукцией нокдауна этого гена. Оказалось, что снижение экспрессии Trf2 in vivo (в дрозофилах) и ex vivo (в культуре клеток) приводит к снижению уровня мРНК гена D1 (рис. 6).
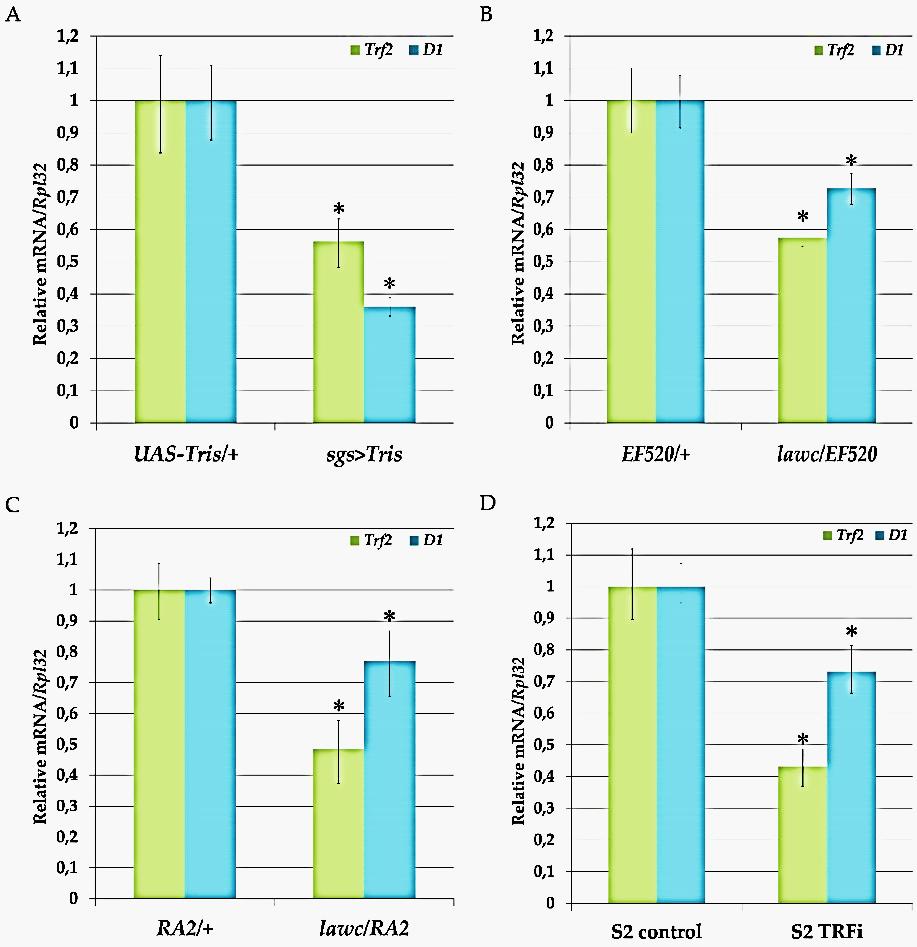
Рис. 6. Анализ относительного уровня экспрессии мРНК генов Trf2 и D1 в слюнных железах личинок, имаго и клетках культуры S2, измеренного qRT-PCR.
Уровень экспрессии Trf2 и D1: A - в слюнных железах контрольных личинок UAS-Tris/+ и личинок c нокдауном Trf2 (sgs>Tris); B - в мухах со сниженной экспрессией Trf2 – мутантах lawcp1/EF520 по сравнению с контролем - EF520/+; C - в мухах с делецией Trf2 - lawcp1/Df(1)RA2 по сравнению с контролем Df(1)RA2/+; D - в клетках S2 после РНКи-опосредованного сайленсинга Trf2 (S2-TRFi) по сравнению с контролем (клетки S2 обработаны двуцепочечной РНК (дцРНК), комплементарной к гену eGFP).* - P<0.05.
Наконец, мы обнаружили, что РНКи-опосредованное подавление Trf2 в клетках S2 дрозофилы ведет к образованию микроядер (рис. 7). Этот дефект может быть следствием неправильной сегрегации хромосом, вызванной различными хромосомными перестройками (в основном транслокациями, ссылка). С другой стороны, ошибки сегрегации хромосом в митозе нарушают сборку de novo ядерной оболочки. Действительно, мы наблюдали Lamin-отрицательные ядра в клетках, истощенных по TRF2 (рис. 7). Клетки с потерей функции D1 демонстрируют сходную аномалию, подтверждающую наше предположение о том, что Trf2 является фактором, контролирующим транскрипцию гена D1. Это говорит о том, что Trf2 может опосредованно, через контролируемые им гены-мишени влиять на структуру хромоцентра и D1 – лишь один такой представитель.
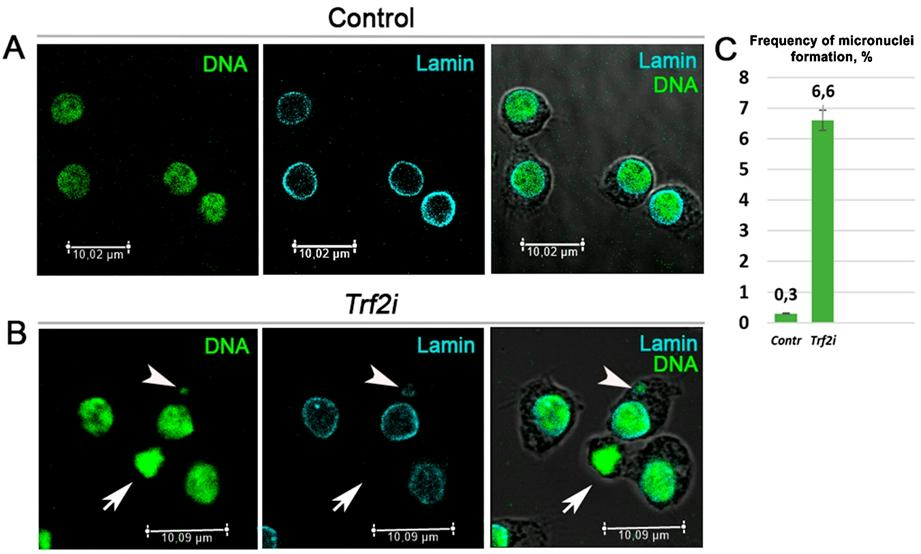
Рис. 7. РНКи-опосредованный сайленсинг Trf2 вызывает формирование микроядер и нарушает сборку ядерной оболочки после митоза.
Конфокальные
иммунофлуоресцентные снимки клеток Drosophila S2: A - до и B - после сайленсинга Trf2. ДНК окрашена SytoxGreen (зелёный), оболочка ядра - anti-Lamin Dm (циановый).
Треугольники показывают микроядро, стрелки – Lamin-негативные ядра. C - количество
клеток с микроядрами в контрольных клетках (Contr, n = 350) и клетках,
трансфецированных dsRNA TRF2 (Trf2i, n = 229) взятое из трёх независимых
экспериментов. p-значение по t-критерию Стьюдента равно 0.0047. Планки погрешностей:
стандартное отклонение (SD).
Недавние открытия показали участие Trf2 в специализированных программах транскрипции во время развития (ссылка). Существует предположение, что Trf2 способствовал эволюции третьего зародышевого листка (мезодермы) и билатериев, контролируя транскрипцию гомейозисных генов и генов мезодермы. Наши данные впервые указывают на то, что Trf2 может также создавать транскрипционную программу, ответственную за структурирование прицентромерных областей и может способствовать образованию новых кариотипов и видообразованию, в частности, за счет содействия центрическому слиянию хромосом.
Ниже приведены основные выводы этого исследования:
1. Центрические слияния хромосом чаще происходят в мейозе самок со слабыми аллелями Trf2. Это важное открытие, оно означает, что даже небольшое снижение экспрессии Trf2 может создавать риск хромосомного дисбаланса и Робертсоновских транслокаций. 2. Другой ключевой результат состоит в том, что D1 chromosomal protein является геном-мишенью Trf2. Учитывая, что D1 является основным белком для сборки хромоцентра, мы пришли к выводу, что эффекты действия Trf2 на хроматин опосредуются снижением экспрессии D1. 3. Наши данные впервые указывают на то, что фактор Trf2 может контролировать генную сеть, отвечающую за структуру прицентромерных регионов, и играть ключевую роль в формировании новых кариотипов, в частности, способствуя центрическому слиянию хромосом.
Эти неожиданные открытия имеют два принципиальных значения:
1. Несмотря на то, что работа была проведена на дрозофиле, ее результаты демонстрируют возможные риски для людей, несущих слабые гипоморфные аллели Trf2. Другими словами, снижение экспрессии Trf2 может потенциально привести к риску бесплодия или патологических генетически наследуемых синдромов человека (синдром Патау и синдром Дауна) даже при небольшом снижении экспрессии этого фактора.
2. Важным аспектом работы является демонстрация того, что Робертсоновские транслокации могут быть вызваны не только химическими мутагенами или радиацией, они также могут стимулироваться мутациями, дестабилизирующими компактную структуру хроматина в прицентромерных областях.
Новость подготовила
© Симонова О.Б.
24.01.2024