 © Захарова Людмила Алексеевна
доктор биологических наук, профессор, г.н.с. лаборатории клеточных и молекулярных основ гистогенеза.
Область научных интересов: клеточные и молекулярные механизмы взаимодействия нейроэндокринной и иммунной систем в онтогенезе.
© Захарова Людмила Алексеевна
доктор биологических наук, профессор, г.н.с. лаборатории клеточных и молекулярных основ гистогенеза.
Область научных интересов: клеточные и молекулярные механизмы взаимодействия нейроэндокринной и иммунной систем в онтогенезе.
Исследования последних лет теперь позволяют понять, почему обычные обезболивающие средства неэффективны при нейропатической боли. Лечение хронической боли направлено на подавление активности нейронов, однако такие меры могут оказаться безуспешными, если не устранить сенсибилизирующее влияние глиальных клеток. Исследование порочных кругов, обусловливающих подобное влияние, позволило предложить новые способы ликвидации самой причины нейропатической боли. В основе этих пока еще экспериментальных способов лежат нормализация активности глиальных клеток, подавление выработки ими факторов воспаления и воздействие противовоспалительными веществами.
Вплоть до второй половины ХХ века роль нейроглии, или просто глии (от др.-греч. νεῦρον — волокно, нерв + γλία — клей), составляющей около 40 % объёма ЦНС, сводили к выполнению опорной, трофической, секреторной, разграничительной и защитной функций. Долгие десятилетия всё внимание физиологов было сосредоточено на нейронах. Предполагалось, что нейроны, поддерживаемые глией, взаимодействуют через синапсы и формируют сложнейшие сети соединений, благодаря которым мы думаем, вспоминаем прошлое или испытываем радость. Хотя глиальных клеток значительно больше, чем нейронов, им отводили скромную роль элементов, поддерживающих жизнедеятельность мозга (транспорт питательных веществ из кровеносных сосудов в нейроны, поддержание нормального баланса ионов в мозге, обезвреживание от чужеродных агентов).
Современными исследованиями доказано, что глиальные клетки обмениваются сигналами о нейронной активности, как между собой, так и с нейронами. Ныне глие отводится важная роль в обеспечении многообразных метаболических процессов в нервной ткани, в формировании миелиновой оболочки, в восстановлении нервной ткани после травм и инфекций, а также в процессах долговременной памяти и обучения.
Еще в 2004 г. были опубликованы данные о том, что субстанция Р, глутамат и хемокинфракталин активируют глиальные клетки, в результате чего активируется секреция ими провоспалительных цитокинов и развивается феномен гипералгезии (усиление боли). При этом нередко возникают экстерриториальные или зеркально отражённые боли, не связанные с зоной первичного повреждения (Wieseler-FrankJ, MaierSF, WatkinsLR.Glial activation and pathological pain.Neurochem Int. 2004. 45(2-3):389-395).
В результате проводимых исследований количество трансмиттеров и посредников, осуществляющих несинаптическое взаимодействие нервных и глиальных клеток, постепенно увеличивается. Примером таких исследований является и статья Kronschläger с соавторами. Проводя комбинированную активацию микроглии и астроцитов с помощью агонистов P2X7 пуринорецептора или высокочастотной стимуляцией С-афферентов, они вызывали "глиогенную долговременную потенциацию (LTP)" на синапсах нейронов I пластины спинного мозга, получающих афферентацию по С волокнам. При этом активировались глиальные клетки спинного мозга, выделяющие нейромодулятор D-серин и провоспалительный цитокин фактор некроза опухоли (ФНО) альфа, которые, перемещаясь по спинномозговой жидкости, могли активировать нейроны отдалённых сегментов. Вследствие этого гипералгезия может распространяться на области тела, не подвергавшиеся повреждению и вызывать распространенную боль. Цитокины, выделяемые глиальными клетками в ответ на повреждение, повышают возбудимость уже активированных ноцицептивных (реагирующих на боль и повреждение) нейронов. Так замыкается порочный круг — импульсация нейронов все больше увеличивается, в ответ глиальные клетки выбрасывают все больше цитокинов и других сенсибилизирующих веществ, и возбуждение нейронов еще сильнее нарастает. Защитная реакция глиальных клеток, направленная на устранение нарушений функционирования нейронов, начинает усугублять и продлевать такие нарушения. При этом источником боли могут становиться все новые нейроны спинного мозга, изначально не связанные с поврежденным участком.
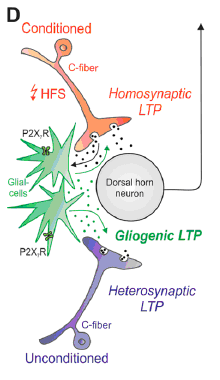 M.T. Kronschläger, R. Drdla-Schutting, M. Gassner, S.D. Honsek, H.L. Teuchmann,J.
Sandkühler “Gliogenic LTP spreads widely in nociceptive pathways” Science.2016:V. 354.Issue 6316. Р. 1144-1148 DOI: 10.1126/science.aah5715
|
Нейрональные сигналы ноцицептивной модальности неизменно сопровождаются изменением структурно-функциональных свойств всех типов глиоцитов. При этом отдельные глиальные механизмы на разных этапах болевого процесса могут иметь разное влияние на выраженность и длительность болевого синдрома. С одной стороны, секретируемые астроцитами интерлейкины ИЛ-1 и ИЛ-6, а также ФНО альфа и D-серин способствуют развитию патологических болевых феноменов. С другой стороны, они способны секретировать противовоспалительные цитокины (ИЛ-10 и ИЛ-4) и уменьшать выраженность боли в месте повреждения нервного ствола (Milligan ED, Watkins LR.Pathological and protective roles of glia in chronic pain.Nat Rev Neurosci.2009. 10(1):23-36. doi: 10.1038/nrn2533). Микроглиальные клетки в ходе развития нейропатологических процессов могут трансформироваться в провоспалительный и\или в нейропротективный фенотип, выполняя, таким образом, амбивалентную роль в нервной ткани (Коржевский Д.Э., Григорьев И.П., Колос Е.А. Молекулярная нейроморфология. Санкт-Петербург. Изд-во: СпецЛит. 2015. 110 с.). Статья M.T. Kronschläger и соавторов безусловно обогащает современные представления о роли нейроглии в патогенезе боли.
Новость подготовила © 2016 Захарова Л.А.
24.01.2017