Традиционно исследования эмбриогенеза были сфокусированы на роли сетей транскрипционных факторов в управлении развитием зародыша. Однако в последнее время накапливается все больше доказательств того, что метаболизм, являясь фундаментальным биологическим процессом, играет не менее важную и активную роль в эмбриональном развитии. Данный обзор, посвящен метаболическим характеристикам эмбриона на разных стадиях его развития, и раскрывает, как конкретные метаболиты и метаболические пути выступают в роли регуляторных сигналов, формирующих клеточную судьбу, тайминг развития и трехмерную организацию эмбриона.
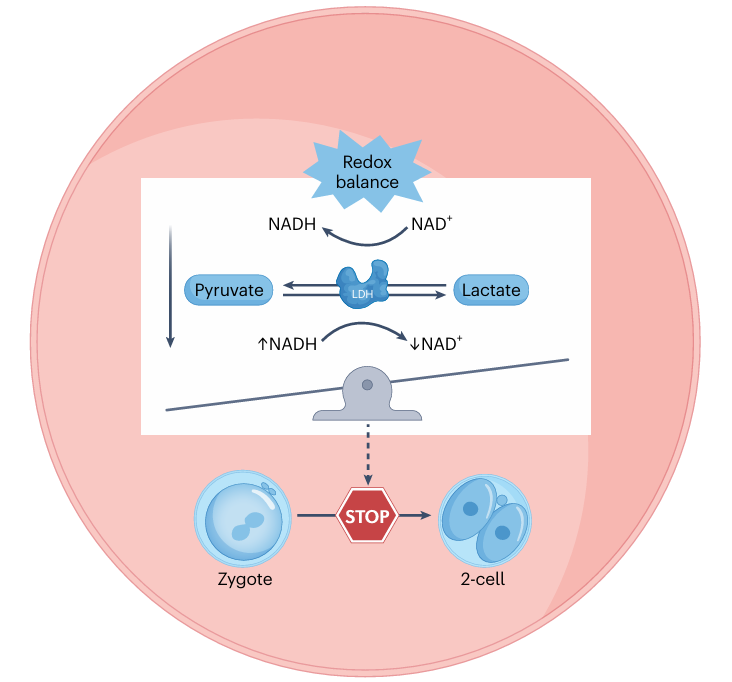
Раннее эмбриональное развитие, предшествующее активации зиготического генома (ZGA), характеризуется исключительной зависимостью от строго определенных метаболитов. Ключевым из них является пируват. Было показано, что его отсутствие в культуральной среде приводит к остановке развития на стадии 2-х клеток у мышей и 8-клеток у человека. Изначально предполагалось, что его роль сводится к энергообеспечению через цикл трикарбоновых кислот (ЦТК). Однако эмбрион на этой стадии находится в относительно «спокойном» метаболическом состоянии и производит мало АТФ. Более глубокие исследования показали, что основная функция пирувата — поддержание редокс-гомеостаза, то есть баланса окислительно-восстановительных реакций в клетке. Пируват и лактат взаимопревращаются с помощью фермента лактатдегигдрогеназы (ЛДГ), используя пару NAD+/NADH в качестве кофактора. При удалении пирувата нарушается этот баланс: уровень NADH резко возрастает, вызывая окислительный стресс. Добавление же NAD+ позволяет эмбрионам, лишенным пирувата, успешно развиваться далее. Аналогичную редокс-буферную функцию выполняет и пара α-кетоглутарат (α-KG) и L-2-гидроксиглутарат (L-2-HG). Таким образом, жесткий метаболический контроль на самых ранних этапах необходим в первую очередь для поддержания редокс-баланса, создавая оптимальную среду для последующих событий.
Рис. 1. Регуляция редокс-баланса в эмбрионе от стадии зиготы до двухклеточной стадии.
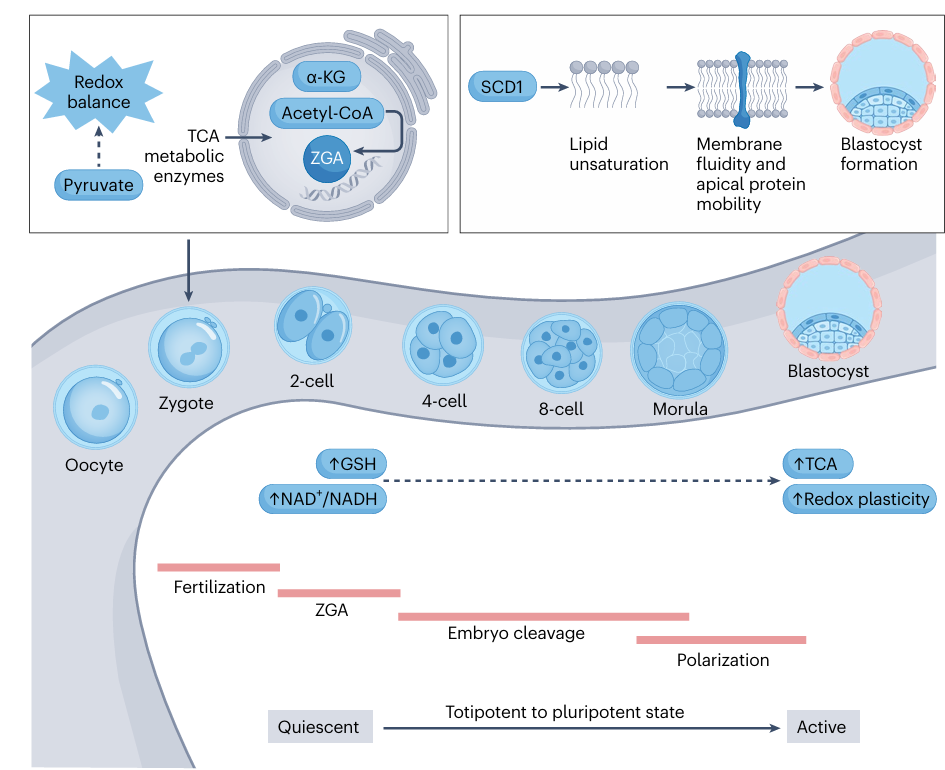
Важнейшим таким событием эмбрионального развития является ZGA — переход, при котором материнские РНК и белки деградируют, а активируется экспрессия генов самого эмбриона. Этот процесс сопровождается и облегчается метаболическим репрограммированием. Оказалось, что пируват критически важен и для успешной активации ZGA. Ферменты митохондриального цикла трикарбоновых кислот временно локализуются в ядре в процессе ZGA пируват-зависимым образом. Производные пирувата — ацетил-КоА и α-кетоглуторат (α-KG) — выступают как ключевые кофакторы и субстраты для эпигенетических модификаций (ацетилирования и деметилирования гистонов), непосредственно регулируя запуск зиготических генов. Лактат, в большом количестве обнаруживаемый в ядре ранних эмбрионов, необходим для нанесения специфической гистоновой метки — ацетилирования H3K18 (H3K18lac). Кроме того, NAD+ служит кофактором для сиртуина 1 (SIRT1), деацетилазы, которая обеспечивает своевременный выход из ZGA. Это демонстрирует прямую связь между метаболитами, эпигенетикой и активацией генома.
Рис. 2. Метаболические особенности ключевых последовательных событий в развитии преимплантационного эмбриона. Схематическая иллюстрация прогрессии от стадии ооцита до образования бластоцисты (на примере мышиной системы).
По мере развития от 2-клеточной стадии к бластоцисте эмбрион претерпевает важные метаболические изменения, переходя от восстановленного состояния к окислительному. Повышается митохондриальная активность, утилизация пирувата и потребность в глюкозе. Эмбрион приобретает метаболическую пластичность — способность гибко использовать различные энергетические субстраты благодаря развитым системам регуляции редокс-баланса (гликолиз, ЦТК, малат-аспартатный челнок). На этой стадии глюкоза играет не энергетическую, а сигнальную и морфогенетическую роль. Она необходима для перехода от морулы к бластоцисте и формирования двух клеточных линий — трофэктодермы (TE) и внутренней клеточной массы (ICM). Через путь биосинтеза гексозаминов (HBP) глюкоза способствует ядерной локализации транскрипционного фактора YAP1, а пентозофосфатный путь (PPP) обеспечивает синтез нуклеотидов для активации mTOR-сигналинга и трансляции фактора TFAP2C. Вместе эти белки формируют комплекс, запускающий экспрессию генов трофэктодермы. Липиды также важны как источник энергии и строительные блоки. Липидные капли мобилизуются через липофагию, обеспечивая правильное выполнение люменогенеза эпибласта, критического процесса в раннем эмбриональном развитии. Кроме того, фермент стеароил-КоА-десатураза-1 (SCD1), регулирующий ненасыщенные жирные кислоты, необходим для установления апикально-базальной полярности клеток, что является ключом к формированию бластоцисты.
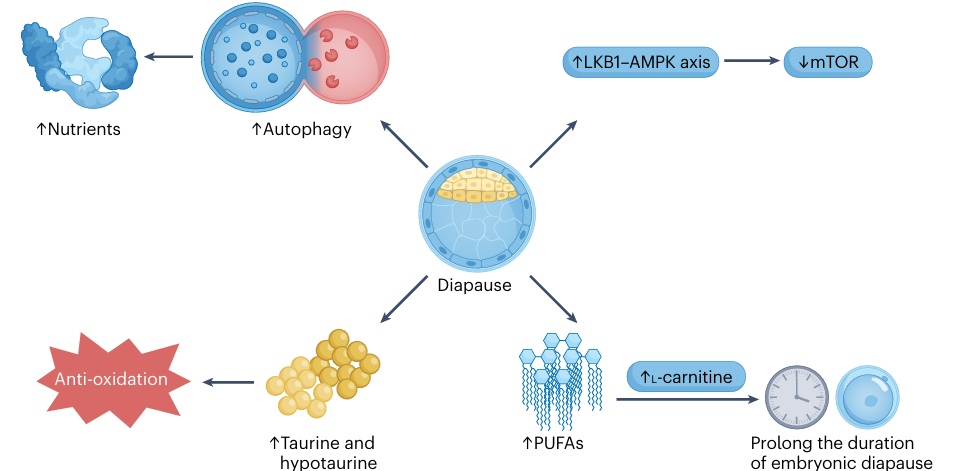
При неблагоприятных условиях эмбрион может впадать в состояние покоя перед имплантацией — так называемую диапаузу. Метаболизм бластоцист, находящихся в диапаузе, перестраивается: они начинают активно использовать липиды (в особенности полиненасыщенные жирные кислоты, ПНЖК) в качестве основного источника энергии, повышают активность аутофагии для переработки питательных веществ, и подавляют энергозатратный mTOR-сигналинг, одновременно активируя энерго-сенсорный путь LKB1-AMPK. Это позволяет эмбриону пережить неблагоприятный период. Интересно, что метаболические стратегии во время диапаузы различаются у разных видов: так, у мышей усиливается липолиз, в то время как человеческие бластоцисты переключаются на метаболизм галактозы.
Рис. 3 Метаболические процессы во время эмбриональной диапаузы.
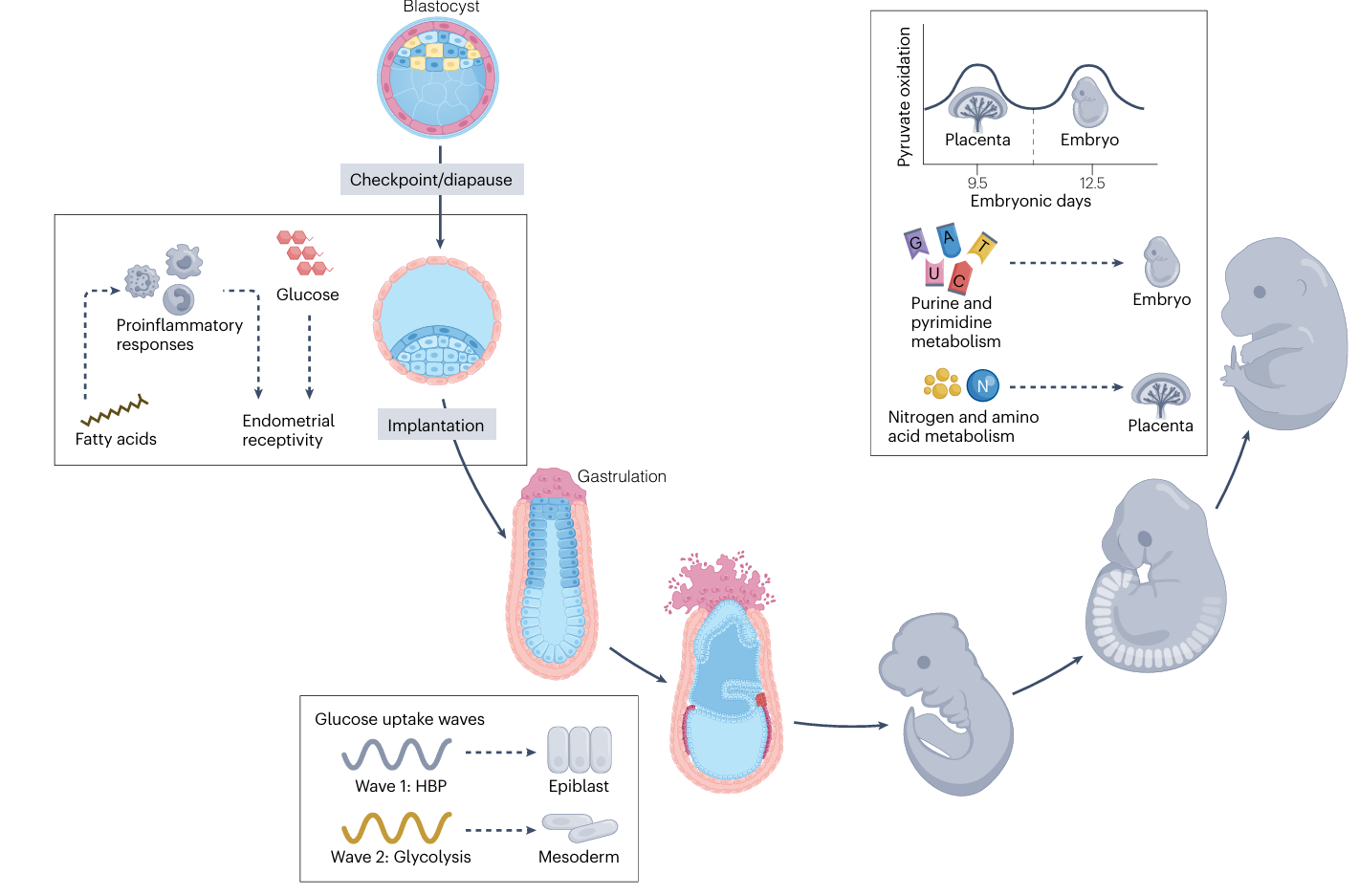
После имплантации метаболизм продолжает играть ключевую роль в морфогенезе. Во время гаструляции у позвоночных в пресомитной мезодерме (PSM) возникает метаболический градиент гликолитической активности. Этот градиент коррелирует с градиентами сигнальных молекул FGF и WNT и помогает обеспечить правильную сегментацию тела. Две последовательные волны метаболизма глюкозы регулируют определение судьбы эктодермальных клеток и миграцию мезодермальных клеток. В дальнейшем, на этапе органогенеза, метаболизм плода и плаценты подвергается интенсивной перестройке, при этом различные органы и ткани демонстрируют компартментализированные (разделенные пространственно) метаболические профили. Материнский метаболический статус, например, гипергликемия (повышенный уровень сахара в крови), может напрямую влиять на эти процессы. Это влияние проявляется в изменении источников углерода в тканях плода и способствует возникновению нарушений развития (эмбриопатий). Данный механизм подчеркивает возможность межпоколенческой передачи метаболических заболеваний.
Рис. 4 Метаболическая регуляция имплантации эмбриона и пост-имплантационного развития.
Отдельно авторы статьи отмечают, что современные технологии, такие как высокочувствительная масс-спектрометрия, позволяющая проводить анализ с малым количеством клеток, Рамановская спектроскопия для неинвазивной оценки качества эмбрионов, пространственная метаболомика и мечение изотопом C-13 для отслеживания метаболических потоков, революционизируют наше понимание метаболизма эмбриона. Эти методы открывают путь к оптимизации питательных сред для ЭКО (экстракорпорального оплодотворения), более эффективному управлению стволовыми клетками и разработке новых терапевтических стратегий. В заключение, метаболизм предстает не фоном, а дирижером эмбриогенеза. Он активно регулирует все ключевые процессы: от поддержания редокс-баланса и эпигенетического репрограммирования до клеточной дифференцировки, морфогенеза и адаптации к условиям среды. Глубокое понимание этих взаимосвязей открывает новую эру в биологии развития и репродуктивной медицине.
Новость подготовила
Никишина Ю.О.
25.09.2025