Эндогенные ретровирусы (ЭР) составляют около 10% генома млекопитающих. В норме они находятся в нетранскрибируемых, упакованных в гетерохроматин участках ДНК и подвержены многоуровневой репрессии. В одном из наиболее известных путей репрессии ЭР в плюрипотентных эмбриональных стволовых клетках задействован белок-корепрессор гетерохроматина TRIM28, который привлекается к ЭР транскрипционным фактором KRAB-ZFP (Rowe et al., 2010). TRIM28 привлекает к ЭР метилтрансферазу SETDB1 и белок гетерохроматина HP1α, тем самым поддерживая репрессированное состояние хроматина ретровирусных элементов.
Дерепрессия эндогенных ретровирусов приводит к летальности эмбриона, даже несмотря на то, что большинство эндогенных ретровирусов млекопитающих потеряли способность к ретротранспозиции. Даже полная делеция кластера генов, кодирующих транскрипционные факторы типа KRAB-ZFP, не приводит к повышенной частоте транспозиции у мышей (Wolf et al., 2020). Это навело авторов статьи Hijacking of transcriptional condensates by endogenous retroviruses на мысль, что летальность эмбрионов при дерепрессии эндогенных ретровирусов может быть связана не с транспозицией, а с их РНК-транскриптами.
РНК является частым компонентом конденсатов биологических молекул, формирующихся при разделении фаз ( Roden and Gladfelter, 2021). К таким конденсатам принадлежат многие безмембранные ядерные структуры, например ядрышко (Iarovaia et al., 2019). PHK также входит в состав стресс-гранул и телец Кахаля. Последние исследования указывают на роль РНК в формировании конденсатов белков-регуляторов транскрипции в ядре (Sharp et al., 2022). За счет электростатических взаимодействий, способствующих разделению фаз, свежетранскрибируемая РНК, вероятно, инициирует формирование транскрипционных конденсатов, обогащенных РНК полимеразой II и комплексом Медиатор. При дерепрессии ретровирусных элементов с них экспрессируются тысячи РНК транскриптов. Авторы предположили, что такие транскрипты могут “переманивать” на себя белки-регуляторы транскрипции и способствовать неадекватному перераспределению транскрипционных конденсатов в ядре.
Чтобы проверить эту гипотезу, был проведен ряд тщательных экспериментов. Была сгенерирована линия эмбриональных стволовых клеток мыши (mESC) c индуцируемой деградацией белка TRIM28, ответственного за репрессию ЭР. Далее, в этой линии было исследовано распределение репрессирующих (H3K9me3) и активирующих (H3K27Ac) меток (с помощью метода ChIP-seq), а также синтез новых РНК-транскриптов (с помощью метода TT-SLAM-seq (Muhar et al., 2018)). Было обнаружено, что при деградации TRIM28 происходит потеря репрессивных гистоновых меток на ЭР, резкое повышение уровня новосинтезированных транскриптов ЭР, а также резкое понижение уровней ряда эндогенных транскриптов, в частности транскриптов, ответственных за плюрипотентность и регулируемых супер-энхансерами. Если первые два результата были ожидаемы и подтверждали полученные ранее данные, снижение ассоциированных с супер-энхансерами транскриптов при деградации TRIM28 стало новым открытием.
Далее авторы проверили, связано ли это снижение с перераспределением транскрипционных конденсатов. Для этого они визуализировали положения компонентов транскрипционных конденсатов - РНК-полимеразы II и комплекса Медиатор, положения ряда хорошо изученных супер-энхансеров, регулирующих гены плюрипотенотности, и положения РНК-транскриптов ЭР с помощью методов FISH, RNA-FISH, иммуногистохимии и микроскопии супер-высокого разрешения PALM (Рис. 1).
В то время как в контрольных клетках наблюдалась постоянная колокализация РНК-полимеразы II и супер-энхансеров, в клетках с деградацией TRIM28 процент локализации был значительно снижен при сохранении того же уровня РНК-полимеразы II. Обратная тенденция наблюдалась для РНК-транскриптов ЭР: при деградации TRIM28 появлялась колокализация очагов ретровирусной транскрипции и элементов транскрипционных конденсатов. Форсированная оверэкспрессия транскрипционных факторов, ассоциированных с суперэнхансерами, восстанавливала нормальное распределение транскрипционных конденсатов, а нокдаун транскриптов ЭР восстанавливал нормальную экспрессию ассоциированных с супер-энхансерами генов плюрипотентности, что свидетельствовало о конкуренции между ретровирусными и эндогенными транскриптами.
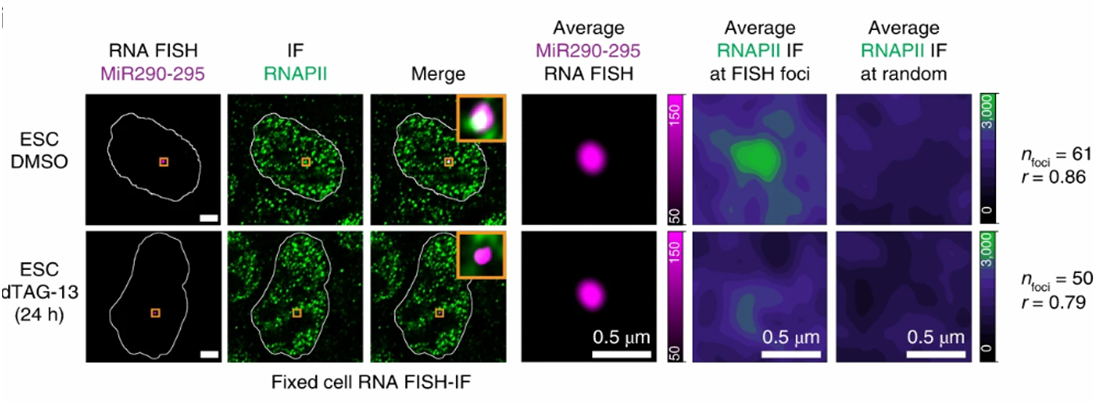
Рис. 1.
Репрезентативные изображения отдельных z-срезов сигналов RNA-FISH и ИФ (слева), а также изображение объединенных каналов (справа) . Ядерная периферия, определенная по окрашиванию DAPI, выделена белым контуром (масштаб 2,5 мкм). Также показаны усредненные сигналы либо RNA-FISH, либо ИФ на РНК полимеразу II, центрированные на очагах FISH или случайно выбранных ядерных позициях (масштаб 0,5 мкм). r - коэффициент корреляции Спирмена.
Чтобы исследовать данный феномен in-vivo, авторы вывели трансгенных мышей с делецией TRIM28, которая приводила к постепенной гибели эмбрионов, начиная со стадии E6.5. Секвенирование РНК единичных клеток данных эмбрионов на разных стадиях - от E5.5 до E7 - показало, что в этих эмбрионах наблюдается резкое снижение количества клеток эпибласта, которые в норме происходят от плюрипотентных клеток внутренней клеточной массы, и повышение количества экстраэмбриональных клеток, например клеток париетальной эндодермы (Рис. 2). При этом в клетках эпибласта наблюдался самый высокий общий уровень транскриптов ЭР, а во внутренней клеточной массе нокаутных эмбрионов уже на стадии E3.5 практически отсутствовала экспрессия важнейших генов плюрипотентности: NANOG, OCT4, SOX2 и KLF4. Таким образом, активация эндогенных ретровирусных элементов приводит к гибели эмбриона за счет деплеции плюрипотентных клеток.
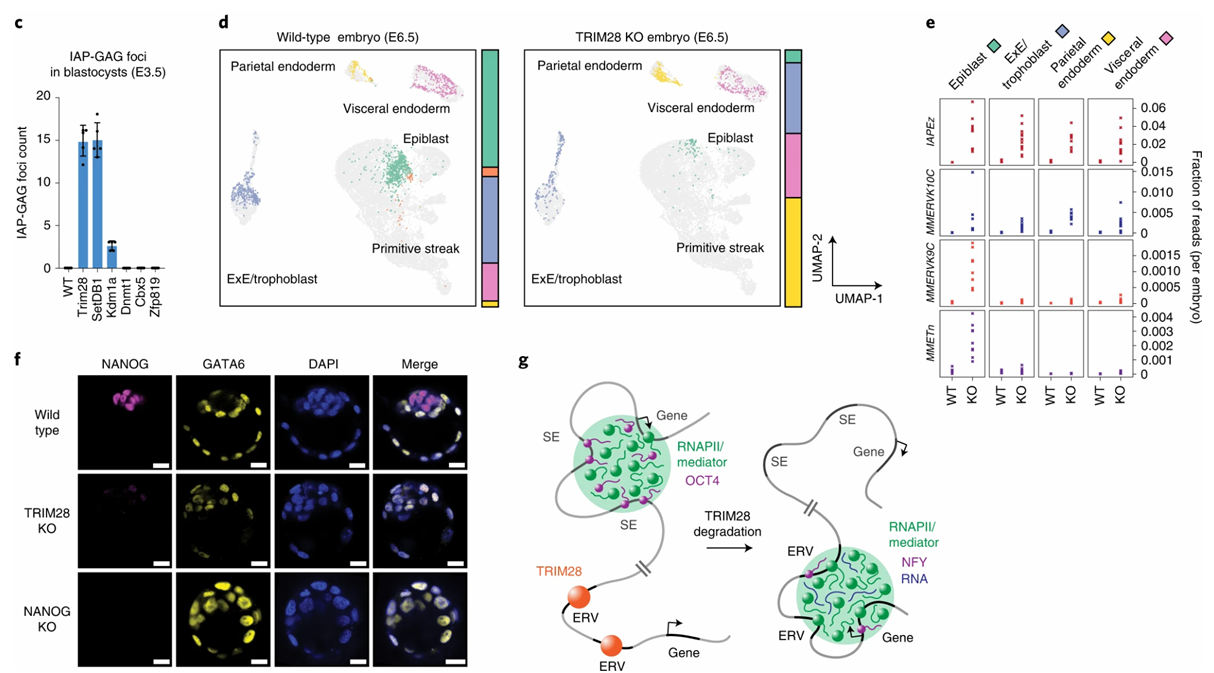
Рис. 2.
c) В эмбрионах с нокаутом TRIM28 и SETDB1 повышена экспрессия транскриптов ЭР. Количественная оценка очагов ретровирусного транскрипта GAG у нескольких эмбрионов с нокаутом указанного по горизонтали гена в трех независимых экспериментах. Данные представлены как средние значения ± s.d.
d) В эмбрионах с нокаутом TRIM28 снижается количество клеток эпибласта. Равномерная аппроксимация и проекция (UMAP) эмбрионов E6.5 дикого типа и E6.5 TRIM28 KO. Пропорции клеток, относящихся к отдельным клеточным типам, указаны справа от графиков. Exe - экстраэмбриональная эктодерма.
e) Экспрессия транскриптов разных таксонов ERV в эмбрионах TRIM28 KO мыши. График показывает долю прочтений РНК-секвенирования, которые соответствуют разным таксонам ERV в указанных типах клеток у эмбрионов дикого типа (WT) и TRIM28 KO в данных scRNA-seq. Каждая точка представляет один эмбрион.
f) Внутренняя часть бластоцисты эмбриона TRIM28 KO населена GATA6-экспрессирующими, NANOG-отрицательными клетками. Представлены репрезентативные IF-изображения NANOG и GATA6 в бластоцистах E3.5 дикого типа, TRIM28 KO и NANOG KO в двух независимых экспериментах, в каждом из которых было задействовано около 20 эмбрионов. Масштаб 20 мкм.
g) Модель захвата транскрипционных конденсатов. В плюрипотентных клетках транскрипционные конденсаты ассоциируются с супер-энхансерами (SE), связанными c транскрипционными факторами плюрипотентности (например, OCT4). В отсутствие TRIM28 транскрипционные конденсаты вокруг супер-энхансеров теряются и ассоциируются с дерепрессированными ERV.
Полученные результаты поддерживают предложенную авторами модель: эндогенные ретровирусные транскрипты переманивают на себя транскрипционные конденсаты, в норме ассоциированные с транскриптами, необходимыми для клетки, что объясняет летальность эмбрионов при дерепрессии ЭР. Это открытие интересно как для фундаментальных исследований эмбриогенеза, так и для исследований механизмов заболеваний, ассоциированных с избыточной транскрипцией ЭР, таких как боковой амиотрофический склероз и шизофрения.
Iarovaia, O.V., Minina, E.P., Sheval, E.V., Onichtchouk, D., Dokudovskaya, S., Razin, S.V., and Vassetzky, Y.S. (2019). Nucleolus: A Central Hub for Nuclear Functions. Trends Cell Biol. 29, 647–659. https://doi.org/10.1016/j.tcb.2019.04.003.
Muhar, M., Ebert, A., Neumann, T., Umkehrer, C., Jude, J., Wieshofer, C., Rescheneder, P., Lipp, J.J., Herzog, V.A., Reichholf, B., et al. (2018). SLAM-seq defines direct gene-regulatory functions of the BRD4-MYC axis. Science 360, 800–805. https://doi.org/10.1126/science.aao2793.
Roden, C., and Gladfelter, A.S. (2021). RNA contributions to the form and function of biomolecular condensates. Nat. Rev. Mol. Cell Biol. 22, 183–195. https://doi.org/10.1038/s41580-020-0264-6.
Rowe, H.M., Jakobsson, J., Mesnard, D., Rougemont, J., Reynard, S., Aktas, T., Maillard, P.V., Layard-Liesching, H., Verp, S., Marquis, J., et al. (2010). KAP1 controls endogenous retroviruses in embryonic stem cells. Nature 463, 237–240. https://doi.org/10.1038/nature08674.
Sharp, P.A., Chakraborty, A.K., Henninger, J.E., and Young, R.A. (2022). RNA in formation and regulation of transcriptional condensates. RNA N. Y. N 28, 52–57. https://doi.org/10.1261/rna.078997.121.
Wolf, G., de Iaco, A., Sun, M.-A., Bruno, M., Tinkham, M., Hoang, D., Mitra, A., Ralls, S., Trono, D., and Macfarlan, T.S. (2020). KRAB-zinc finger protein gene expansion in response to active retrotransposons in the murine lineage. ELife 9, e56337. https://doi.org/10.7554/eLife.56337.
Новость представила ©Анна Карпухина
23.08.2022
