 © Михайлов Виктор Сергеевич, главный научный сотрудник. Доктор биологических наук, профессор. Область научных интересов: репликация ДНК, репарация ДНК, ДНК-полимеразы, ДНК-связывающие белки, макромолекулярные синтезы в раннем развитии, репродукция вирусов.
© Михайлов Виктор Сергеевич, главный научный сотрудник. Доктор биологических наук, профессор. Область научных интересов: репликация ДНК, репарация ДНК, ДНК-полимеразы, ДНК-связывающие белки, макромолекулярные синтезы в раннем развитии, репродукция вирусов.Клетки прокариот в ходе эволюции выработали эффективный механизм адаптивного иммунного ответа на инвазивные патогены - CRISPR-Cas систему. Работа системы заключается в том, что нуклеаза Cas в комплексе с направляющей РНК (guide/CRISPR RNA, gRNA/crRNA) разрезает ДНК-геном патогена в участке связывания направляющей РНК. Это позволяет бактериям противодействовать инфекции плазмидами и бактериофагами. Приблизительно 40% секвенированных культивируемых бактерий и 87% архей имеют CRISPR-Cas систему какого-либо типа. Система CRISPR-Cas успешно адаптирована для редактирования генома в клетках млекопитающих и человека, и в настоящее время рассматривается как наиболее эффективный метод для генотерапии. Широкое применение системы CRISPR-Cas для редактирования геномов многоклеточных животных выявило ее существенные недостатки. Несмотря на высокую специфичность в отношении генов-мишеней система CRISPR-Cas вызывает с низкой частотой разрывы в других участках генома, может быть токсична и иммуногенна. Продолжительное присутствие активной CRISPR-Cas в клетках усугубляет эту проблему. Поэтому активность системы CRISPR-Cas в клетках должна быть строго регулируемой.
Эту задачу успешно решили бактерии включением в геном набора генов для белков-ингибиторов CRISPR-Cas системы. К настоящему времени в геномах бактерий идентифицированы 45 ингибиторных белков Acr шести различных типов. Эти белки кодируются диспергированными мобильными повторами, имеют относительно небольшой размер (50-200 а.к.), негомологичны друг другу и имеют различный механизм действия (рис. 1). Различные acr гены часто расположены в геноме тандемно. Наличие такой кассеты генов обеспечивает устойчивость бактерий к набору различных патогенов. Большинство белков Acr используют механизм подавления связывания нуклеазного комплекса с ДНК-мишенью (i на рисунке). Бактериофаги могут использовать белки Acr для подавления защитной реакции CRISPR-Cas системы в инфицированных бактериях. Именно поэтому рекомбинантные бактериофаги, кодирующие Acr факторы, являются перспективными агентами для антибактериальной фаговой терапии, особенно в условиях быстрого формирования устойчивости к антибиотикам у большинства патогенных бактерий.
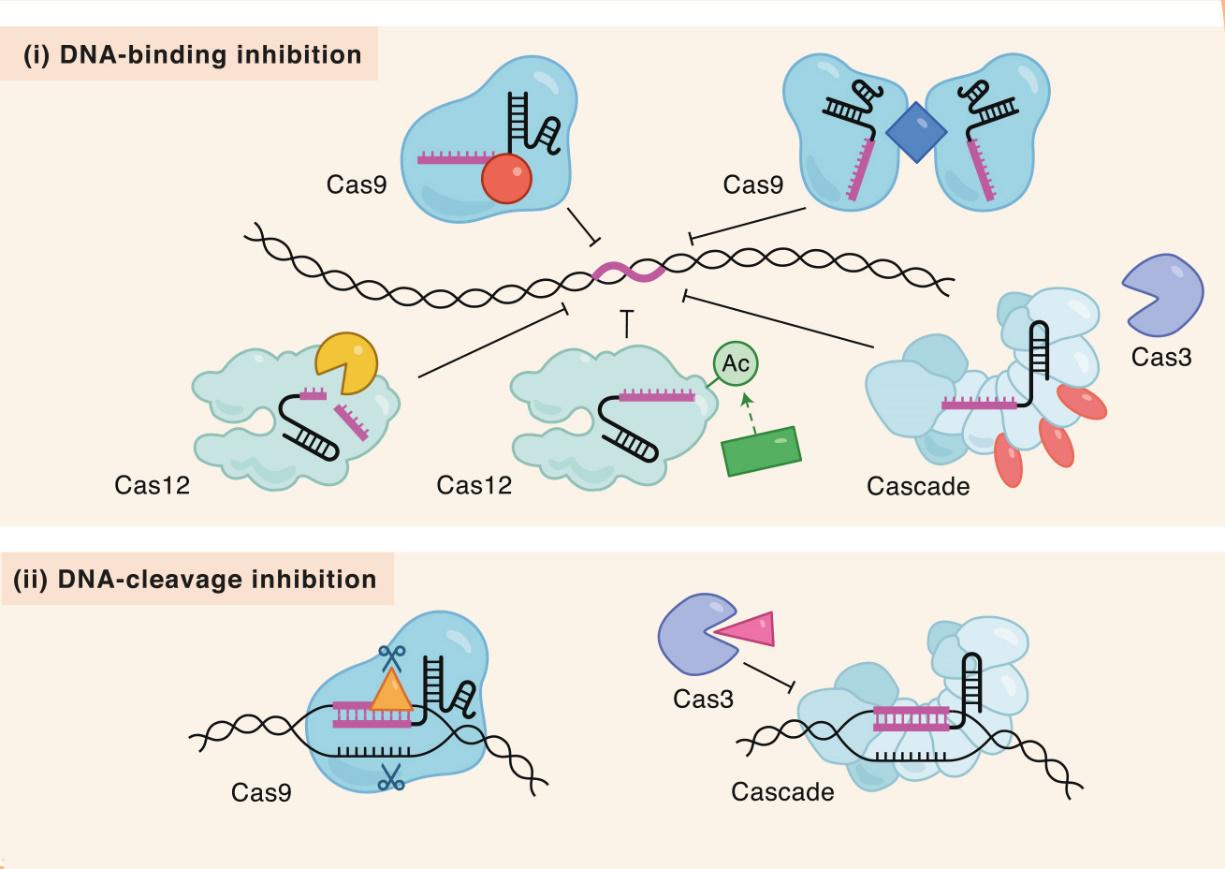
Рис 1. Механизм ингибирования активности CRISPR-Cas. (i) Ингибирование связывания с ДНК за счет блокирования сайта связывания (красный цвет), димеризации Cas (синий цвет), деградации crRNA (желтый цвет), химической модификации Cas (зеленый цвет), блокирования эффекторного комплекса с gRNA (голубой и оранжевый цвет). (ii) Ингибирование нуклеазной реакции в результате блокирования связывания ДНК-мишени с активным центром Cas (слева) и блокирования нуклеазы Cas (справа).
Применение экспрессионных конструкций, кодирующих белки Acr, в опытах по геномному редактированию в клетках растений и животных открывает новые возможности для тонкой регуляции активности CRISPR-Cas системы. Поскольку белки не способны преодолевать барьер клеточной мембраны, для введения белков Acr в клетки требуется рекомбинантные векторы. Удобным вектором для клеток млекопитающих являются аденоассоциированные вирусные векторы (AAV), которые эффективно трансдуцируют клетки млекопитающих. Емкость генома этих векторов невелика, но достаточна для включения генов acr. Вероятность неспецифической атаки генома возрастает при длительной активации CRISPR-Cas системы в клетках. Традиционные способы предотвращения неспецифических разрывов включают трудоемкое получение мутантных форм нуклеазы Cas c пониженной активностью или повышенной специфичностью. Этого не требуется в случае использования Acr-ингибиторов. Для предотвращения неспецифических разрывов генома, векторы с Acr факторами, блокирующими CRISPR-Cas, могут добавляться к клеткам на любой стадии после активации CRISPR-Cas системы.
Можно также регулировать экспрессию Acr разными способами – на транскрипционном уровне с использованием различных промоторов, в том числе индуцибельных, на пост-транскрипционном уровне с использованием микроРНК или с помощью специфических лигандов. Широкая субстратная специфичность многих белков Arc позволяет использовать одни и те же ингибиторы для подавления активности CRISPR-Cas систем разного типа. Эти и другие подходы с применением Acr факторов создают многоуровневую систему контроля активности CRISPR-Cas системы в клетках и снижают вероятность нежелательных побочных эффектов в опытах по геномному редактированию. Генные конструкции для экспрессии Acr факторов могут быть использованы для решения различных экспериментальных задач. Так, на основе Acr белков были получены флуоресцирующие биосенсоры, показывающие уровень экспрессии компонентов CRISPR-Cas системы и функциональное состояние комплекса в клетках дрожжей. Важным практическим приложением Acr факторов является их использование для титрования драйва модификаций, вносимых CRISPR-Cas системой, между сестринскими хромосомами.
Подобная регуляция важна для получения линий клеток гомозиготных по вносимым модификациям и для закрепления модификаций в потомстве. В рецензируемом обзоре представлены базовые сведения о новых способах регуляции активности CRISPR-Cas системы с использованием белков Acr, которые уже нашли применение в работах по редактированию генома.
Многочисленные группы исследователей продолжают работать над расширением возможностей системы CRISPR-Cas редактирования, в частности для одновременной модификации в клетках нескольких генов. Описаны опыты, в которых систему редактирования с нуклеазой Cas9 использовали с направляющими gRNA для разных генов. Более перспективным представляется недавно описанный подход, когда Cas9 была использована совместно с нуклеазой Cas12а, которая способна генерировать набор gRNA из конкатемерного транскрипта. Этот подход применим для одновременной модификации генов-паралогов, функционально связанных генов или экзонов.
Предложенная авторами система Cas-гибридного мультиплексного редактирования и скринирования (Cas Hybrid for Multiplexed Editing and screening Application (ChyMErA) System) была с успехом применена для идентификации генов, регулирующих клеточную пролиферацию в условиях подавления сигнального пути mTOR, и экзонов, связанных с адаптационными возможностями клеточных линий человека (T. Gonatopoulos-Pournatzis et al. Genetic interaction mapping and exon-resolution functional genomics with a hybrid Cas9-Cas12a platform. Nature Biotechnology. Published 16 March 2020. doi.org/10.1038/s41587-020-0437-z).
В будущем описанные методы, без сомнения, найдут более широкое и разнообразное применение и станут рутинной практикой геномного редактирования и функционального исследования генома.
Новость подготовил © Михайлов В.С.
23.03.2020