 © Подгорный Олег Владимирович, кандидат биологических наук, лаборатория проблем регенерации. Область интересов: развитие ЦНС, стволовые клетки мозга, разработка практических подходов к применению лазерной микродиссекции в клеточной и молекулярной биологии, применение современных методов флуоресцентной визуализации для изучения механизмов действия бактериальных токсинов на клетки эукариот.
© Подгорный Олег Владимирович, кандидат биологических наук, лаборатория проблем регенерации. Область интересов: развитие ЦНС, стволовые клетки мозга, разработка практических подходов к применению лазерной микродиссекции в клеточной и молекулярной биологии, применение современных методов флуоресцентной визуализации для изучения механизмов действия бактериальных токсинов на клетки эукариот.
Постнатальный нейрогенез в головном мозге млекопитающих вызывает особый интерес у нейробиологов последние примерно 25 лет, поскольку его открытие, а вернее сказать признание его существования, разрушило непоколебимую в течение длительного времени догму о том, что нервные клетки в центральной нервной системе не восстанавливаются. Это вселило надежду на успешную борьбу с нейродегенеративными заболеваниями. Проведенные многочисленные исследования показали, что в головном мозге сохраняются две области, в которых происходит генерация новых нервных клеток: субвентрикулярная зона боковых желудочков мозга и субгранулярная зона зубчатой извилины гиппокампа. Нейробласты, рожденные в субвентрикулярной зоне, мигрируют по так называемому ростральному миграционному пути, образованному клетками продольно ориентированной глии, в обонятельную луковицу, где они дифференцируются во вставочные нейроны. Новые клетки, рожденные в субгранулярной зоне, становятся зрелыми нейронами гранулярного слоя, функционально интегрируясь в существующую нервную сеть. Нейрогенез в гиппокампе притягивает особое внимание, поскольку предполагается его участие в познавательной функции, памяти и поддержании психоэмоционального состояния. Многократно показано, что нарушение любой из этих гиппокампальных функций сопровождается снижением нейрогенеза. Кроме того, возрастное снижение нейрогенеза в гиппокампе, которое обусловлено истощением пула стволовых клеток, связывают с ухудшением познавательных способностей и функции памяти в старости. Нейрогенез в гиппокампе сегодня рассматривается в качестве мишени для терапии, направленной на коррекцию нарушений познавательной способности и депрессивных состояний.
Сегодня мы достаточно много знаем о том, как происходит генерация новых нервных клеток в гиппокампе взрослых грызунов. В нашем распоряжении имеются линии модельных трансгенных мышей для изучения различных аспектов нейрогенеза. Но, самое главное, включение новорожденных нервных клеток в существующие нейронные сети гиппокампа прекрасно подходит для объяснения формирования пространственной памяти в поведенческих экспериментах на крысах и мышах. Изучению же вопроса о существовании постнатального нейрогенеза у человека уделялось гораздо меньше внимания, очевидно, из-за методических и этических особенностей исследования человеческого материала. Те же, кто занимался исследованиями нейрогенеза на грызунах, как правило, a priori подразумевали верность своих наблюдений в том числе и для человека, ссылаясь на самую первую работу (Eriksson et al., 1998), в которой были получены данные, подтверждающие существовании нейрогенеза в гиппокампе на протяжении всей жизни взрослого человека. В этой работе пациенты в возрасте от 57-ми до 72-х лет со сквамозной-клеточной карциномой либо в основании языка, либо в гортани получали внутривенную инфузию 5-бромо-2’-декоксиуридина (БрдУ), который встраивается в ДНК в S фазе клеточного цикла и наследуется потомками клетки, включившей его. Введение БрдУ таким пациентам было обусловлено диагностической необходимостью. После смерти пациентов ткани мозга, содержащие структуры гиппокампа, были взяты для анализа на присутствие в них метки БрдУ. Совместное иммуногистохимическое окрашивание на БрдУ и NeuN (маркер дифференцированных нейронов) или GFAP (маркер астроцитов) показало, что в зубчатой извилине человека детектируется до двух сотен БрдУ-позитивных клеточных ядер в 1 мм3, среди которых примерно по 20% колокализуются с маркерами нейронов или астроцитов. Таким образом, идентификация постмитотических нейронов у возрастных пациентов позволила сделать вывод о том, что у человека на протяжении всей жизни сохраняется нейрогенез в гиппокампе.
Хотя нейрогенез у взрослого человека подтверждался различными методами и другими исследовательскими группами (Knoth et al., 2010; Mathews et al., 2017; Spalding et al., 2013), в только что опубликованной статье в журнале Nature (Sorrells et al., 2018) авторы пришли к совершенно неожиданным и интригующим выводам. В обсуждаемой статье было проведено исследование аутопсийного и постоперационного (удаление фрагмента головного мозга при эпилепсии) материала головного мозга человека. При этом материал получали как из фетального (возраст плодов составлял 14 и 22 недели внутриутробного развития), так и из постнатального (возраст пациентов составлял от 0 до 77 лет) мозга человека. Анализ возрастных изменений показал, что нейрогенез в зубчатой извилине гиппокампа резко снижается в течение первого года жизни. Это выражается не только в значительном падении пролиферативной активности (Рис. 1), но и практически полном исчезновении молодых нейронов в гранулярном слое зубчатой извилины (Рис. 2). Кроме того, в отличие от других млекопитающих в зубчатой извилине человека делящиеся (Ki67- и Sox2-позитивные) и покоящиеся (Ki67-негативные и Sox2-позитивные) прогениторные клетки никогда не образуют морфологически выделенную субгранулярную зону, а окрашивание на GFAP никогда не выявляет клеток, морфологически сходных с радиальной глией.
Хотя ранее уже были сообщения (Dennis et al., 2016) о том, что генерация новых нейронов в гиппокампе человека ограничена ранним детством, обсуждаемая работа впервые показывает, что у человека никогда не формируется морфологически выделенная герминативная зона, характерная для других млекопитающих, в том числе обезьян. Очевидно, что эта работа окажет влияние на всю область, поскольку, если ее результаты подтвердятся, то придется пересматривать роль новообразованных нейронов в механизмах формирования пространственной памяти, познавательной функции и поддержании психоэмоционального состояния у человека. Следовательно, придется пересматривать и отношение к нейрогенезу как мишени для терапии когнитивных нарушений и депрессивных состояний.
В заключение необходимо отметить, что исследование нейрогенеза у человека является крайне трудной с экспериментальной точки зрения задачей. Во-первых, невозможно собрать однородные выборки пациентов по разным возрастам. Все люди имеют различный, и часто несопоставимый образ жизни (питание, вредные привычки, условия жизни и работы, травмы, инфекционные, наследственные, хронические, онкологические и иные заболевания), а также различные причины смерти. Во-вторых, временная задержка взятия аутопсийных образцов ткани мозга может приводить к неконтролируемым изменениям морфологии клеток и антигенных свойств маркерных белков, что может вылиться в ошибочную интерпретацию результатов. В-третьих, анализ проб, полученных при операциях на мозге, также может давать недостоверную картину гиппокампального нейрогенеза происходящего на фоне заболевания, требующего нейрохирургического вмешательства. В-четвертых, размеры гиппокампа человека, а также степень целостности материала сильно ограничивают возможности проведения полноценного морфометрического анализа, доступного на грызунах. Выборки используемых для обсчета срезов составляют объем, который ничтожно мал по сравнению с объемом зубчатой извилины человека, что также может снижать достоверность анализа. Таким образом, противоречивость данных о нейрогенезе в гиппокампе взрослого человека объясняется фрагментарностью исследований, а его существование или, наоборот, отсутствие требует многократных проверок различными исследовательскими группами.
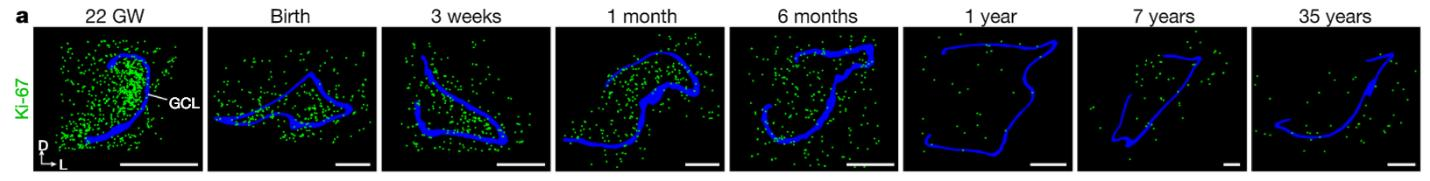
Рис.1. Возрастное изменение пролиферативной активности по маркеру Ki67 в зубчатой извилине гиппокампа. Синим цветом обозначен гранулярный слой зубчатой извилины гиппокампа. Зеленые точки соответствуют Ki67-позитиным делящимся клеткам. Рисунок взят из оригинальной статьи.
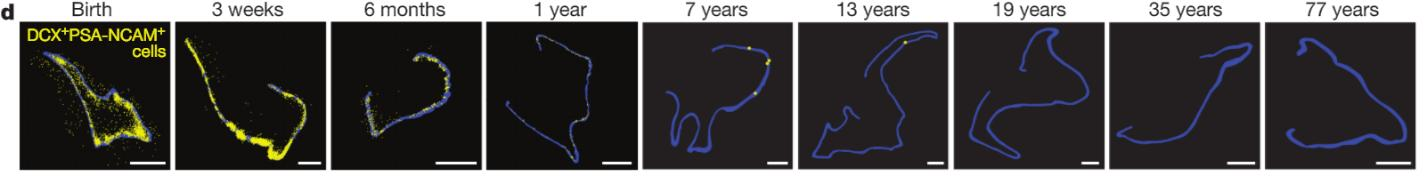
Рис.2. Молодые нейроны (DCX- и PSA-NCAM-позитивные клетки) не детектируются у пациентов старше 13 лет. Синим цветом обозначен гранулярный слой зубчатой извилины гиппокампа. Желтые точки соответствуют DCX- и PSA-NCAM-позитивным молодым нейронам. Рисунок взят из оригинальной статьи.
Литература:
Dennis C.V., Suh L.S., Rodriguez M.L., Kril J.J., Sutherland G.T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathol. Appl. Neurobiol. 2016 Dec;42(7):621-638. doi: 10.1111/nan.12337.
Eriksson P.S., Perfilieva E., Björk-Eriksson T., Alborn A.M., Nordborg C., Peterson D.A., Gage F.H. Neurogenesis in the adult human hippocampus. Nat Med. 1998 Nov;4(11):1313-7.
Knoth R., Singec I., Ditter M., Pantazis G., Capetian P., Meyer R.P., Horvat V., Volk B., Kempermann G. Murine features of neurogenesis in the human hippocampus across the lifespan from 0 to 100 years. PLoS One. 2010 Jan 29;5(1):e8809.
Mathews K.J., Allen K.M., Boerrigter D., Ball H., Shannon Weickert C., Double K.L. Evidence for reduced neurogenesis in the aging human hippocampus despite stable stem cell markers. Aging Cell. 2017 Oct;16(5):1195-1199.
Spalding K.L., Bergmann O., Alkass K., Bernard S., Salehpour M., Huttner H.B., Boström E., Westerlund I., Vial C., Buchholz B.A., Possnert G., Mash D.C., Druid H., Frisén J. Dynamics of hippocampal neurogenesis in adult humans. Cell. 2013 Jun 6;153(6):1219-1227.
Новость подготовил © 22.03.2018 Подгорный О.В.