 © Григорян Элеонора Норайровна,
главный научный сотрудник лаборатории проблем регенерации. д.б.н. Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
© Григорян Элеонора Норайровна,
главный научный сотрудник лаборатории проблем регенерации. д.б.н. Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
В декабре 2019 года в журнале Science Advances была опубликована статья, которая представляется интересной как для биологов, изучающих развитие, так и исследователей в области биомедицины. Работа имеет отношение к самому раннему пост-имплантационному эмбриональному развитию человека, но выполнена на модели, созданной биотехнологически. Частным вопросом, решаемым в статье, является моделирование процесса становления дорсо-вентральной организации нервной пластинки в развитии ЦНС человека.
Нейруляция является одним из ключевых событий эмбрионального развития. Она начинается с формирования нервной пластинки (НП) из нейроэпителиальных клеток в области дорсальной эктодермы. Затем происходит образование нервной трубки (НТ) за счет подворачивания краев пластинки. Постериорная область НТ дает начало спинному мозгу, тогда как антериорная становится впоследствии головным мозгом. Совместно они образуют ЦНС позвоночных. При этом в развитии НП и НТ важна спецификация не только в направлении антерио-постериорной оси, но и дорсо-вентральной. Эти совокупные процессы приводят к дифференцировке определенных, имеющих строгую локализацию внутри НТ групп нейрональных клеток предшественников.
При использовании различных модельных организмов в последние годы достигнуты большие успехи в понимании молекулярных механизмов становления дорсо-вентральной организации НТ. Общепринятым стало понимание того, что судьба региональных клеточных популяций НТ определяется факторами – морфогенами, секретируемыми окружающими тканями и действующими коротко-дистантно. Таким образом, положение клеток предшественников нейронов внутри НТ является определяющим в их дальнейшей судьбе благодаря влиянию разного набора и концентраций морфогенов в разных областях.
Исследования развития НТ человека ограничены получением эмбрионального материала и правилами работы на нем. В то же время использование только животных моделей, учитывая межвидовые особенности развитийных процессов, не всегда удовлетворяет полному пониманию развития НТ человека. Тут на помощь приходят линии стволовых плюрипотентных клеток человека (hPSCs).
Начиная с 2014 года (Warmflash et al, 2014), эти клетки стали применять для моделирования некоторых процессов пост-имплантационного эмбрионального развития человека. Было установлено также, что популяции получаемых из hPSCs нейральных клеток могут обладать свойствами, присущими развивающимся in vivo клеткам мозга человека (Itsykson уt al., 2005). Использование таких культур в условиях 3D in vitro продемонстрировало возможность их развития в многоклеточные, саморганизующиеся структуры, напоминающие различные отделы мозга и названные органоидами мозга (brain organoids). В пионерских работах (Meinhardt et al., 2014) и (Ranga et al., 2016) при использовании ESCs мыши удалось получить трехмерные органоиды, организованные в ДВ направлении. В целом работ с использованием hPSCs пока совсем немного и приведенное здесь исследование – пока единственная демонстрация того, что полученные из hPSCs органоиды, в терминологии авторов «цисты», способны служить моделью развития НТ человека с реализованным дорсо-вентральным планом ее строения.
Авторы использовали подходы, позволяющие в условиях 3D культивирования in vitro воспроизвести нейрогенную нишу для развития полученной из hPSCs нейральной цисты псевдоткани НТ, имеющей дорсо-вентральную организацию. Ключевыми элементами нейрогенной ниши in vivo стало наличие 3D внеклеточного матрикса и гелевой основы для механического и физикохимического пермессивного развития НТ из нейроэпителия со стороны вентрикулярной поверхности окружения. Такой «биомиметический» подход оказался удобным для манипуляций с динамическими силами микроокружения, а также химическими и биофизическими его сигналами - важнейшими факторами для морфогенетических процессов и спецификации нейральных клеток НТ.
В работе дано подробное описание создания указанной модели, в очень схематическом виде представленное на рисунке. В качестве клеточного материала для формирования НТ-подобных развивающихся цист применяли линии hESCs H9, H1, а также hiPSCs 1196a. Среди методов указано производство гелевых подложек, межклеточного матрикса и микроокружения, а также сред, обеспечивающих «эмбриональную индукцию» растущих hPSCs. Нейрональное направление развития обеспечивала среда культивирования на основе N2B27. «Дорсализация» и «вентрализация» нейроэпителия обеспечивались ранее разработанными средами, содержащими широкий набор ростовых факторов и их ингибиторов. Для изучения формирующихся НТ-подобных цист использованы иммуноцитохимия, qRT-PCR, конфокальная микроскопия и вестерн блот.
Морфогенами, индуцирующими развитие нейральных прогениторов НТ в том или ином направлении, являются факторы WNT, BMP, SHH сигналингов. Первые два отвечают в большей мере за развитие дорсальной эктодермы, а SHH служит приобретению клетками вентральной идентичности. При нейрализующем действии среды клетки растущих цист теряли плюрипотентность, продолжали делиться, формируя центральный просвет, приобретали апико-базальную полярность, демонстрировали интеркинетическую миграцию и псевдостратификацию, а также экспрессировали широкий набор ранних нейроэпителиальных маркеров. Все эти процессы имели сходство с развитием НП в НТ в области дорсальной эктодермы. Дорсо-вентральная организация нейроэпителиальных цист достигалась с помощью ретиноевой кислоты и/или фактора Shh, в результате действия которых происходило последовательное появление вентральной пластинки c P3 и pMN доменами в прилежащих областях. В результате этого «дорсальная» территория постепенно сужалась и ограничивалась противоположным вентральному дорсальным полюсом. Интересным в данной работе оказалось и то, что в выбранных условиях механической и биохимической поддержки развивающихся цист происходила дифференцировка их нейроэпителиальных клеток в соответствии с их региональными доменами по дорсо-вентральной оси. Выявление возникающих молекулярных отличий дорсальной и вентральной клеточных популяций проводилось с помощью мечения клеток специфическими маркерами региональных доменов. Интересно также и то, что при 3D культивировании в геле, дорсо-вентральный паттернинг полученных из hPSCs нейроэпителиальных цист инициировался после удаления из среды экзогенных, добавляемых в среду морфогенов. Авторы связывают это явление со свойством «гистерезиса» (hysteresis, память о сигнальном пути), в данном случае - продолжением работы SHH после удаления из среды культивирования данного морфогена. С этим же явлением увязывается и действие ретиноевой кислоты, активирующей SHH-опосредованный вентральный паттернинг, т.е. дальнейшую спецификацию прогениторных, в работе FOXA2+ FP, клеток. В этой связи авторы задаются вопросом является ли SHH достаточным для широкой по территории спецификации вентральной области НТ-подобных развивающихся цист и, изучив динамику появления «вентральных» клеток, приходят к выводу, что в этом домене дополнительно работают эндогенные, самоусиливающие действие внешнего морфогена, активаторы / ингибиторы его влияния. Эта гипотеза требует проверки, однако она соответствует и другим известным данным о способности получаемых из PSCs нейральных органоидов развиваться самостоятельно, демонстрируя самоорганизацию, сходную с нормальным развитием структуры in vivo.
Выявленная в работе самоорганизация получаемой из нейральных цист НТ после снятия экзогенного индуцирующего влияния послужит моделью для решения интреснейшего и важного вопроса биологии развития - вопроса о взаимоотношении внешнего индуцирующего влияния факторов со стороны окружающих тканей и внутренней способности ткани к саморегуляции развития. Решение этой проблемы очень важно для понимания ранних этапов эмбрионального развития, в частности формирования ЦНС позвоночных животных и человека. Помимо этого предложенная авторами статьи модель полученной из hPSCs, формирующейся in vitro псевдоткани НТ человека может стать полезной для развития подходов регенерационной терапии, основанной на стволовых клетках, а также для моделирования различных нарушений ЦНС, связанных с развитием, человека и животных.
Цитирование:
A. Warmflash, B. Sorre, F. Etoc, E. D. Siggia, A. H. Brivanlou. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nat. Methods 11, 847–854 (2014).
P. Itsykson, N. Ilouz, T. Turetsky, R. S. Goldstein, M. F. Pera, I. Fishbein, M. Segal, B. E. Reubinoff. Derivation of neural precursors from human embryonic stem cells in the presence of noggin. Mol. Cell. Neurosci. 30, 24–36 (2005).
A. Meinhardt, D. Eberle, A. Tazaki, A. Ranga, M. Niesche, M. Wilsch-Br.uninger, A. Stec, G. Schackert, M. Lutolf, E. M. Tanaka. 3D reconstitution of the patterned neural tube from embryonic stem cells. Stem Cell Rep. 3, 987–999 (2014).
A.Ranga, M. Girgin, A. Meinhardt, D. Eberle, M. Caiazzo, E. M. Tanaka, M. P. Lutolf. Neural tube morphogenesis in synthetic 3D microenvironments. Proc. Natl. Acad. Sci. U.S.A. 113, E6831–E6839 (2016).
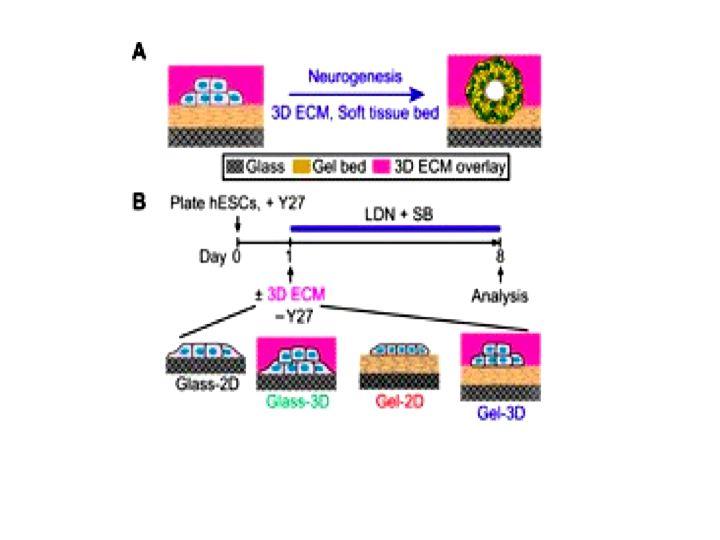
Рис. А – схема культивирования hPSCs и получаемых из этих клеток нейральных цист, В – для сравнения, культуры без геля, но с ЕСМ (Glass-3D), с гелем, но без ECM (Gel-2D), или без геля и ЕСМ (Glass-2D).
Новость подготовила © 2020 Григорян Э.Н.
21.01.2020