 © Кузнецова Алла Викторовна,
старший научный сотрудник лаборатории проблем регенерации, канд. мед. наук.
© Кузнецова Алла Викторовна,
старший научный сотрудник лаборатории проблем регенерации, канд. мед. наук.
Область научных интересов: межклеточные и клеточно-матриксные взаимодействия, опухолево-стромальные взаимодействия, дедифференцировка, эпителиально-мезенхимальный переход.
В современной онкологии существуют два активно развивающихся направления: иммунотерапия, которая нацелена на раковые клетки, и таргетная терапия опухолевого микроокружения (англ. tumor microenvironment, TME). TME представлено многочисленными клетками, среди которых важная роль принадлежит опухоль-ассоциированным фибробластам (сancer-associated fibroblasts, CAFs), участвующим в десмоплазии. Последняя выражена в солидных раках, где обуславливает химиотерапевтическую резистентность.
В обзоре рассматриваются различные аспекты опухолево-стромальных взаимодействий в TME протоковой аденокарциномы поджелудочной железы (англ. pancreatic ductal adenocarcinoma, PDAC) и проблемы в разработке новых терапевтических стратегий для вмешательства в прогрессирование данного заболевания.
Диагностика и лечение карциномы экзокринной части поджелудочной железы представляет собой серьезную проблему для современной медицины. Заболеваемость раком поджелудочной железы увеличивается с каждым годом. Из всех солидных злокачественных новообразований рак поджелудочной железы является заболеванием с высокой летальностью, при котором общая 5-летняя выживаемость составляет менее 10%; он занимает третье место среди причин смертности от рака (Siegel et al., 2022). Наиболее распространенной формой рака поджелудочной железы является PDAC. Из-за отсутствия эффективных стратегий раннего выявления у большей части пациентов PDAC диагностируется на неоперабельной стадии. Поэтому необходимы новые стратегии как к раннему выявлению заболевания, так и к системному терапевтическому лечению.
Развитие PDAC, метастатическая способность и ответ на терапию определяются не только характеристиками раковых клеток, но и их взаимодействием с окружающей средой – стромой. Поскольку прогрессирование рака тесно связано с физиологическим состоянием TME, которое в значительной степени способствует прогрессированию опухоли, оно рассматривается как перспективная мишень для лечения рака. Аномальная пролиферация стромальных клеток, наряду с измененной динамикой внеклеточного матрикса (ВКМ), способствует формированию онкогенного микроокружения, что приводит к злокачественной трансформации, и облегчает способность раковых клеток к выживанию и инвазии. Следовательно, на онкогенез и метастазирование рака сильно влияет измененный ВКМ, который обычно возникает в результате неудачной попытки восстановить поврежденную ткань.
TME представляет собой сложную систему, которая состоит из гетерогенной популяции клеток, кровеносных и лимфатических сосудов, компонентов ВКМ и сигнальных молекул (LeBleu and Kalluri, 2018; Thomas and Radhakrishnan, 2019). Вместе эти компоненты образуют оптимальное TME, ответственное за межклеточную коммуникацию, питание клеток, передачу сигналов и дальнейшее поведение клеток (Vitale et al., 2019).
Среди нераковых/нормальных клеток выделяют стромальные клетки (в том числе резидентные фибробласты, CAFs, миофибробласты, перициты), эндотелиальные клетки, нейроны и иммунные клетки (Т- и В-клетки, NK клетки, дендритные клетки, связанные с опухолью моноциты и макрофаги, полиморфно-ядерные лейкоциты).
Активированные фибробласты или CAFs являются основными компонентами стромы опухоли, которые ответственны за избыточную продукцию ВКМ. CAFs играют важную роль в пролиферации, инвазивности и метастазировании раковых клеток. Однако, механизмы, лежащие в основе влияния CAFs и ВКМ на прогрессирование рака, до сих пор неясны. В обзоре подробно рассматриваются различные компоненты ВКМ, обнаруживаемые в PDAC, приводятся примеры доклинических и клинических исследований различных препаратов, направленных на регуляцию свойств и состава ВКМ при данном заболевании.
CAFs – это неоднородная популяция стромальных фибробластов с различными фенотипами и функциями, изменяемыми во время туморогенеза. В строме одной опухоли могут сосуществовать как иммуносупрессивные, так и иммуноподдерживающие субпопуляции CAFs. В обзоре приводится характеристика различных субпопуляций CAFs, их происхождение и маркеры.
Предшественниками активированных фибробластов или CAFs считаются стромальные звездчатые клетки поджелудочной железы (англ. pancreatic stellate cells, PSCs), которые представляют собой увеличивающуюся популяцию клеток, размножающихся in situили рекрутируемых в опухоль. Как показано на мышиной модели PDAC, PSCs действительно являются предшественниками CAFs, но эта популяция CAFs, полученная из PSCs, численно незначительна, что предполагает дополнительное и все же неопределенное клеточное происхождение для большинства CAFs при PDAC (Helms et al., 2022).
В настоящее время ориентация на CAFs становится одной из самых привлекательных стратегий противоопухолевой терапии. Попытки нацелиться или перепрограммировать определенные подтипы CAFs открывают большие возможности для лечения рака. Целью стромально-направленной терапии при PDAC является достижение оптимального баланса между стромальным истощением и перепрограммированием TME. Различные подходы к таргетной терапии, направленные на CAFs и ВКМ при PDAC, обобщены на рисунке 1.
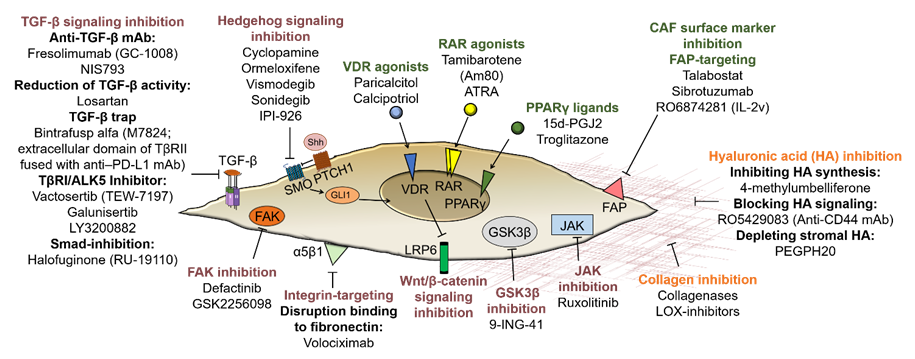
Наиболее актуальные и новые клинические испытания, направленные на строму при раке поджелудочной железы, приведены в обзоре.
Сочетание сигнал-зависимого репрограммирования стромы с цитотоксическими и иммунологическими препаратами, направленными на опухоль, является новым методом лечения PDAC (Sherman et al., 2015; Garcia-Sampedro et al., 2021). Иммунотерапевтический подход может принимать различные формы, включая опухолеспецифические вакцины, ингибиторы иммунных контрольных точек или терапию активированными Т-клетками. Каждая из этих модальностей была исследована в доклинических моделях и продемонстрировала готовность действовать в контексте PDAC. Однако на сегодняшний день испытания иммунотерапии одним агентом не дали клинической пользы при PDAC, поэтому рекомендуется многосторонний подход (Garcia-Sampedro et al., 2021). Кроме того, как показано в недавнем исследовании, поверхностные молекулы, которые заставляют традиционные ингибиторы контрольных точек работать при других видах рака, просто отсутствуют в опухолях поджелудочной железы (Cui Zhou et al., 2022).
В обзоре рассматриваются также молекулярные подтипы PDAC. Так, недавние исследования, сочетающие генетическое и эпигенетическое секвенирование, выявили различные подтипы рака поджелудочной железы на основе их молекулярных сигнатур, но в разных исследованиях сообщается о разных системах классификации.
В недавнем исследовании с использованием транскриптомного анализа первичных культур CAFs, полученных от пациентов с PDAC, идентифицировано по крайней мере четыре подтипа CAFs (Neuzillet et al., 2019). Предложенная авторами классификация CAFs, демонстрирует молекулярную и функциональную меж- и внутриопухолевую гетерогенность CAFs при PDAC человека и свидетельствует о том, что специфический для пациента профиль CAFs может определять гетерогенность межопухолевой стромы (Neuzillet et al., 2019).
В ряде работ показано, что важную роль в инвазии опухолевых клеток и прогрессировании PDAC играет иммунное микроокружение, а характеристики экспрессии иммунитета могут влиять на степень ингибирования раковых клеток (Knudsen et al., 2017; Fabris et al., 2019). Так, Wang et al. разделили когорту PDAC на четыре подтипа на основании обогащения иммунными и стромальными клетками (Wang et al., 2022). В то же время, клеточная гетерогенность TME и различия в методологиях кластеризации оставляет неопределенность в отношении наиболее подходящей классификации PDAC, и, кроме того, клиническое применение этих подтипов на поздних стадиях заболевания неясно (O’Kane et al., 2020). Очевидно, что выявление молекулярных различий между опухолями может быть полезным при стратификации пациентов для адаптации терапии или определения наилучшего лечения путем нацеливания лекарств на подтип опухоли, для которого они избирательно эффективны.
Новость подготовила
© Кузнецова Алла Викторовна,
20.12.2022