https://doi.org/10.1038/s41598-024-62745-1

Область научных интересов: мезенхимные стромальные клетки, гемопоэтические стволовые клетки, их роль в процессах регенерации, экспансия и культивирование на биоматериалах, дифференцировка в различные типы клеток.
На сегодняшний день повышение частоты случаев дегенеративного поражения сердечных клапанов можно расценивать как новую кардиальную «эпидемию». Наиболее эффективным методом лечения болезни клапанов сердца является хирургический метод. Новая стратегия тканевой инженерии направлена на создание каркасов сердечных клапанов, которые могут обеспечить пациентам пожизненное решение проблемы. Каркасы сердечных клапанов служат трехмерной опорной конструкцией, изготовленной из биосовместимых материалов, которые обеспечивают достаточную пористость для заселения клеток, транспортировки питательных веществ и отходов, способствуют адгезии, пролиферации и дифференцировке клеток и позволяют производить внеклеточный матрикс, что, в совокупности, способствует формированию новой функциональной ткани. Были разработаны новые тканеинженерные матрицы человека (чТМ) с высоким потенциалом восстановления и ремоделирования ткани. Чтобы обеспечить положительный эффект при трансплантации чТМ , необходимо улучшить их иммуносовместимость. После имплантации чТМ , моноциты и макрофаги, представляющие собой первую линию защиты, притягиваются к имплантату и реагируют на него каскадом воспалений. В рамках тканевой инженерии in situ макрофаги были определены как ключевые участники начальных стадий ремоделирования тканей. По мере проникновения макрофагов в имплантированный инородный материал, их первоначальная провоспалительная активация является ключом к каскаду адаптивного ремоделирования. После удаления стимуляторов, вызвавших провоспалительную реакцию (белки внеклеточного матрикса и синтетические полимеры), первоначальная реакция макрофагов проходит и за этим следует поляризация макрофагов в сторону противовоспалительного состояния. Таким образом, макрофаги инициируют иммунный ответ и опосредуют ремоделирование чТМ, необходимое для их функционирования. чТМ изготавливались с использованием сетчатого нетканого материала на основе полигликолевой кислоты (PGA) с покрытием из 1% поли-4-гидроксибутиратом (P4HB) , Такой материал подшивали к нитиноловому стенту, затем культивировали и засевали дермальными фибробластами человека (чДФБ) с использованием фибрина в качестве клеточного носителя.
Клетками, используемыми в экспериментах in vitro, чаще всего являются макрофаги, полученные из периферической крови, поскольку они, как известно, управляют процессом ремоделирования и легкодоступны. Однако, эти макрофаги имеют ряд существенных ограничений к исследованию иммуносовместимости из-за вариабельности от донора к донору, которая может приводить к изменению иммунных реакций. Точная роль другого типа макрофагов, тканерезидентных макрофагов (ТРМ), еще не выяснена, хотя они поддерживают гомеостаз нативных тканей. ТРМ представляют собой подмножество макрофагов, которые образуются в результате эмбрионального примитивного транзиторного кроветворения и отличаются от макрофагов, происходящих из периферической крови. Малое количество таких клеток и очень ограниченный донорский материал затрудняет изучение их механизмов, задействованных в процессе ремоделирования тканей. Макрофаги, полученные из индуцированных плюрипотентных клеток человека (чИПСК), могут представлять собой ТРМ подобные клетки in vitro и решить проблему недостатка донорского материала.
В данном исследовании охарактеризована реакция ТРМ подобных клеток при контакте чТМ и показано, что макрофаги, полученные из чИПСК (ИМФ), являются потенциальной моделью ТРМ подобных клеток для оценки иммуносовместимости чТМ. Для этого необходимо было получить предшественники ИМФ из чИПСК и дифференцировать их в ИМФ. Затем нужно было охарактеризовать их с использованием биологических маркеров и дать функциональную оценку потенциала поляризации ИМФ, а также оценить способность ИМФ принимать про- или противовоспалительные фенотипы в ответ на состав чТМ.
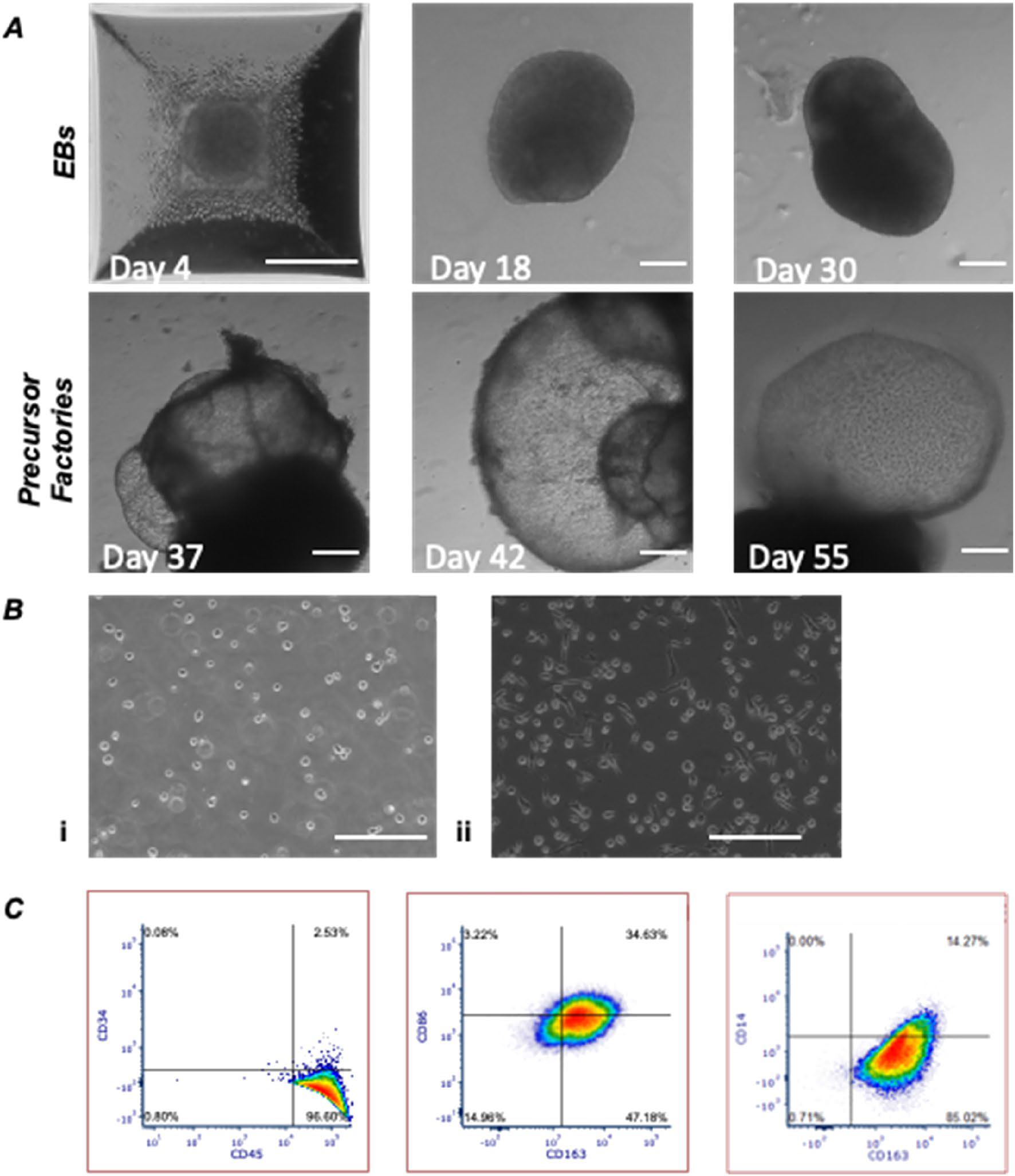
В ходе эксперимента чИПСК были успешно дифференцированы в сторону ИМФ в устойчивом (M0) состоянии, что подтверждалось отсутствием маркеров плюрипотентности (минимальная экспрессия CD34) и наличием специфичных для макрофагов маркеров (CD14, CD45, CD163 и CD86), а также секрецией IL-8В.
Рис.1 Оценка IMΦ с помощью проточной цитометрии после дифференцировки в среде DM в течение 7 дней (n = 3; 50 000 клеток для каждого эксперимента).
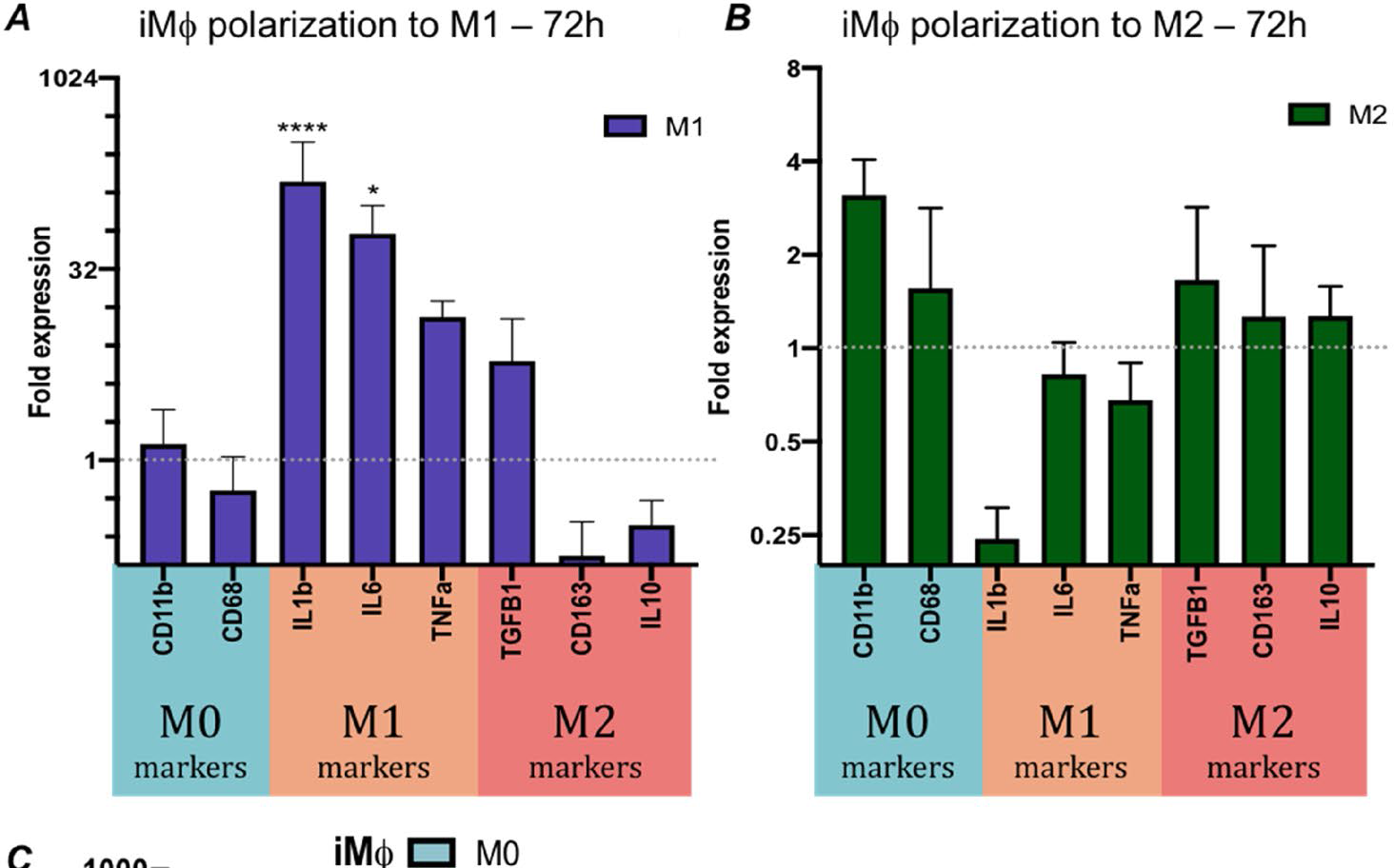
Полученные клетки реагировали на воспалительные сигналы in vitro со значительными изменениями маркеров клеточной поверхности и высвобождением цитокинов, особенно при воздействии провоспалительных факторов. Поляризационные состояния ИМФ могут быть использованы для определения провоспалительной иммуногенности чТМ in vitro. В этом исследовании была изучена поляризационная способность IMΦ, чтобы получить маркеры для идентификации провоспалительной поляризации. Поляризация макрофагов имеет решающее значение для реконструкции чТМ на основе экстрацеллюлярного матрикса (ЭЦМ) in vivo.
Рис.2 А.) Экспрессия генов в IMΦ, поляризованных при стимуляции M1 (LPS/IFN-γ) в течение 72 ч. В.) Поляризация IMΦ при стимуляции M2 (IL-4/ IL-13) в течение 72 ч.)
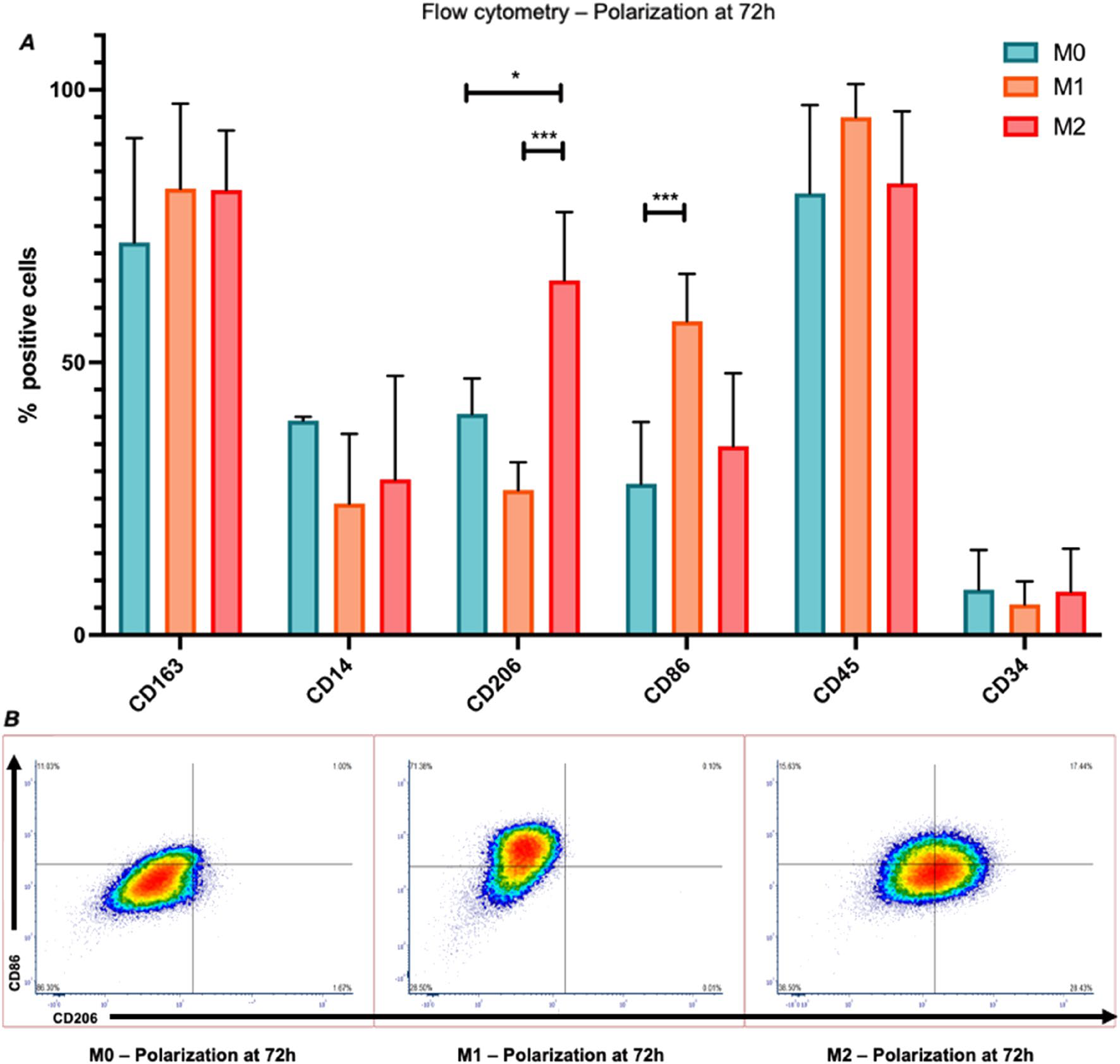
Чтобы оценить, являются ли ИМФ функционально значимыми и могут ли они проявлять чувствительность к различным субстратам, ИМФ подвергали воздействию образцов чТМ in vitro в течение 3 и 7 дней. Образцы чТМ были взяты в три разных временных интервала: через 2 недели (2н), 4 недели (4 н) и 6 недель (6 н) культивирования до заселения ИМФ и охарактеризованы с помощью масс-спектроскопии для определения их протеомного состава. После совместного культивирования с ИМФ в течение 3 и 7 дней проводили проточную цитометрию и иммуноферментный анализ для того, чтобы оценить способность клеток к поляризации в отношении про- и противовоспалительных состояний с выделением соответствующих цитокинов.
Рис.3 Поляризация IMΦ в про- и противовоспалительном состояниях в течение 72 часов. (А) Анализ поверхностных маркеров с помощью проточной цитометрии для оценки поляризации IMΦ после стимуляции M1 или M2 в течение 72 часов по сравнению с неполяризованными M0 клетками (n = 3). (B) Графики плотности неполяризованных и поляризованных IMΦ методом проточной цитометрии (условия M1 и M2 ) для маркеров CD206 (противовоспалительный) и CD86 (провоспалительный), (тест множественных сравнений 2way ANOVA Тьюки, *p-значение < 0,05, ***p < 0,0005).
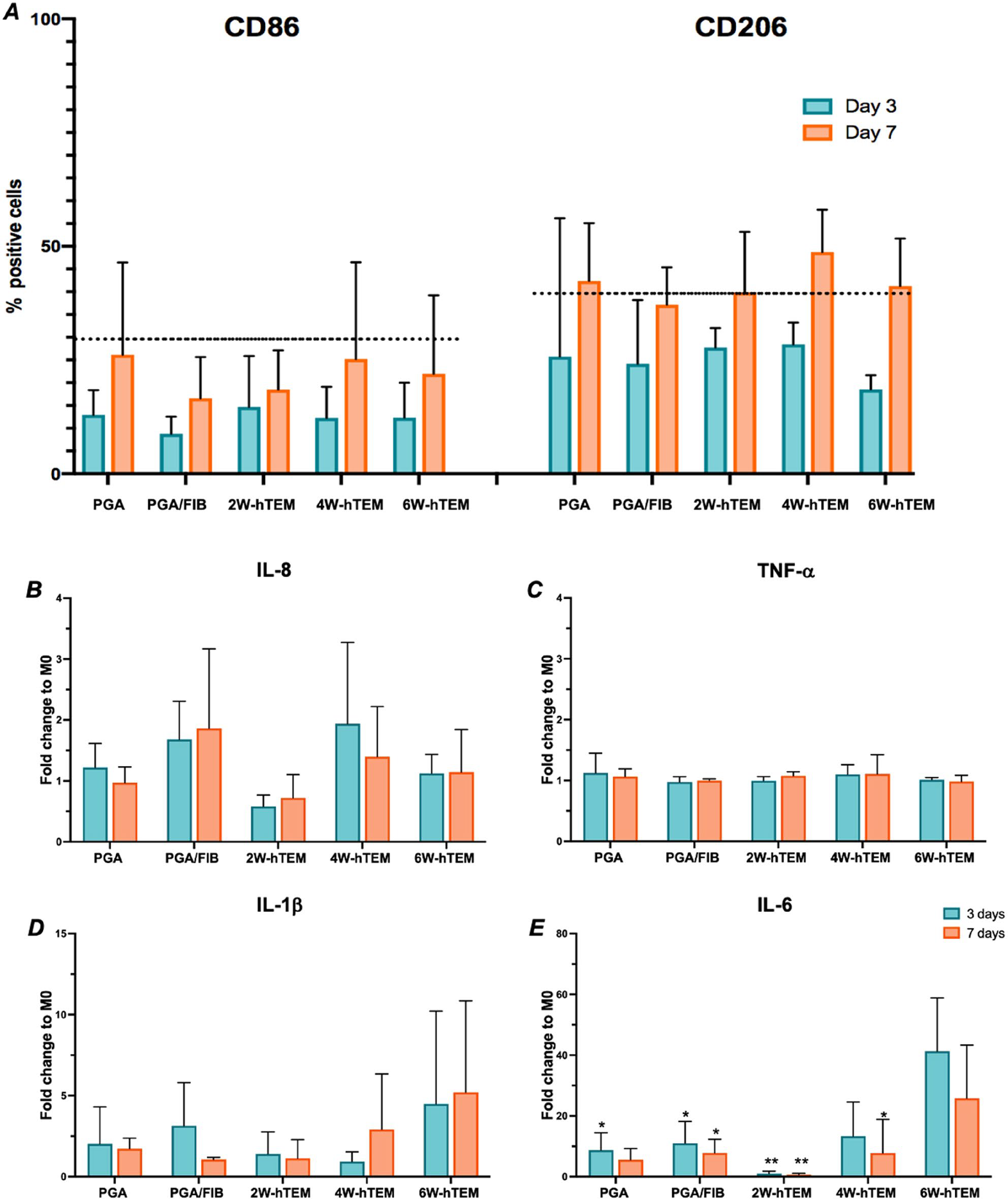
Определение цитокинового профиля ELISA привело к выбору IL-6 и IL-1β в качестве интерлейкинов с наибольшей секрецией из всех протестированных. Оказалось, что уровень секреции IL-6 в контрольных образцах был низким , а но повышался при культивировании чТМ через 2,4 и 6 недель, соответственно. Это позволяет предположить, что IL-6 потенциально может быть ключевым маркером постепенной адаптации IMΦ к провоспалительному состоянию. Согласно полученным данным, IL-8 не такой чувствительный маркер противовоспалительной поляризации, как CD206, поэтому необходимы дальнейшие исследования для выявления других секретируемых противовоспалительных цитокинов, которые могут быть использованы для этой цели.
Рис.4 Оценка иммуногенности.чТМ из PGA/P4HB и бычьего фибрина.Контрольные образцы PGA/P4HB (PGA/FIB) и образцы, полученные при 2нед, 4нед и 6 нед (n = 3 на единицу времени), культивировали с ИМФ (M0) в течение 3 и 7 дней (n = 3 на единицу времени).(А) Анализ с помощью проточной цитометрии (n = 3/момент времени) не выявил существенной разницы в поверхностных маркерах по сравнению сИМФ (M0).(Б–Е) Количественное определение секретируемых цитокинов в супернатантах методом ИФА (n = 3/момент времени, статистика IL-6 по 6-нед через 3 дня.
ИМФ продемонстрировали устойчивую поляризацию и показали в состоянии поляризации характеристики, отличные от макрофагов, полученных из крови. На характеристики ИМФ, культивируемых с помощью чТМ, могут влиять свойства самого чТМ. ЭЦМ, формируемый чТМ, состоит из множества белков и в процессе культивирования меняется на сроках 2, 4 и 6 недель. Изменяется состав структурных компонентов ЭЦМ, таких как коллагены и другие белки, связанные с ЭЦМ, которые обеспечивают механическую целостность материалов, используемых для производства чТМ. С увеличением времени культивирования меняется количественный состав белков, жёсткость матрикса, многие параметры, которые могут повлиять на поляризацию ИМФ, культивируемых с чТМ. В культурах чТМ/ИМФ тенденции секреции IL-6 и IL-1β были нарастающими между 2, 4 и 6-ю недельными чТМ в 3- и 7-дневных культурах ИМФ. IL-6 и IL-1β указывают на своевременное завершение провоспалительной реакции, поскольку IL-6 опосредует переход к невоспалительной (M2) поляризации макрофагов. Таким образом, состав ECM может влиять на секрецию IL-6 и IL-1β.
Проведённое исследование является первым шагом на пути к стандартизации иммуногенных характеристик чТМ. Становится очевидным, что важность определения характеристик чТМ с помощью стандартизированных методов и платформ имеет первостепенное значение для обеспечения безопасного клинического применения тканеинженерных конструкций. Актуальность источника клеток и вырабатываемого ЭЦМ нуждается в дальнейшей оценке в будущих исследованиях. Наравне с изучением поляризационной способности ИМФ при контакте с чТМ , встаёт вопрос о способности этих клеток принимать тканеспецифические фенотипы. Существенным ограничением в применении ИМФ является отсутствие данных in vivo для подтверждения пригодности ИМФ в качестве TPM-подобной клетки. Необходимы дальнейшие исследования с использованием оценки имплантированных чТМ in vivo в качестве заменителей сердечных клапанов, которые позволили бы выяснить значимость ТРМ в ремоделировании чТМ.
Список литературы:
Poulis, N. et al. Tissue engineered heart valves for transcatheter aortic valve implantation: Current state, challenges, and future developments. Expert Rev. Cardiovasc. Ther. 18, 681–696 (2020).
Motta, S. E., Lintas, V., Fioretta, E. S., Hoerstrup, S. P. & Emmert, M. Y. Off-the-shelf tissue engineered heart valves for in situ regeneration: Current state, challenges and future directions. Expert Rev. Med. Devices 15, 35–45. https:// doi. org/ 10. 1080/ 17434 440. 2018. 14198 65 (2018).
Poulis, N. et al. Multiscale analysis of human tissue engineered matrices for heart valve tissue engineering applications. Acta Biomater. 158, 43. https:// doi. org/ 10. 1016/j. actbio. 2023. 01. 007 (2023)
Koch, S. E. et al. Donor heterogeneity in the human macrophage response to a biomaterial under hyperglycemia in vitro. Tissue Eng. C Methods 28, 440–456 (2022).
Hoeffel, G. & Ginhoux, F. Fetal monocytes and the origins of tissue-resident macrophages. Cell Immunol. 330, 5–15 (2018).Gutbier, S. et al. Large-scale production of human IPSC-derived macrophages for drug screening. Int. J. Mol. Sci. 21, 1–23 (2020).
Dijkman, P. E., Driessen-Mol, A., Frese, L., Hoerstrup, S. P. & Baaijens, F. P. T. T. Decellularized homologous tissue-engineeredheart valves as off-the-shelf alternatives to xeno- and homografts. Biomaterials 33, 4545–4554 (2012).
Reimer, J. et al. Implantation of a tissue-engineered tubular heart valve in growing lambs. Ann. Biomed. Eng. 45, 439–451 (2017).
Lee, C. Z. W., Kozaki, T. & Ginhoux, F. Studying tissue macrophages in vitro: Are iPSC-derived cells the answer?. Nat. Rev. Immunol.18, 716–725.
Новость подготовила
Буторина Н. Н.
20.08.2025