Production and transplantation of bioengineered lung into a large-animal model // Science Translational Medicine 01 Aug 2018: Vol. 10, Issue 452, eaao3926 DOI: 10.1126/scitranslmed.aao3926.
 © Калабушева Екатерина Павловна.
Кандидат биологических наук, младший научный сотрудник. Лаборатория клеточной биологии ИБР РАН.
© Калабушева Екатерина Павловна.
Кандидат биологических наук, младший научный сотрудник. Лаборатория клеточной биологии ИБР РАН.
Получение органов, пригодных к трансплантации, полноценно функционирующих и не вызывающих отторжения, вероятно, самая актуальная тема современной клеточной биологии. Одно из перспективных направлений в этой области – метод децеллюляризации – рецеллюляризации. Основные сложности в создании тканеинженерных конструкций связаны с формированием сосудистой сети, необходимой для питания и поддержания ткани. Это особенно важно при реконструкции легких, так как сосуды в этом органе отвечают не только за питание собственной ткани, но должны обеспечивать газообмен всего организма. В данной работе исследователи собрали воедино результаты множества научных коллективов, модернизировали ранее разработанные подходы и успешно создали и пересадили биоинженерное легкое. Особой ценностью этой работы является то, что легкое пересадили крупному животному – свинье без иммунодефицита, что максимально приближает модель к человеку.
Биоинженерный трансплантат получили для четырех животных. За месяц до трансплантации животным проводили пневмоэктомию; удаленное легкое стало источником клеток для создания конструкции. Подготовку аллогенного децеллюляризированного матрикса проводили классическим методом: легкое хранили 30 суток замороженным при температуре -80, далее быстро размораживали, после чего перфузировали 2% раствором детергента (SDS) в течение часа. Полной очистки добивались перфузией 1% раствора детергента в течение нескольких суток. Авторы модифицировали протокол, добавив декстрозу к раствору SDS, что позволило сохранить исходную структуру коллагеновых волокон.
Децеллюляризированный скаффолд предварительно подготавливали к заселению различными клеточными типами. Чтобы добиться максимальной адгезии вносимых клеток и способствовать их выживанию, на небольшом кусочке децеллюляризированного легкого исследовали различные комбинации факторов роста и методов их доставки. В конечном счете, были использованы дискоидальные пористые силиконовые микрочастицы для доставки VEGF и гидрогель для доставки FGF2. Для прикрепления клеток легкого, альвеолоцитов, помимо комбинации факторов роста, субстрат заселяли мезенхимными стволовыми клетками (МСК), M1 и М2 макрофагами, мононуклеарными лейкоцитами, с или без предварительной стимуляции липополисахаридом, а также добавляли среду, кондиционированную всеми вышеуказанными клеточными типами. Исследование скорости прикрепления и пролиферации клеток в кусочке децеллюляризированного легкого показало необходимость добавления гидрогеля с KGF, среды, кондиционированной МСК, М2 макрофагов и среды, кондиционированной М2 макрофагами, для успешного приживления легочного эпителия.
Внесение дискоидальных пористых силиконовых микрочастиц и гидрогеля с факторами роста производили за 2 часа до заселения клетками. В децеллюляризированное легкое вносили следующие клеточные популяции: аквопорин 5 положительные альвеолоциты I типа, просурфактант С-позитивные альвеолоциты II типа. Через легочную артерию добавляли CD31 и VE-кадгерин положительные клетки сосудов. В трахею и бронхи помещали клетки многорядного мерцательного эпителия, положительные по следующим маркерам: пан-цитокератин, кератин 18, Ep-CAM и СС10 (белок клеток Клара-10) Во все отделы легких добавляли SMA и FSP положительные фибробласты. Полученное биоинженерное легкое культивировали в биореакторной системе в течение 30 суток (Рис.1).
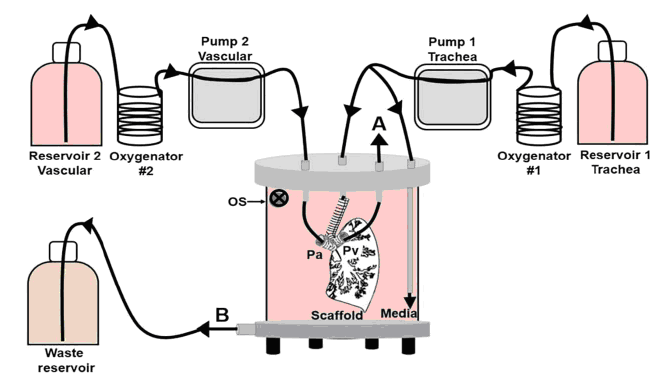
Рисунок 1. Устройство биореактора. OS – датчик кислорода, Pa – легочная артерия, Pv – легочная вена.
Всего в работе использовали 4 животных, которые выводили из эксперимента последовательно через 10 часов, 2 недели, 1 месяц и 2 месяца. Биоинженерное легкое не вызывало отторжения, что подтверждалось низкой концентрацией Il-2 и отсутствием роста CD8+ клеточной популяции.
Компьютерная томография и ангиограмма выявили, что плотность тканей собственного легкого реципиента и биоинженерного легкого примерно одинакова, более того через 2 недели и на более поздних сроках в трансплантате детектировали развивающиеся сосуды. Сравнение транскрипционного профиля собственного и трансплантированного легкого через 30 дней выявило 11,79% генов с подавленной и 15,90% генов с повышенной экспрессией в трансплантате, однако большая часть транскриптома (72,28%) была одинакова в исследуемых группах. Гены с повышенной экспрессией в основном относились к маркерам ангиогенеза, альвеолоцитов I и II типа, а также провоспалительным агентам. Экспрессия генов, типичных для эпителиальных и нейроэндокринных клеток легкого, находилась на сходном уровне.
Для исследования ангиогенеза клетки сосудов перед внесением в скаффолд легкого метили карбоксифлуоресциином, что в дальнейшем позволило выявить их витальным анализом при помощи системы Spectrum. Сосуды были сформированы из собственных клеток биоинженерного легкого, часть меченых клеток нашли в области контакта сосудов животного-реципиента и трансплантата. Исследование парциального давления кислорода в легочной артерии трансплантированного участка выявило обогащенную кислородом, а не венозную кровь. Через 2 недели после трансплантации выявили признаки развивающихся лимфатических сосудов, через месяц после трансплантации эти сосуды были уже сформированы по всему биоинженерному легкому.
Помимо обширного развития сосудов, выявили формирование и эпителиальных тканей легкого. Еще до трансплантации, после 30 суток культивирования в биореакторе отмечали появление развитых альвеолярных участков, тем не менее, оставалось множество неаэрируемых регионов. Стоит отметить, что до трансплантации количество альвеолоцитов II типа значительно превышало содержание альвеолоцитов I типа. После трансплантации нормализовалась аэрация биоинженерного легкого, хотя недоразвитые участки сохранялись. Через 2 недели после трансплантации отмечали повышение содержания альвеолоцитов I типа, через 1 и 2 месяца общее количество всех клеток значительно увеличивалось. Клетки трахеи теряли межклеточные контакты и становились более рассредоточенными через 2 недели после трансплантации, однако через 2 месяца состояние эпителия нормализовалось в большинстве участков. Очаги пролиферации обнаруживали в альвеолах и бронхиолах, однако даже к 2м месяцам их развитие еще не было закончено. Тем не менее, препараты аэрируемых участков биоинженерного легкого были неотличимы от контрольных образцов, полученных из собственного легкого животного-реципиента.
Животное, прожившее с биоинженерным легким 2 месяца, имело осложнение после операционного вмешательства в виде окклюзии дыхательных путей. Собственное правое легкое животного частично сместилось в левую часть грудной клетки, что привело к сдавливанию трансплантата. Сдавливание препятствовало полноценной аэрации и, следовательно, развитию биоинженерного легкого. В трансплантате выявили больше неаэрируемых участков в сравнении с другими аналогичными препаратами, исследованными на более ранних сроках, однако сохранялись полноценно развивающиеся участки.
Отдельной проблемой биоинженерных конструкций, культивируемых в биореакторных системах в течение продолжительного времени, остается контаминация патогенными микроорганизмами. Вероятность инфекций биоинженерного легкого повышается в несколько раз вследствие непосредственного контакта с воздухом после трансплантации. В качестве превентивной меры в искусственное легкое вносили аутологичную сыворотку крови, альвеолярные макрофаги и мононуклеарные лейкоциты.
Бронхоскопия с изучением жидкости, полученной из легких (бронхоальвиолярный лаваж) показала низкое содержание провоспалительных цитокинов как в собственном, так и в биоинженерном легком до трансплантации. У животного, выведенного из эксперимента через 10 часов после трансплантации, проявлялись признаки недиагностированной легочной инфекции. Тем не менее, содержание провоспалительных цитокинов снижалось с увеличением времени, прошедшего после трансплантации. Проводили анализ микробиома трахеи и легочной паренхимы. Уже через 10 часов после пересадки трансплантат был колонизирован бактериями. Однако профиль микробиологических сообществ был нестабилен, выявлялось больше бактериальных мишеней в сравнении с легким реципиента. Количественный ПЦР анализ показал высокий уровень Mycoplasma flocculare, который, вероятно, стал причиной легочной инфекции, которая, в свою очередь, стала причиной вывода этого животного из эксперимента через 10 часов по предписанию этического комитета. Через 2 недели после трансплантации состав микробиома нормализовался, отличия были выявлены только в количественной пропорции разных видов бактерий. На более поздних сроках бактериальные сообщества трансплантата соответствовали аналогичным из здорового легкого.
Целью этого исследования было изучение ранних этапов приживления биоинженерного легкого после трансплантации. Исследователи модифицировали подготовку трансплантата, что позволило простимулировать рост сосудов, альвеолярного эпителия и клеток выстилки трахеи. Биоинженерный конструкт не вызывал иммунного ответа, сохранял исходные размеры и не демонстрировал структурных аномалий. Более того, отмечали оксигенацию крови, проходящей через искусственное легкое, и восстановление микробиоты. Таким образом, исследователи создали платформу для изучения биоинженерных конструкций, полученных методом децеллюляризации – рецеллюляризации. Данная работа является пилотной, проведенной на малом количестве животных. Следовательно, в ближайшем будущем стоит ожидать новых публикаций этого научного коллектива с более продолжительными сроками трансплантации, изучением «созревания» легочной ткани и исследованием функционирования сосудов легких.
Новость подготовила © Калабушева Е.П.
20.08.2018